- 9226
- 7,9
- 5
- 4
Макрофаг атакует раковую клетку


Опухоль и иммунитет — драматический диалог в трех частях с прологом
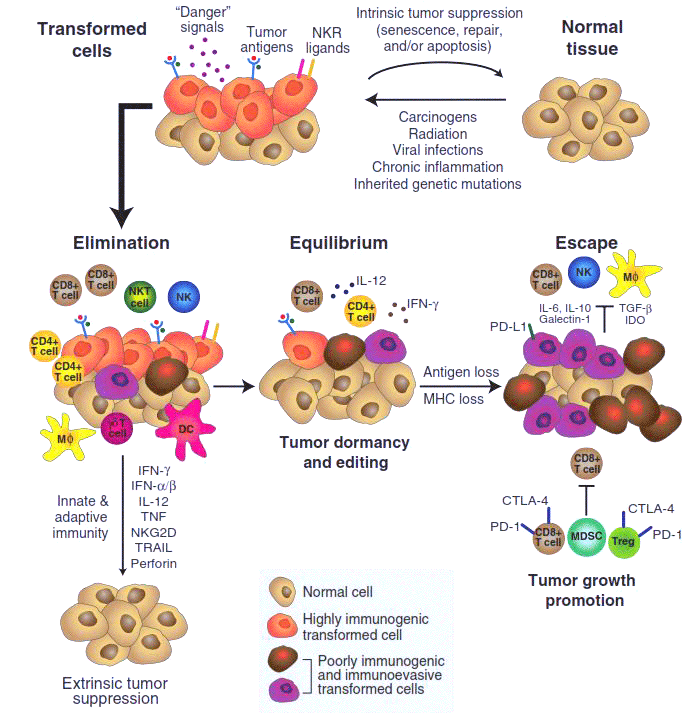
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги, пожалуй, самые знаменитые клетки врожденного иммунитета — именно с изучения их способностей к фагоцитозу Мечниковым и началась классическая клеточная иммунология. В организме млекопитающих макрофаги — боевой авангард: первыми обнаруживая врага, они не только пытаются уничтожить его собственными силами, но также привлекают к месту сражения другие клетки иммунной системы, активируя их. А после уничтожения чужеродных агентов принимаются активно участвовать в ликвидации причиненных повреждений, вырабатывая факторы, способствующие заживлению ран. Эту двойственную природу макрофагов опухоли используют себе на пользу.
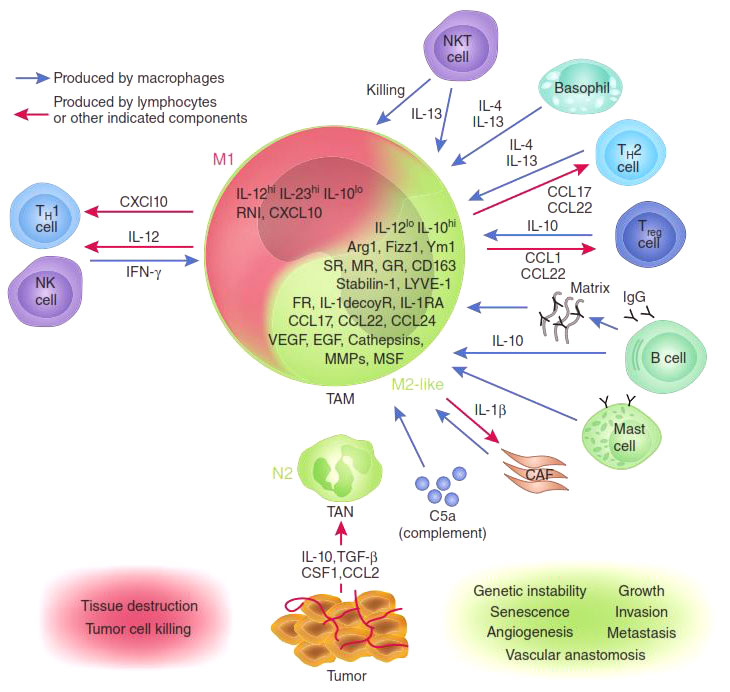
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Неоднозначность ответа на рост злокачественно трансформированных клеток присуща также различным фагоцитирующим клеткам, в частности макрофагам, моноцитам и нейтрофилам.
В этом плане наиболее изучены клетки моноцитарно-макрофагального ряда, а их способность усиливать опухолевую прогрессию известна достаточно давно.
Однако подобно тому, как это имело место в отношении CD4+- и СD8+Т-лимфоцитов, от констатации способности фагоцитирующих клеток усиливать рост опухоли до выяснения механизмов этого процесса прошло достаточно много времени.
Несмотря на то что работ, посвященных выяснению механизма усиления роста опухоли фагоцитирующими клетками, сравнительно немного и основная часть их появилась преимущественно в последние годы, представляется возможным обсуждать различные механизмы, с помощью которых осуществляется это усиление.
К ним, в первую очередь, относятся:
1) индукция воспаления, которое, как известно, может быть фактором риска развития опухоли;
2) усиление ангиогенеза;
3) выделение супрессирующих цитокинов и других факторов, усиливающих рост опухоли;
4) трансформация клеток, способных участвовать в стимуляции роста опухоли в определенный фенотип.
Макрофаги, моноциты
Как отмечено выше, макрофаги так же, как и другие фагоцитирующие клетки, особенно нейтрофилы, участвуют в реализации различных воспалительных реакций. Несмотря на то что определенный уровень интенсивности воспаления во многих случаях — реакция адаптации, в последнее время все чаще и чаще появляются данные о том, что воспаление — фактор риска развития опухоли.
В настоящее время появилась возможность рассматривать молекулярные и клеточные основы воспаления и те его компоненты, которые могут способствовать развитию опухоли.
Продукты, выделяемые указанными клетками в процессе воспаления, в частности реактивные кислородные радикалы, простагландины, лейкотриены, различные ростовые факторы и другие биологически активные вещества, могут приводить к повреждению передачи сигнала трансдукции пролиферирующим клеткам и способствовать развитию опухоли. Более того, высказывается точка зрения, что макрофаги могут быть необходимы для развития опухоли.
При изучении роли макрофагов в опухолевом процессе, как отмечено ранее, преимущественно использовались макрофаги, инфильтрирующие опухоль, что обусловлено вполне понятными причинами.
Согласно современным представлениям, макрофаги, которые проходят сложный путь от циркуляции в кровяном русле до инфильтрации опухоли и непосредственно взаимодействуют с опухолевыми клетками, — очень важный информативный объект изучения взаимодействия с опухолевыми клетками.
Функции макрофагов, инфильтрирующих опухоль, прямо зависят от микроокружения, включая цитокины и гипоксию. Поэтому в высшей степени обоснована необходимость выяснения особенностей функционального состояния, фенотипа макрофагов и молекулярных основ, которые определяют этот фенотип.
Возможное сочетание инфильтрации опухоли макрофагами и плохого прогноза зависит от ряда причин. К их числу относится способность макрофагов продуцировать цитокины, которые участвуют в стимуляции роста опухоли, усиливая прежде всего ангиогенез и воспаление.
При исследовании биопсийного материала рака молочной железы и кишечника наблюдалась экспрессия мРНК VEGF-A и VEGF-C, но не VEGF-E или VEGF-D макрофагами, которые при добавлении опухолевых клеток в культуру, содержащую и полиморфноядерные клетки, начинали секретировать VEGF.
В системе in vivo отмечено, что продукция VEGF, усиление ангиогенеза и инфильтрация макрофагами ассоциируется с усилением роста опухоли, а также значительным увеличением количества антител против опухолеассоциированных антигенов.
Наличие таких клеток, как тучные и макрофаги, участвующих в воспалении, наблюдалось при аденокарциноме поджелудочной железы. Эти клетки в значительно большем, чем в нормальных тканях, количестве находились в участках роста опухоли и метастазов в лимфатические узлы, экспрессировали VEGF-A, VEGF-C и EGFP (во многих случаях эти цитокины экспрессировали и опухолевые клетки).
Поскольку авторы исследований наблюдали экспрессию указанных цитокинов и инфильтрацию моноцитами, макрофагами и при хроническом панкреатите, они отметили, что при хроническом панкреатите также происходит инфильтрация этими клетками. По их мнению, это создает благоприятный фон для перехода в злокачественное новообразование.
Роль макрофагов в развитии гепатоцеллюлярной карциномы констатируют и другие авторы, которые наблюдали продукцию VEGF макрофагами и эндотелиальными клетками, активацию тромбоцитов тканевым фактором, что сочеталось с аномальным ангиогенезом, в частности артериализацией печеночных синусоидов.
Однако продукция макрофагами не только VEGF, но и других цитокинов способствует ангиогенезу. При исследовании макрофагов, инфильтрирующих карциному пищевода, было показано, что их взаимодействие с опухолевыми клетками приводит к продукции такого хемоаттрактанта, как МСР-1 и экспрессии рецептора CCR-2.
В этих условиях опухолевые клетки также секретировали VEGF, а уровень инвазии, неоваскуляризации и количество макрофагов были существенно выше в МСР-1-положительных опухолях. Авторы пришли к заключению, что МСР-1, продуцируемый макрофагами, может играть роль в прогрессии карциномы пищевода.
Активная инфильтрация макрофагами наблюдается и в строме, что установлено при изучении образцов немелкоклеточного рака легкого. В этих случаях инфильтрация макрофагами сочеталась с инфильтрацией лимфоцитами.
Многие макрофаги продуцировали IL-1в, IL-la, TL-6, TNFa и TGFP, однако уровень их продукции был незначительным при высоком уровне PDGF. Важный факт, установленный в этих исследованиях, состоит в том, что лимфоциты инфильтрирующие опухоль (ЛИО) проявляли слабую способность к цитотоксичности, и это было связано не только с тем, что опухолевые клетки экспрессировали низкий уровень антигенов I класса главного комплекса гистосовместимости (ГКГ), но и с тем, что низкий уровень продукции цитокинов макрофагами ограничивал цитотоксичность цитотоксических лимфоцитов (ЦТЛ).
Наряду с этим инфильтрация макрофагами способствовала опухолевой прогрессии, влияя на строму и ангиогенез, что в основном, как уже указывалось, было связано с выделением PDGF и происходило на фоне выделения опухолевыми клетками TGFв.
Зависимость между инфильтрацией макрофагами и микроциркуляцией изучали и при увеальной меланоме, которая, как известно, характеризуется быстрым метастазированием в печень.
При исследовании образцов метастазов выявлено, что они имеют значительно более низкий уровень пигментации, большее число эпителиоидных клеток, СD68-положительных макрофагов и высокую плотность васкуляризации по сравнению с первичными меланомами.
Отмечено, что наличие эпителиоидных клеток и плотность васкуляризации увеличиваются при переходе в метастазы параллельно с усилением пигментации и инфильтрацией макрофагами, что изменяет морфологический тип опухоли.
Эти новые данные раскрывают еще один важный аспект — наличие макрофагов, инфильтрирующих опухоль, связано не только с ангиогенезом, но и с формированием определенного морфологического типа опухоли.
Зависимость образования микрососудов от инфильтрации макрофагами изучали также при доброкачественных лимфоаденопатиях и неходжкинских лимфомах. На основании иммуногистохимических и электронно-микроскопических исследований удалось установить связь между образованием микрососудов и наличием макрофагов — факт, который подтверждает, что при неходжкинских лимфомах, как и при различных солидных опухолях, макрофаги способствуют усилению ангиогенеза, что приводит к прогрессии роста опухоли.
Как уже отмечено, одним из механизмов участия макрофагов в стимуляции роста опухоли является их способность выделять различные факторы. В частности, макрофаги могут способствовать усилению выделения клетками меланомы фактора ингибиторной активности меланомы (melanioma inhibitiry activity — MIA), который ингибирует фиксацию клеток меланомы к экстрацеллюлярному матриксу, усиливая инвазию.
При изучении клеток меланомы сосудистой оболочки глаза линии HUMCL в системах in vitro показано, что действительно макрофаги секретируют факторы, которые могут стимулировать клетки меланомы к усилению продукции MIA.
Известно, что моноциты и макрофаги — клетки, которые могут активно взаимодействовать с другими типами клеток. Такая способность необходима для поддержания нормального иммунологического гомеостаза. К сожалению, в условиях роста опухоли эти межклеточные взаимодействия могут приводить к противоположному эффекту — усилению ее роста.
В частности, в опытах с перевивной рабдомиосаркомой показано, что по мере развития опухоли начинает формироваться опухолеассоциированная супрессия, которая достигает максимума на этапе наиболее выраженного роста опухоли. Исследования, направленные на выяснение вопроса, какие же клетки формируют эту супрессию, показали, что ее морфологическую основу составляют макрофаг-лимфоцитарные агрегаты.
Это было подтверждено опытами с адоптивным переносом таких макрофаг-лимфоцитарных агрегатов, которые способствовали выраженному усилению роста опухоли после перевивки опухолевых клеток интактным животным. В последующем были получены данные о том, что макрофаги способны образовывать конъюгаты с Т-лимфоцитами при участии антител или иммунных комплексов.
В свете этих данных вызывает большой интерес новая информация о том, что опухолевые клетки могут образовывать конъюгаты с макрофагами, инфильтрирующими опухоль, и эта форма взаимодействия играет роль в опухолевой прогрессии и инвазии.
Соответствующие данные были получены при исследовании клеток молочной железы, которые экспрессируют эндотелины (ЕТ-1, ЕТ-2 и ЕТ-3) и их рецепторы (ET-RA и ET-RB), что способствует усилению хемотаксиса опухолевых клеток. Этот процесс взаимодействия опухолевых клеток и макрофагов сопровождается увеличением продукции макрофагами ММП-2 и ММП-9 и усилением инвазии.
Взаимодействие макрофагов с другими клетками
Взаимодействие макрофагов с другими клетками, в частности гранулоцитами, также может способствовать инвазии и метастазированию, что происходит на фоне деградации матрикса и усиления ангиогенеза. В опытах, в которых были созданы соответствующие условия, установлено, что в этом взаимодействии существенную роль играет появление иммунных комплексов, которые также способствуют усилению деградации матрикса и ангиогенеза.
Представления о способности макрофагов участвовать в усилении роста опухоли расширяются благодаря информации о том, что макрофаги, инфильтрирующие опухоль, могут вызывать апоптоз Т-клеток, что приводит к элиминации активированных специфических Т-лимфоцитов внутри опухоли.
Такие данные получены на моделях различных опухолей мышей, при этом отмечено, что инфильтрирующие опухоль макрофаги выделяют TNFa, экспрессируют I и II типы рецепторов TNF и при контакте с ЦТЛ индуцируют выделение IFNy, продукцию NO. Киллинг Т-лимфоцитов мог быть блокирован in vitro антителами против IFNy, TNFa и указанных рецепторов.
При изменении условий эксперимента (использование мышей, дефицитных по рецепторам TNF) не наблюдали ни апоптоза, ни продукции NO. Механизм апоптотического действия не был связан с системой Fas/FasL, так как применение соответствующих антител не влияло на макрофагозависимый лизис Т-лимфоцитов.
Не меньший интерес представляют данные о том, что супернатанты макрофагов, добавленные в культуру опухолевых клеток человека и мышей, активно усиливают пролиферацию, интенсивность которой не изменяется после удаления супернатантов и добавления свежей среды — факт, который нуждается в дальнейшем изучении. На рис. 65 представлены пути включения макрофагов в стимуляцию роста опухоли.

Рис. 65. Пути участия макрофагов в стимуляции роста опухоли при их взаимодействии с опухолевыми клетками
Несмотря на приведенную информацию, имеются отдельные сообщения, авторы которых оставляют открытым вопрос о возможности участия макрофагов в усилении роста опухоли. Такой точки зрения придерживаются исследователи, изучавшие роль макрофагов на моделях опухолей головного мозга, в частности глиомы и астроцитомы, активно инфильтрируемых макрофагами.
На модели астроцитомы, индуцированной клетками линии CNS-1, показано, что клетки этой опухоли активно продуцируют хемоаттрактант клеток моноцито-макрофагального ряда — МСР-1, постоянно экспрессируют TGFp, а в опухолях in vivo было выявлено большое количество различных цитокинов (IL-la, IL-lв, TNFa, TNFp, IL-10, IFNy).
Констатация того, что клетки астроцитомы могут продуцировать хемотаксические факторы, свидетельствует, что они способны привлекать макрофаги в участки развития опухоли. Однако, по мнению авторов, роль макрофагов в усилении роста опухоли нуждается в дальнейшем изучении.
В связи с нередким сочетанием плохого прогноза с инфильтрацией опухоли макрофагами, продуцирующими хемоаттрактанты, можно понять попытки новых подходов к терапии.
Один из них — применение антагонистов рецепторов хемокинов и его перспективность продемонстрирована на модели рака молочной железы мышей, клетки которой активно продуцируют RANTES, инфильтрированы макрофагами и лейкоцитами, экспрессирующими рецепторы для этих хемокинов. Примение указанного антагониста замедляло развитие опухоли и снижало уровень инфильтрации макрофагами.
Предположение о том, что не все макрофаги, а лишь их определенный клон, могут способствовать инвазии и прогрессии опухоли, начинает получать подтверждение. На модели рака мочевого пузыря установлено, что макрофаги, инфильтрирующие опухоль, продуцируют домен эндотелиального белка (endothelial Per-ARNT-Sim domen protein-1 — EPAS-1), который индуцирует гипоксию и трансактивацию генов, включающихся в ангиогенез и метаболизм.
Авторы показали, что не все инфильтрирующие макрофаги, а лишь их небольшая часть экспрессируют EPAS-1 и именно эти клетки способствуют прогрессии рака мочевого пузыря.
Из этого следует, что при инвазивном раке мочевого пузыря оценка не общего количества инфильтрирующих макрофагов, а лишь определенной их части может быть важна для прогностического значения; появление ERAS-1-положительных макрофагов было связано с уменьшением выживаемости.
Реальность того, что макрофаги, инфильтрирующие опухоль, представлены различными субпопуляциями, подтверждается данными изучения многих опухолей. Проведенные исследования свидетельствуют, что опухолевое микроокружение (опыты in vitro) существенно влияет на дифференцировку и активацию макрофагов, культивируемых с опухолевыми клетками.
В результате культивирования изменяются фенотип макрофагов, их активность; такие макрофаги характеризуются низкой экспрессией дифференцировочных антигенов и признаками постоянной активации.
Поскольку не только в различных опухолях, но и в пределах одной и той же опухоли разные ее участки могут иметь и разное микроокружение, становится вполне реальным наличие в опухоли макрофагов с разным фенотипом и различным влиянием на рост опухоли.
Неоднозначная роль макрофагов в опухолевом процессе объясняется и новыми фактами на уровне генетической регуляции. Так, имеется доказательство того, что гибриды, полученные от генетически близких макрофагов и слабоиммуногенных клеток меланомы линии S91, обладают различным метастатическим потенциалом — от слабого до высокого.
Сравнение экспрессии генов, ассоциированных с метастазами, гибридными клетками, с родственными клетками меланомы и нормальными макрофагами показало выраженные различия в экспрессии генов: в одних случаях наблюдалось усиление, в других — ослабление. Такую гибридную модель авторы рассматривают как уникальную для изучения генов, формирующих метастатический фенотип.
В свете изложенных данных и учитывая различные точки зрения не должна вызывать удивления постановка вопроса о том, что макрофаги, инфильтрирующие опухоли, необходимы для ее развития, прежде всего в связи с продукцией хемоаттрактантов.
В опытах, проведенных на мышах, дефицитных по макрофагам, показано, что их отсутствие не влияет ни на частоту возникновения, ни на характер роста первичных опухолей, но снижает уровень прогрессии и ингибирует метастазирование.
Понять эти данные могут помочь представления о функциях макрофагов, в частности их участии в воспалении, ремоделировании матрикса, ангиогенезе, продукции различных факторов.
Все эти функции макрофаги реализуют при воспалении, а это предполагает, что воспаление, индуцированное острой или персистирующей инфекцией, а также другими факторами, может быть важным в генезе и усилении роста опухолей.
Понимание причин участия макрофагальных клеток в стимуляции роста опухоли довольно сложно, так как в отличие от CD4+- и СD8+Т-лимфоцитов, среди которых выделены фенотипы клеток с выраженным супрессорным действием, утверждать, что такие клоны есть в общей популяции макрофагов, в настоящее время нет достаточных оснований.
Можно предполагать возможность трансформации макрофагов в клон клеток, обладающих способностью усиливать рост опухоли, однако еще неясно, какие условия этому способствуют и какими свойствами характеризуются эти клетки. Весьма реальны предположения, высказываемые A. Mantovani и соавторами, согласно которым в ответ на различные сигналы, поступающие из окружающей среды, макрофаги могут реализовывать разные программы.
Соответственно этим программам может происходить поляризация макрофагов на I и II типы — процесс, который происходит с участием цитокинов, выделяемых Т-лимфоцитами и опухолевыми клетками.
С использованием мышей, у которых преобладают активности Тh1- или Тh2-лимфоцитов, показано, что у мышей с выраженным ответом Тh1-лимфоцитов преобладают макрофаги М1, которые характеризуются преимущественно секрецией NO, а при преобладании активности Тh2-лимфоцитов — макрофаги М2, отличающиеся преимущественно продукцией TGFp.
В такой поляризации макрофагов центральная роль принадлежит IL-2. Макрофаги I типа способны повышать экспрессию В7.1 и В7.2, в то время как М2 ослабляют экспрессию этих ко-стимулирующих молекул.
Опухолевые клетки при их взаимодействии с макрофагами могут по-разному влиять на функции последних благодаря выделению различных молекул с регуляторной активностью. Одно из проявлений такого влияния — деактивация функций макрофагов и последующее ослабление противоопухолевой защиты.
Изложенные данные, показывают, что макрофаги, наряду с активным участием в противоопухолевой защите (соответствующие факты представлены выше), способны стимулировать рост опухоли. Такое их действие, которое некоторые авторы склонны называть парадоксальным, нуждается в ответе на вопрос, чем же определяется неоднозначность действия макрофагов.

Мастопатия, рак груди являются достаточно распространенными заболеваниями.
Для выявления наличия патологических процессов в молочных железах проводится ряд обследований, среди которых – цитологический анализ. Иногда результат показывает наличие моноцитов. Многих женщин это пугает и настораживает.
Важно понимать, что означают макрофаги в молочных железах.
Функционирование макрофагов

Макрофаги (или созревшие моноциты) – это разновидность белых клеток крови. Вместе с монобластами, промоцитами они образуют систему мононуклеарных фагоцитов. Это иммунные клетки.
Они жизненно необходимы для стимуляции работы неспецифических защитных механизмов организма. Их активизация приводит к поглощению внутриклеточных патогенов: Listeria, Mycobacterium tuberculosis, Toxoplasma, Leishmania, Streptococcus pneumoniae и т.п.
Уничтожение таких болезнетворных агентов зависит от продукции оксида азота и перекиси водорода. Макрофаги присутствуют практических во всех тканях организма, в том числе и в молочных железах. Их главная роль заключается в очистке организма от поврежденных, раковых и мертвых клеток, элементов, бактерий и прочих патогенных тел.
Процесс, в ходе которого макрофаги поглощают и обезвреживают нездоровые ткани, называется фагоцитозом. Макрофаги принимают участие в поддержании адаптивного и клеточного иммунитета. Они получают информацию о чужеродных антигенах и передают ее лимфоцитам. Благодаря этому иммунной системе удается лучше справляться с патологическим процессом.
Также макрофаги принимают участие в следующих важных функциях организма:

- заживление ран;
- гомеостаз;
- прекращение иммунных реакций;
- производство гормональных веществ.
Иммунные клетки способны находиться в спокойном или активированном виде, последнее состояние провоцирует:
- компоненты комплемента (сложных белков, которые постоянно присутствуют в составе крови);
- бактериальные продукты (ЛПС);
- прилипание к разным поверхностям;
- цитокины.
Активированные макрофаги отличаются от пассивных по ряду морфологических признаков, например:

- повышается способность к адгезии;
- увеличение цитотоксической активности;
- большой размер;
- деградация захваченных частиц;
- образование продуктов частичного восстановления кислорода;
- повышенная секреция монокинов, лизосомных ферментов;
- активная экспрессия разных рецепторов (к цитокинам ИЛ-1, 2, 6, трансферрину, ФНО).
Диагностика
Для определения наличия и количества иммунных тел в молочных железах проводится цитологическое исследование. Этот вид диагностики направлен на оценку и изучение клеток. Он отличается высокой точностью, эффективностью. Материал для обследования получают путем пункционной биопсии.

Цитологическая диагностика позволяет увидеть динамику изменений морфологии на уровне клеток во время болезни, а также лечения без лишних оперативных вмешательств.
Поэтому такой тип исследования дает возможность оценить эффективность проводимой терапии. Цитологический метод диагностики доступен в финансовом плане.
Благодаря этому сделать анализ может любая женщина, попавшая в группу риска появления рака и прочих патологий молочных желез. Задача лаборанта заключается не только в изучении добытого материала, но и в определении, анализе состава выявленных макрофагов.
В таких иммунных клетках обычно присутствуют остатки либо фрагменты перевариваемых либо переваренных патогенов. Если у лаборанта получается узнать, что находится внутри белых клеток крови, то это дает возможность специалисту сделать определенные выводы о типе и форме протекания болезни, имеющейся у женщины.
Наличие в иммунных клетках гемосидерина говорит о присутствии в женской груди полости с кровью. Это возможно при посттравматических изменениях. Также макрофаги с гемосидерином наблюдаются при определенных формах мастопатии.
При обнаружении большого количества макрофагов в груди проводится дополнительное обследование. Дифференциальная диагностика болезней молочных желез позволяет своевременно и правильно выявить тип и форму патологии.
Расшифровка
Важно не только правильно проведенное цитологическое исследование, но и грамотная расшифровка результатов. Трактовку анализов проводит врач. Самая благоприятная картина наблюдается при интерпретации результатов нормы. Исследуемые ткани молочных желез в этом случае не содержат аномальных клеток, воспаления, дополнительных включений.

Нередко при цитологическом исследовании выявляется доброкачественный состав клеток опухоли. Если в анализируемом материале обнаруживаются макрофаги, нейтрофилы, гистиоциты (вид макрофагов, которые у здоровых людей присутствуют в соединительной ткани), то это говорит о протекании воспалительного процесса. Распространенным диагнозом у женщин является фиброзно-кистозная болезнь молочных желез.
Поражение характеризуется изменениями строения паренхимы, стромы, образованием кистозных элементов. Стимулом для развития патологического процесса выступает дисбаланс гормонов.
В результатах гистологического обследования при наличии фиброзно-кистозного мастита присутствуют такие изменения:
- единичные пенистые макрофаги;
- ксантомные клетки;
- признаки внутрипротоковой пролиферации эпителия разной выраженности;
- голоядерные клетки.
Норма или патология
Наличие макрофагов в цитологическом исследовании молочных желез может быть нормой и патологией. Все зависит от количества данных иммунных клеток и их состава.
Если же данных клеток очень много и их состав не соответствует норме, то это свидетельствует о протекании патологического процесса. Большое скопление макрофагов говорит о том, что присутствует болезнетворная микрофлора, организму есть с чем бороться.
Это может быть воспаление, доброкачественное либо злокачественное образование. Для постановки диагноза проводятся дополнительные обследования (например, УЗИ, КТ, МРТ и т.п).
Видео по теме
О диагностике заболеваний молочных желез в видео:
Таким образом, макрофаги – это иммунные клетки, которые призваны бороться с патологической микрофлорой и токсинами. При возникновении воспаления, рака и прочих нарушений данные тельца активизируются и начинают поглощать, уничтожать болезнетворные элементы.
Для выявления количества белых клеток в молочных железах, проводится цитологическое исследование материала взятого в ходе биопсии. Расшифровкой результата диагностики занимается врач. Важно помнить, что макрофаги присутствуют и у полностью здоровых пациенток. О наличии заболевания судят по количеству данных элементов и их составу.
