Лучевая терапия с середины 20 века стала рассматриваться в качестве альтернативы классическому хирургическому методу и активно изучаться. Ведь при большинстве операций не удается избежать повреждений сосудистых и нервных структур, находящихся рядом с предстательной железой. Это приводит к осложнениям: недержанию мочи (после операции от этого страдает каждый 5-й пациент) и импотенции.
Облучение опухоли простаты способствует достижению длительного контроля над ней и даже излечению от заболевания, помогает избежать неприятных побочных эффектов.
Методики лучевой терапии при раке простаты
Многочисленные исследования, посвященные лучевой терапии простаты, показали, что для стойкого излечения от опухоли необходимо воздействие высокой дозы излучения (100Гр-140Гр).
При дистанционной лучевой терапии сложно обеспечить ее точное подведение к пораженной простате. Это, с одной стороны, приводит к тому, что у одних больных не удается достигнуть стойкого контроля над опухолью, а у других — излечение сопровождается повреждением прилегающих к предстательной железе органов – прямой кишки, мочевого пузыря.
Кроме того, необходима очень длительная дистанционная лучевая терапия, лечение рака простаты должно проходить ежедневно, на протяжении 8-10 недель.

Брахитерапия — один из самых востребованных радиологических методов, так называют облучение с высокой избирательностью подведения дозы.
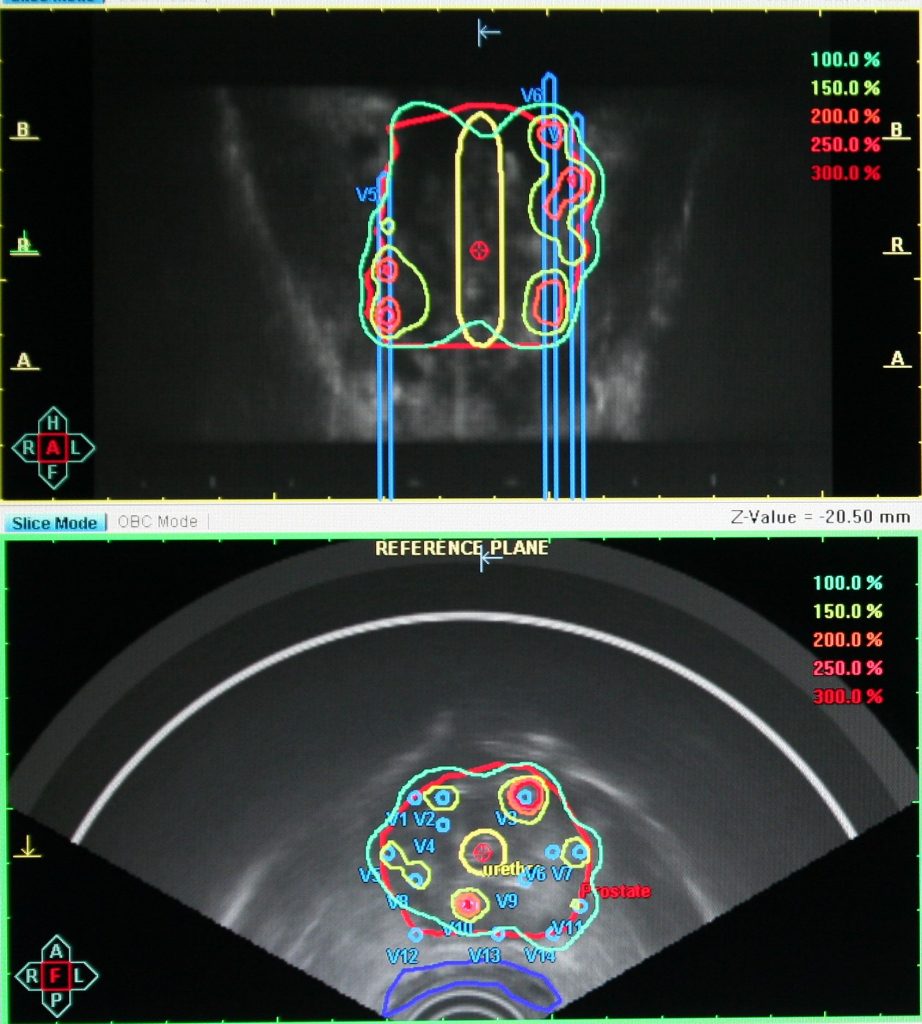
Это позволяет бороться с опухолью высокими дозами (100Гр-140Гр и выше), избегая повышенного риска лучевого поражения здоровых тканей.
Оно может выполняться даже больным с серьезной сопутствующей патологией, например, перенесшим инфаркт миокарда, с облитерирующими заболеваниями сосудов и т.д.

Дозы облучения, как правило, ниже, чем при высокодозной брахитерапии. Поэтому стереотаксическая лучевая терапия чаще используется при лечении пациентов с наиболее благоприятно протекающим ранним раком предстательной железы.
НИИ онкологии им. Н.Н. Петрова — одно из ведущих лечебных учреждений России, занимающееся излечением от рака предстательной железы.
Институтом накоплен опыт хирургического и лекарственного лечения, проведено более 400 сеансов высокодозной брахитерапии рака предстательной железы, десятки сеансов стереотаксической лучевой терапии. Лечение осуществляется в рамках государственной федеральной программы, бесплатно для граждан России.


Авторская публикация:
НОВИКОВ СЕРГЕЙ НИКОЛАЕВИЧ
радиолог, онколог, радиотерапевт
ведущий научный сотрудник, заведующий отделением
НИИ онкологии им Н.Н. Петрова
Аннотация научной статьи по клинической медицине, автор научной работы — Воробьев Н.А., Мартынова Н.И., Михайлов А.В., Гуцало Ю.В., Кубасов А.В.
Введение. В последнее десятилетие отмечается значительный рост числа пациентов, подвергающихся лучевой терапии по поводу рака предстательной железы (РПЖ). Это объясняется созданием нового оборудования, способного значительно повысить эффективность облучения при уменьшении частоты и выраженности побочных явлений. Активное изучение новых режимов фракционирования привело к появлению метода стереотаксической лучевой терапии (СтЛТ). В работе представлены результаты собственного опыта применения методики СтЛТ у пациентов с локализованным РПЖ.Материалы и методы. В исследование включены 48 пациентов. Облучение осуществляли с применением роботизированной радиохирургической системы кибер-нож. Предписанная суммарная очаговая доза за 5 фракций составила 36,25 Гр.Результаты. При медиане наблюдения 24 мес 4-летняя безрецидивная выживаемость по уровню простатического специфического антигена составила 95,8 %, медиана надира по уровню простатического специфического антигена – 0,48 нг/мл. Ранних и поздних нежелательных явлений III–IV степеней тяжести не отмечено.Заключение. Представленные результаты применения СтЛТ при локализованном РПЖ свидетельствуют о высоком уровне биохимического контроля, сравнимом с таковым при использовании других видов терапии, а также о наличии сопоставимой, а в некоторых случаях меньшей, токсичности.
Похожие темы научных работ по клинической медицине , автор научной работы — Воробьев Н.А., Мартынова Н.И., Михайлов А.В., Гуцало Ю.В., Кубасов А.В.
Stereotactic body radiation therapy for clinically localized prostate cancer
Background. In the last decade, we observed a significant increase in the number of patients undergoing radiotherapy for prostate cancer (PC). It became possible with the development of new equipment that can significantly increase radiation efficiency and reduce the frequency and severity of side effects. Active investigation of new fractionation regimens led to the development of stereotactic radiotherapy (StR) technique. In this article, we describe our own experience of using StR in patients with localized PC.Material and methods. The study included 48 patients treated with CyberKnife robotic radiosurgery system. The patients received a total dose of 36.25 Gy delivered in 5 fractions.Results. At a median follow-up of 24 months, the estimated four-year prostate-specific antigen (PSA) relapse-free survival rate was 95.8 %. The median PSA nadir was 0.48 ng/mL. We observed no grade III–IV side effects (either early or late).Conclusion. Our results suggest that the use of StR allows achieving good biochemical control comparable to that achieved by other methods and demonstrates comparable and sometimes even lower toxicity.
Стереотаксическая лучевая терапия при локализованном
раке предстательной железы
Н.А. Воробьев1-3, Н.И. Мартынова1, А.В. Михайлов1, Ю.В. Гуцало1, А.В. Кубасов1
Россия, 191015Санкт-Петербург, ул. Кирочная, 41
Контакты: Николай Андреевич Воробьев vorobyovofficial@gmail.com
Введение. В последнее десятилетие отмечается значительный рост числа пациентов, подвергающихся лучевой терапии по поводу рака предстательной железы (РПЖ). Это объясняется созданием нового оборудования, способного значительно повысить эффективность облучения при уменьшении частоты и выраженности побочных явлений. Активное изучение новых режимов фракционирования привело к появлению метода стереотаксической лучевой терапии (СтЛТ). В работе представлены результаты сч собственного опыта применения методики СтЛТ у пациентов с локализованным РПЖ.
Материалы и методы. В исследование включены 48 пациентов. Облучение осуществляли с применением роботизированной радиохирургической системы кибер-нож. Предписанная суммарная очаговая доза за 5 фракций составила 36,25 Гр. Результаты. При медиане наблюдения 24мес 4-летняя безрецидивная выживаемость по уровню простатического специфического антигена составила 95,8 %, медиана надира по уровню простатического специфического антигена — 0,48нг/мл. Ранних и поздних нежелательных явлений III—IVстепеней тяжести не отмечено.
Заключение. Представленные результаты применения СтЛТ при локализованном РПЖ свидетельствуют о высоком уровне биохимического контроля, сравнимом с таковым при использовании других видов терапии, а также о наличии сопоставимой, а в некоторых случаях меньшей, токсичности.
Ключевые слова: рак предстательной железы, стереотаксическая лучевая терапия, гипофракционирование, кибер-нож, радиохирургия
Для цитирования: Воробьев Н.А., Мартынова Н.И., Михайлов А.В. и др. Стереотаксическая лучевая терапия при локализованном раке предстательной железы. Онкоурология 2018;14(2):122—9.
Stereotactic body radiation therapy for clinically localized prostate cancer
N.A. Vorobyov1-3, N.I. Martynova1, A.V. Mikhailov1, Yu.V. Gutsalo1, A.V. Kubasov1
Medical and Diagnostic Center of the S. Berezin International Institute of Biological Systems; 43 Karla Marksa St., Pesochniy, Saint Petersburg 197758, Russia; 2Saint Petersburg State University; 7—9 Universitetskaya Emb., Saint Petersburg 199034, Russia; 3I.I. Mechnikov North-Western State Medical University, Ministry of Health of Russia; 41 Kirochnaya St., Saint Petersburg 191015, Russia
Background. In the last decade, we observed a significant increase in the number of patients undergoing radiotherapy for prostate cancer (PC). It became possible with the development of new equipment that can significantly increase radiation efficiency and reduce the frequency and severity of side effects. Active investigation of new fractionation regimens led to the development of stereotactic radiotherapy (StR) technique. In this article, we describe our own experience of using StR in patients with localized PC.
Material and methods. The study included 48 patients treated with CyberKnife robotic radiosurgery system. The patients received a total dose of36.25 Gy delivered in 5 fractions.
Results. At a median follow-up of 24 months, the estimated four-year prostate-specific antigen (PSA) relapse-free survival rate was 95.8 %. The median PSA nadir was 0.48 ng/mL. We observed no grade III—IV side effects (either early or late).
Conclusion. Our results suggest that the use of StR allows achieving good biochemical control comparable to that achieved by other methods and demonstrates comparable and sometimes even lower toxicity.
Key words: prostate cancer, stereotactic radiotherapy, hypofractionation, CyberKnife, radiosurgery
For citation: Vorobyov N.A., Martynova N.I., Mikhailov A.V. et al. Stereotactic body radiation therapy for clinically localized prostate cancer. Onkourologiya = Cancer Urology 2018;14(2):122—9.
Рак предстательной железы (РПЖ) занимает 2-е место по распространенности среди злокачественных опухолей у мужчин. В мире выявляют около 1 млн новых случаев данного заболевания ежегодно [1]. Сегодня доступно большое количество лечебных методик, демонстрирующих схожие показатели эффективности у пациентов с локализованными формами РПЖ. Среди них радикальная простатэктомия, дистанционная лучевая терапия (ДЛТ) и брахитерапия. В последнее десятилетие отмечается значительный рост числа пациентов, подвергающихся лучевой терапии по поводу РПЖ. С одной стороны, это объясняется созданием нового оборудования для проведения лучевой терапии, способного значительно повысить эффективность облучения при уменьшении частоты и выраженности побочных явлений. С другой стороны, это можно объяснить такими преимуществами ДЛТ, как отсутствие необходимости госпитализации в стационар, нахождения в реанимации, изменения обычного уклада жизни пациентов. Интерес представляет и тот факт, что в последнее время все больше пациентов самостоятельно делают выбор в пользу лучевой терапии по сравнению с другими методами. Так, в Японии доля больных РПЖ, которые предпочли лучевую терапию другим видам лечения, в период с 1996 по 1998 г. составляла 5,9 %, с 1999 по 2001 г. — 26,5 %, а с 2003 по 2005 г. — 41,4 % (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
В данной работе представлены результаты собственного опыта применения методики СтЛТ у пациентов с локализованным РПЖ.
Материалы и методы
В исследование включены 48 пациентов, страдающих локализованной формой РПЖ и проходивших лечение в Лечебно-диагностическом центре Международного института биологических систем им. С. Березина в период с 2012 по 2017 г. Средний возраст пациентов составил 67 лет (47—85 лет). Согласно рекомендациям NCCN (National Comprehensive Cancer Network) пациенты были разделены на 3 группы [7]: в группу низкого риска вошли 7 (14,6 %) больных, промежуточного риска — 35 (72,9 %) и высокого риска — 6 (12,5 %). Средний уровень простатического специфического антигена (ПСА) на момент начала лечения составил 10,6 нг/мл (1—34 нг /мл). Оценку выраженности расстройств мочеиспускания и симптомов, связанных с заболеванием предстательной железы, выполняли по шкале IPSS (International Prostate Symptom Score, Международная шкала оценки простатических симптомов) [8]. Наличие дизурических явлений не считали абсолютным противопоказанием к проведению облучения. Характеристика пациентов представлена в табл. 1.
Облучение осуществляли с применением роботизированной радиохирургической системы кибер-нож. Эта система состоит из линейного ускорителя 6 МэВ, установленного на роботизированной консоли. Две ортогонально расположенные рентгеновские трубки обеспечивают непрерывное слежение за мишенью и позволяют корректировать облучение в режиме реального времени. В целях слежения за смещением предстательной железы и повышения точности облучения 4 рентгенконтрастных маркера имплантировали в ткань предстательной железы трансректально под контролем ультразвукового исследования. Компьютерно-томографическую (КТ) топометрию выполняли через 10—14 сут после имплантации маркеров. На топометрию пациент приходил с наполненным мочевым пузырем (не мочился за 2 ч до процедуры). Вначале проводили нативное КТ-исследование с толщиной среза 1,5 мм. После этого в мочевой пузырь устанавливали катетер Фолея, по которому вводили 10 мл урографина. Данная процедура позволяет
Таблица 1. Характеристика пациентов, прошедших курс стереотак-сической дистанционной лучевой терапии (n = 48) Table 1. Characteristics of patients that underwent stereotactic external beam radiotherapy (n = 48)
JN CV CS Показатель Parameter Значение
DC Средний возраст (диапазон), лет Mean age (range), years 67,2 ± 8,7 (47-85)
ОС ш u Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Рис. 1. Динамика уровня простатического специфического антигена
после проведения стереотаксической лучевой терапии
Fig. 1. Dynamics of serum prostate-specific antigen level after stereotactic
гъ s Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Токсическая реакция Число пациентов (%)
Number of patients (%)
I степень тяжести Severity I 11 «Severer™ III—IV степень тяжести Severity III-IV
общая слабость 12 (25,0)
со стороны мочеполовой системы 20 (41,6)
in the genitourinary system
со стороны желудочно-кишечного тракта 4 (8,3)
in the gastrointestinal tract
со стороны мочеполовой системы 11 (23)
in the genitourinary system
со стороны желудочно-кишечного тракта 5 (10,4)
in the gastrointestinal tract
мочеиспускания, а также недержания мочи за период наблюдения не зарегистрировано. Всем пациентам перед началом лечения была назначена плановая терапия альфа-блокаторами. В большинстве случаев дизурические проявления регрессировали через 1—3 мес после проведения СтЛТ.
Со стороны желудочно-кишечного тракта наиболее частыми проявлениями токсичности стали диарея и ложные позывы к дефекации. Ранние нежелательные явления II степени тяжести наблюдались у 3 (6,3 %) пациентов.
Среди наиболее часто отмечаемых поздних лучевых осложнений со стороны мочеполовой системы можно выделить ноктурию, в связи с чем проводилась терапия альфа-блокаторами. У 2 пациентов в позднем постлучевом периоде выявлено кровотечение из прямой кишки через 12 и 15 мес после лечения. В обоих случаях кровотечение купировалось самостоятельно, хирургического вмешательства не потребовалось.
Ранних и поздних нежелательных явлений Ш—^ степеней тяжести, связанных с переоблучением уретры, мочевого пузыря или прямой кишки, на протяжении всего периода наблюдения не отмечено.
В нашем исследовании 4-летняя безрецидивная выживаемость по уровню ПСА составила 95,8 %. Медиана надира по уровню ПСА — 0,48 ± 0,3 нг/мл, что является благоприятным прогностическим признаком у пациентов [12, 13]. Подобные положительные результаты свидетельствуют в поддержку гипотезы о низком значении индекса а/ в для клеток РПЖ, равном 1,5 Гр. При а/Р = 1,5 Гр доза излучения, подведенная к опухоли в нашем исследовании (7,25 Гр за фракцию), эквивалентна дозе в 90—96 Гр, подведенной в режиме стандартного фракционирования (1,8 Гр за фракцию).
Полученные данные безрецидивной выживаемости по уровню ПСА сравнимы с подобными показателями при использовании альтернативных методов лечения локализованного РПЖ (радикальной простатэктомии, брахитерапии, трехмерной (3D) конформной ДЛТ) [14—16]. В то же время СтЛТ обладает рядом преимуществ: короткий (5—9 сут) курс лечения, отсутствие необходимости в госпитализации, проведении анестезии и длительного восстановительного периода. Если результаты дальнейших исследований по изучению метода СтЛТ с большей медианой наблюдения также смогут продемонстрировать высокую эффективность, сравнимую с брахитерапией и хирургическим лечением, СтЛТ сможет стать наиболее предпочтительным вариантом в терапии локализованных форм РПЖ.
Большинство пациентов в нашем исследовании относились к группам низкого и промежуточного риска развития рецидива. Для больных из группы
высокого риска наиболее предпочтительным считается проведение курса 3D-конформной ДЛТ с облучением тазовых лимфатических узлов на фоне гормонотерапии. Тем не менее в исследовании АЛ. Katz и соавт. метод СтЛТ продемонстрировал высокие показатели 5-летней безрецидивной выживаемости по уровню ПСА в группах низкого, промежуточного и высокого риска — 97,0; 90,7 и 74,1 % соответственно [17]. Необходимо проведение новых исследований с большим периодом наблюдения, для того чтобы определить эффективность применения СтЛТ в качестве самостоятельного вида лечения пациентов с высоким риском развития рецидива. В то же время этот метод может применяться в качестве дополнения (буста) после стандартного курса 3D-конформной ДЛТ. В одной из научных работ, опубликованной в 2010 г., продемонстрированы высокие показатели 3-летней безрецидивной выживаемости по уровню ПСА (77,7 %) при использовании СтЛТ в качестве буста (18—21 Гр за 3 фракции) после курса ДЛТ (45 Гр) [18].
Низкие показатели токсичности, представленные в нашем исследовании, свидетельствуют о хорошей переносимости СтЛТ. При медиане наблюдения 2 года не зарегистрировано нежелательных явлений Ш—^ степеней тяжести, связанных с лучевым повреждением мочевого пузыря или прямой кишки. Таких осложнений, как острая задержка мочеиспускания, макрогематурия, недержание мочи, лучевые язвы или прободение прямой кишки, не отмечено.
Частота и тяжесть побочных эффектов в нашем исследовании оказались схожими с результатами, представленными в других работах по изучению СтЛТ. Сравнение с классической методикой 3D-конформной ДЛТ в режиме стандартного фракционирования также свидетельствует в пользу лучшей переносимости СтЛТ (табл. 3). Представленные в табл. 3 исследования различаются не только значениями разовой и суммарной очаговой дозы, но и техникой подведения дозы, наличием или отсутствием методик визуализации и контроля за смещением мишени. Предстательная железа может смещаться на 10—15 мм во время сеанса облучения за счет перистальтики и наличия газа в прямой кишке. Применение рентгенконтрастных маркеров и контроль за положением предстательной железы в процессе облучения позволяют снизить частоту и выраженность постлучевых осложнений за счет высокой точности облучения и уменьшения отступов на РТУ Так, в случае 3D-конформной ДЛТ без использования методов визуализации минимальные отступы на погрешности при укладке и на смещение предстательной железы составляют 10—15 мм. Применение модулированной по интенсивности лучевой терапии или СтЛТ в комбинации с рентгенконтрастными маркерами позволяет уменьшить отступы до 5—3 мм, не опасаясь при этом недооблучения мишени.
Таблица 3. Сравнение показателей поздней токсичности при проведении СтЛТ и ЗБ-конформной ДЛТ Table 3. Comparison of late toxicity after sEBRT and 3D conformal EBRT

Инновации в радиотерапии позволили ученым и врачам разработать способы для воздействия на злокачественные опухоли точечно, высокими дозами излучения и при этом снизить интоксикацию пациента, неизбежную при данном виде лечения. Технология SBRT — гипофракционная стереотаксическая лучевая терапия — с успехом применяется в Израиле уже несколько лет. Для проведения такого лечения у нас используются системы лучевой терапии последнего поколения TrueBeam и Trilogy производства Varian Medical Systems (США).
Как долго длится лечение?
SBRT — это метод лучевой терапии, при котором используется специальное оборудование, фиксирующее расположение опухоли в теле больного (за исключением головного мозга) и выполняющее точнейший расчет направления и силы радиоактивных лучей. Курс лучевой терапии по методу SBRT проводится при помощи очень высоких доз излучения и составляет от одного до пяти сеансов.
Данная терапия эффективна при раке легких и печени. Также данный метод используется при лечении рака простаты за границей. Помимо этого, SBRT часто применяется при лечении метастазов в печень, надпочечники и позвоночник. Показаниями для радиотерапии при раке простаты средней или низкой степени злокачественности являются:
Этот iframe содержит необходимую логику для обработки Ajax в Gravity Forms.
