Атипичная аденоматозная гиперплазия (син.: ААГ, аденоз, атипичный аденоз, мелкоаципарная атипичная гиперплазия простаты) характеризуется узловой пролиферацией мелких и/или средних по размеру ацинусов, не имеющих структурных и цитологических признаков малигнизации. Как и при ПИН, нет ни какой-либо характерной клинической симптоматики, ни очерченной макроскопической картины. В пунктатах и материале, полученном после трансуретральной резекции простаты, ААГ обнаруживается у 1,5—19,6 % пациентов, а после радикальной простатэктомии — в 28,9—33,0 % случаев. У подавляющего большинства больных ААГ поражает транзиторную зону простаты, в то время как периферическая зона органа страдает не чаще, чем в 2 % случаев. Изредка, при наличии ДГП, развивается многоочаговый процесс с вовлечением в него обеих зон.
Малигнизация при атипичной аденоматозной гиперплазии наблюдается не чаще, чем при ДГП. Кроме внешнего поверхностного морфологического сходства очагов ААГ с некоторыми вариантами высокодифференцированной карциномы ни возраст пациентов (на 5—10 лет моложе больных раком), ни склонность к периуретральной локализации указанных очагов не свидетельствуют о связи с раком. Вместе с тем утрата аллелей 8р22, появление микросателлитных маркеров в позициях 7q, 8p, 8q и 18q, обнаруженные у 8—40 % больных с ААГ, наводят на мысль о возможности такой связи. Прерывистый характер окрашивания на цитокератин 34BЕ12 базального слоя выстилки ацинусов в очагах ААГ, а также возросшие, по сравнению с нормой, среднее значение диаметра ядер эпителиоцитов и уровень их пролиферации свидетельствуют о некоем промежуточном положении эпителиоцитов при ААГ между их нормальными и раковыми аналогами.
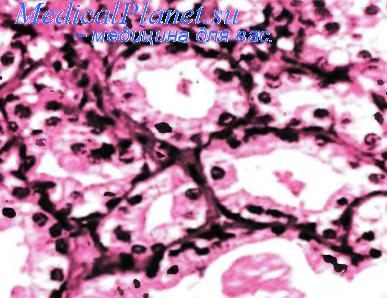
Атипичная аденоматозная гиперплазия простаты
Эпителиоциты обладают умеренно развитой цитоплазмой, иногда слабо эозинофильной и слегка зернистой, а также округлыми полиморфными ядрами с равномерно распределенным хроматином и базофильными ядрышками, обычно менее 1 мкм в диаметре (как и в норме). Эти клетки позитивны к ПСА, кислой фосфатазе и Leu-7. Окраска на высокомолекулярный цитокератин 34ВЕ12 выявляет рассеянные элементы базального типа. Строма очагов ААГ, как правило, не содержит воспалительного инфильтрата и может быть склерозирована в разной степени. ААГ следует дифференцировать от мелкоацинарной аденокарциномы.
При атипичной гиперплазии (она же аденоз, мелкоаципарная атипичная гиперплазия простаты) обнаруживается узловая пролиферация мелких и/либо средних ацинусов. Важно подчеркнуть, что при этом заболевании ни структурно, ни цитологически выявить малигнизацию не удаётся, отсутствует специфическая клиническая симптоматика и макроскопическая картина. В большинстве случаев оказывается поражена транзитная область, а окраина затрагивается патологическим процессом максимум у 2% пациентов.
Дополнительные сведения
Если АГП сочетается с ДГПЖ, вероятно мультиочаговое поражение и периферии и промежуточного района, малигнизация атипической гиперплазии не слишком вероятна. Только по отдельным морфологическим параметрам наружной структуры прослеживается совпадение с некоторыми разновидностями аденокарцином. Однако несоответствие по возрастной группе риска и тяготение патологического очага в периуретральный регион позволяют уверенно отбросить худшее предположение.
Методика интраоперационного сканирования
При гиперплазиях предстательной железы показано использование ТРУЗИ на частоте 7,5 МГц (конвексным датчиком, в три стадии поперечно и сагиттально). Начинают всегда сагиттально, одновременно с этим проводя уретроцистоскопию. Сразу должен визуализироваться дистальный участок резектоскопа, размещающийся около семенного бугорка с последующим плавным переводом его в пузырь. Такой подход обеспечивает определение дистанции, отделяющей петлю от капсулы на условном циферблате в реальном времени. Поперечное сканирование недостаточно информативно, потому что прилежание гиперпластического очага слишком плотное.
Сначала изучают боковые доли гиперплазии простаты, затем средние, только после этого наступает черёд поперечного сканирования. На 30 — 40 минутах оперативного вмешательства прибегают ко второму сканированию, оценивая состояние ложа удалённой гиперплазии и характеризуя капсулу простаты в тех участках, которые не подлежат визуальному контролю.
Основное внимание при этом уделяется:
* Тому, насколько симметрична удалённая ткань
* Тому, какая доля гиперплазированного объёма пока сохраняется
* Вхождению в просвет уретры узлов неудалённой пока аденомы
* Дистанции между петлёй и капсулой, чтобы своевременно оценить риск перфорации
Наконец, после завершения оперативного вмешательства ультразвуковой контроль позволяет получить данные о том, сколько всего ткани удалено, насколько хорошо сформировалось ложе, есть ли необходимость в устранении или вапоризации сохранившихся ещё сегментов гиперпластического очага.
Информация о предварительной диагностике
Если в ацинарном эпителии ПЖ гиперплазия принимает плоскоклеточную форму, то правильнее будет говорить не о атипичности процесса, а о переходе от одного типа эпителия к другому; такое состояние свойственно для 56,8% пациентов с железистой гиперплазией. Проявления атипичной гиперплазии, в свою очередь, бывают достаточно разными, но давно уже известно, что все они могут выступать, с высокой степенью вероятности, в роли предраковых состояний.
Соответственно, как обнаружение исключительно фокусов атипической гиперплазии, так и наличие данных о повышенном уровне простатспецифического антигена требует ведения диспансерного наблюдения за пациентом. Особое практическое значение приобретает дифференцирование камбиальных структур эпителия от клеточной дисплазии, поскольку именно от нее зависит точность оценки основных факторов онкологического риска.
Очаг атипической гиперплазии предстательной железы
Атипичная аденоматозная гиперплазия (син.: ААГ, аденоз, атипичный аденоз, мелкоаципарная атипичная гиперплазия простаты) характеризуется узловой пролиферацией мелких и/или средних по размеру ацинусов, не имеющих структурных и цитологических признаков малигнизации. Как и при ПИН, нет ни какой-либо характерной клинической симптоматики, ни очерченной макроскопической картины. В пунктатах и материале, полученном после трансуретральной резекции простаты, ААГ обнаруживается у 1,5—19,6 % пациентов, а после радикальной простатэктомии — в 28,9—33,0 % случаев. У подавляющего большинства больных ААГ поражает транзиторную зону простаты, в то время как периферическая зона органа страдает не чаще, чем в 2 % случаев. Изредка, при наличии ДГП, развивается многоочаговый процесс с вовлечением в него обеих зон.
Малигнизация при атипичной аденоматозной гиперплазии наблюдается не чаще, чем при ДГП. Кроме внешнего поверхностного морфологического сходства очагов ААГ с некоторыми вариантами высокодифференцированной карциномы ни возраст пациентов (на 5—10 лет моложе больных раком), ни склонность к периуретральной локализации указанных очагов не свидетельствуют о связи с раком. Вместе с тем утрата аллелей 8р22, появление микросателлитных маркеров в позициях 7q, 8p, 8q и 18q, обнаруженные у 8—40 % больных с ААГ, наводят на мысль о возможности такой связи. Прерывистый характер окрашивания на цитокератин 34BЕ12 базального слоя выстилки ацинусов в очагах ААГ, а также возросшие, по сравнению с нормой, среднее значение диаметра ядер эпителиоцитов и уровень их пролиферации свидетельствуют о некоем промежуточном положении эпителиоцитов при ААГ между их нормальными и раковыми аналогами.

Атипичная аденоматозная гиперплазия простаты
Эпителиоциты обладают умеренно развитой цитоплазмой, иногда слабо эозинофильной и слегка зернистой, а также округлыми полиморфными ядрами с равномерно распределенным хроматином и базофильными ядрышками, обычно менее 1 мкм в диаметре (как и в норме). Эти клетки позитивны к ПСА, кислой фосфатазе и Leu-7. Окраска на высокомолекулярный цитокератин 34ВЕ12 выявляет рассеянные элементы базального типа. Строма очагов ААГ, как правило, не содержит воспалительного инфильтрата и может быть склерозирована в разной степени. ААГ следует дифференцировать от мелкоацинарной аденокарциномы.
Патологическая анатомия рака предстательной железы
Рак предстательной железы развивается в железистых элементах паренхимы и прилежащих к ней терминальных канальцах периферической зоны железы. В процессе старения организма в периферической зоне нарастает количество очагов атипичной гиперплазии, отличающейся от железистой гиперплазии, связанной с развитием аденомы предстательной железы, дезорганизацией железистых структур. Атипичная гиперплазия развивается в зонах с сохранившейся секреторной активностью эпи гелия, подвергающихся в последующем диффузной железистой гиперплазии, что отражает биологическую взаимосвязь между этими процессами и возникновением гистологической картины рака. Эволюция рака предстательной железы включает продолжительное предраковое состояние, при котором повышенная чувствительность нормального эпителия к андрогенной стимуляции и последующая утрата гормональной зависимости являются ключевыми факторами в стимуляции злокачественного роста. Возникающая при этом атипичность клеток отражает потерю их андрогенозависимости.
В начальной стадии развития рака предстательной железы определяется микроскопический очаг малигнизации, включающий область значительного или слабовыраженного атипичного разрастания эпителия. Большинство таких очагов локализуются в периферической части железы и имеют размеры 0,2 —2,1 мм. Гистологически они относятся к светлоклеточному канальцево-альвеолярному или темноклеточному канальцевому раку. При развитии злокачественного процесса многочисленные микроскопические инфильтраты распространяются среди нормальной железистой ткани. При этом участок малигнизации часто оказывается мультицентрическим с разрастанием соединительной ткани. Постепенно происходит конденсация патологического фокуса в раковый узел, пальпируемый при ректальном исследовании. При гистологическом исследовании обнаруживаются области атипичных микроацинусов, занимающих несколько участков в задненижних отделах железы, внутри капсулы. В последующем размеры узла увеличиваются и он занимает значительную часть железы, но не распространяется за ее пределы. Это сопровождается значительной деформацией поверхности долей или доли железы при отсутствии вовлечения в процесс латеральных бороздок и семенных пузырьков. В дальнейшем происходит диффузная инфильтрация ткани железы с распространением злокачественного процесса на ее капсулу, семенные пузырьки и окружающую железу богатую сеть лимфатических и венозных сплетений. Инвазия прямой кишки и перипростатической клетчатки является результатом пенетрации капсулы железы. В дальнейшем в процесс вовлекаются шейка мочевого пузыря, предстательная и мембранозная части мочеиспускательного канала.
Большая часть рака предстательной железы с явными клиническими проявлениями заболевания относится к аденокарциномам, составляющим около 90% всех гистологических форм злокачественных новообразований предстательной железы. Основными признаками аденокарциномы являются нарушения дифференциации желез и анаплазия ядер. Общая патологическая характеристика рака предстательной железы включает расположение простатических ацинусов бок о бок, отсутствие базальных клеток в однослойном эпителии, выстилающем ацинусы, клетки располагаются в виде гроздьев, клеточные границы неотчетливы, в клетках обнаруживаются большие эозинофильные ядрышки, железки приобретают вид линейных инфильтратов в фиброзно-мышечной строме, выраженность ядерного гиперхроматизма, периневральная инфильтрация. Аденокарциномы предстательной железы классифицируются на дифференцированные (образующие при своем росте железистые структуры) и недифференцированные (с отсутствием желез). По степени дифференциации различают высоко-, умеренно- и низкодифференцированные формы рака предстательной железы. По характеру строения желез аденокарциномы дифференцированного типа разделяются на крибриформные, папиллярные и смешанного крибриформно-папиллярного строения.
Важным показателем доброкачественных и злокачественных изменений в простатических железках может служить выстилающий их эпителий, однослойный в случае злокачественной биотрансформации ацинусов с отсутствием базального слоя, и двухслойный в железках аденомы предстательной железы. В высокодифференцированных аденокарциномах отмечается морфологическая однородность эпителия, железистые структуры представлены маленькими прилежащими друг к другу ацинусами. Эпителиальные клетки цилиндрической формы с бледной, субгранулированной цитоплазмой, в нижней трети которой располагаются гиперхроматичные ядра.
Умеренно дифференцированная аденокарцинома характеризуется меньшей выраженностью регулярности желез, отдельные ацинусы слабо демаркированы, в них прослеживается вариабельность просветов. Железы выстланы низким цилиндрическим или кубическим эпителием с недостаточно четкими клеточными границами, гиперхроматичными ядрами и редкими митозами.
Низкодифференцированная аденокарцинома состоит из маленьких, нерегулярных, плотно сжатых ацинусов со слабо определяемыми просветами, выстланными кубическим или многослойным эпителием со скудной цитоплазмой и темными маленькими ядрами. В недифференцированном раке предстательной железы наблюдается полная утрата железистых структур, эпителиальные клетки расположены кучкообразно и в виде тяжей или струн, массивно инфильтрирующих строму, выражены митозы. При развитии рака предстательной железы проявляется выраженная анаплазия ядер. Ядра эпителиальных клеток характеризуются полиморфизмом, изменяются в размере и форме.
Гистологическая картина латентной карциномы характеризуется одиночными очагами пролиферации железистого эпителия. Развитие злокачественного процесса ограничено небольшим участком ткани с отсутствием тенденции к эксцентрическому росту. В противоположность клинически явной карциноме латентная форма редко включает многочисленные зоны крибриформно-папиллярных структур или недифференцированных желез, выявление которых не дает оснований расценивать рак простаты как скрытопротекающее заболевание. Очаги латентного рака предстательной железы обнаруживаются случайно на аутопсии или в ткани удаленных аденоматозных узлов. Для повышения вероятности выявления микроочагов рака предстательной железы в ткани удаленной аденомы целесообразно делать срезы, ориентированные к заднему краю энуклеации аденоматозных узлов, прилежащему к истинной предстательной железе — месту развития рака. При этом число срезов, произведенных у заднего края энуклеации аденомы по отношению к ткани, расположенной кпереди от мочеиспускательного канала, должно находиться в соотношении 3:1. Этот метод позволяет повысить частоту выявления латентной карциномы в ткани удаленных аденоматозных узлов с 6—10% до 20 — 28%. Гистологическая картина оккультного рака предстательной железы в большинстве случаев включает крибриформно-папиллярные структуры. При оккультной форме метастазы проявляются до выявления первичного очага опухоли.
