
Рак предстательной железы в структуре злокачественных заболеваний у мужчин в последнее десятилетие занимает одно из лидирующих положений. Своевременная диагностика РПЖ в настоящее время приобрела особую актуальность вследствие неуклонного роста заболеваемости (3,5).
В европейских странах в последнее десятилетие отмечена устойчивая тенденция роста заболеваемости рака предстательной железы (10,12). В Российской Федерации также отмечается существенный рост заболеваемости, так по величине прироста рак предстательной железы занимает второе место после меланомы (2).
Выявление рака предстательной железы на ранних стадиях и оценка распространенности опухолевого процесса является актуальной проблемой, т. к. определяет выбор оптимальной тактики лечения (7). По данным отдельных авторов распространение опухолевого процесса за пределы предстательной железы и особенно вовлечение семенных пузырьков в процесс ухудшает прогноз заболевания (5,13). С ростом заболеваемости отмечается рост и смертности от рака предстательной железы.
К сожалению, до 70 % пациентов обращаются за медицинской помощью на поздних стадиях, при которых невозможно проведение адекватного радикального лечения, что несомненно отражается на прогнозе заболевания (5,10).
В последнее десятилетие отмечается широкое внедрение в практическое здравоохранение современных высокоинформативных методов диагностики, что, несомненно, повысило качество ранней диагностики рака предстательной железы (5,6, 8,9,11).
Важным является не только обнаружение патологического очага в предстательной железе, но и его дифференциация, определение распространенности опухолевого процесса. Указанное становится актуальным при разработке принципиально новых подходов к лечению — комбинированных и комплексных методов лечения.
Цель исследования — изучить возможности комплексного ультразвукового исследования (ЦДК кровотока, ЭД, 3Д, соноэластография) в диагностике и динамическом контроле эффективности лечения рака предстательной железы.
Материалы и методы. Для выполнения поставленной цели нами обследовано 87 пациентов, средний возраст которых составляет 68,5 ±5,3 лет. Всем пациентам проводилось пальцевое ректальное исследование (ПРИ), клинико-биохимическое исследование, а также определение уровня простат-специфического антигена (ПСА) в сыворотке крови. Следующий этап обследования включал ультразвуковое трансабдоминальное и трансректальное исследование в режиме, с последующим использованием методик цветового допплеровского картирования кровотока, энергетической допплерографии, 3-х мерной допплерографии, соноэластографии. Для выполнения ТРУЗИ использовали ультразвуковые аппараты Logig 9, AECUVIXXG (MEDISON) и HitachiAscendus премиум класса с конвексным датчиком для абдоминального исследования с частотой 1-5 МГц и универсальным полостным датчиком с частотой 4-10 МГц.
Диагностическое обследование завершилось выполнением мультифокальной трансректальной биопсии под ультразвуковым контролем с последующим морфологическим исследованием полученного материала.
Результаты исследования и их обсуждение
Пальцевое ректальное исследование выполнено всем 87 пациентам. При ПРИ акцентировали внимание на наличие асимметрии железы, на плотность, размеры железы, подвижность слизистой прямой кишки над железой, наличие отдельных узлов.
При ПРИ установлено наличие асимметрии железы у 16 больных, увеличение размеров простаты — у 52 пациентов, повышение плотности железы — 39 больных, наличие отдельных узлов повышенной плотности у 33 и ограничение подвижности слизистой прямой кишки над железой у 3 больных.
Определение уровня ПСА в сыворотке крови проведено всем больным. Средний показатель уровня простат-специфического антигена в сыворотке крови у обследуемых пациентов составил 16,1 ±6,65 нг/мл.
Следующий этап обследования включал ультразвуковое исследование, которое проведено всем 87 больным.
При ТРУЗИ у 29 (33,3 %) пациентов выявлена неровность контуров железы. У 52 (59,8 %) больных выявлен гипоэхогенный очаг с четкими контурами и дифференциацией от окружающей неизменной ткани предстательной железы.
У 20 (23 %) больных опухоль визуализировалась в виде изоэхогенного образования. Изоэхогенные образования вызывали определенные затруднения в диагностике, в связи с нечеткой дифференциацией границы опухоли и неизмененной ткани предстательной железы.
У 13 (14,9 %) больных опухоль определялась в виде очага смешанной эхогенности и у 2 (2,3 %) пациентов как гиперэхогенное образование. Патологический очаг у 55 пациентов локализовался в периферической зоне, у 9 — в центральной и у 23 — в переходной зоне.
По нашим данным чувствительность ТРУЗИ при РПЖ составила 73,9 %, специфичность 57,7 %, точность 71,9 %.
При ТРУЗИ с использованием ЦДК кровотока, энергетической и трехмерной допплерографии у 65 больных выявлена патологическая васкуляризация с дезинтеграцией и деформацией сосудистого рисунка. Увеличение количества кровеносных сосудов и их концентрации с преимущественной локализацией в периферической зоне выявлено у 33 больных и у 39 пациентов внутриопухолевая локализация кровеносных сосудов.
Из 52 больных с гипоэхогенным очагом патологическая васкуляризация выявлена у 30 пациентов, что составило 80,8 %. Из 20 пациентов, с изоэхогенными признаками опухоли, патологическая васкуляризация диагностирована у 17 (80 %) и из 13 больных с образованиями предстательной железы смешенной эхогенности патологическая васкуляризация установлена в 6 (46,2 %) случаях.
По нашим данным чувствительность УЗИ в сочетании с ЦДК кровотока, ЭД и 3Д при раке предстательной железы составила 86,1 %, специфичность 74,3 %, точность 83,5 %.
Соноэластография проведена 17 больным с подозрением на рак предстательной железы, при этом установлено, что у 15 пациентов были выявлены очаги высокой жесткости, которые визуализировались окрашенные в черный цвет.
Соноэластография 15 пациентам проведена на аппарате HitachiAscendus. При анализе полученных данных установлено, что у 13 больных визуализировались очаги высокой жесткости т.е. не эластичные при давлении, которые были окрашены в синий цвет. У 2 больных выявлены очаги с сочетанием зеленого и синего цвета, но с преобладанием синей окраски.
При включении эластографии в алгоритм комплексной диагностики рака предстательной железы чувствительность составила 91,7 %, специфичность 79,8 %, точность 86,3 %.
При сопоставлении данных полученных при УЗИ с показателями гистоморфологической градации опухоли по шкале Глисона установлено: гипоэхогенный очаг чаще встречается при сумме баллов 5-7 и менее 5 баллов, изоэхогенная опухоль чаще при сумме баллов 5-7. Патологическая васкуляризация с дезинтеграцией и деформацией сосудистого рисунка чаще диагностирована в группе больных с суммой баллов 5-7. После проведенного анализа полученных данных пациенты были распределены по стадиям: Т1 стадия установлена у 8 больных, что составило 9,1 %, Т2 стадия — у 22 пациентов (25,3 %), Т3 стадия — у 56 больных (64,4 %) и Т4 стадия — у 1 пациентов (1,1 %).
Для изучения возможности комплексного ТРУЗИ в динамическом контроле эффективности лечения рака предстательной железы нами проведено обследование пациентов по окончании курса консервативной терапии, затем через 3, 6, и 12 месяцев.
Для оценки местных изменений в предстательной железе и в области опухолевого очага мы использовали следующие эхографические признаки — эхогенность и степень васкуляризации опухоли. После проведенного анализа полученных данных при ТРУЗИ больных с раком предстательной железы в процессе лечения установлено, что в большинстве случаев отмечалось постепенное повышение эхогенности опухоли. При ТРУЗИ пациентов с раком предстательной железы после окончания курса консервативной терапии выявлено повышение эхогенности опухоли у 61 (70,1 %) больных.
При контрольном ТРУЗИ по истечении 3 месяцев после окончании консервативной терапии у 46 (52,9 %) пациентов опухолевый очаг визуализировался изоэзогенно по отношении к ткани железы.
По истечении 6 месяцев у 38 (43,7 %) больных выявлены эхопризнаки формирования фиброза в проекции опухолевого очага, а через 12 месяцев визуализировались признаки фиброзной ткани.
Как было отмечено выше, при ТРУЗИ с использованием ЦДК кровотока, энергетической допплерографии и трехмерной допплерографии у 65(74,7 %) больных была выявлена патологическая васкуляризация с дезинтеграцией и деформацией сосудистого рисунка. По окончании курса консервативной терапии при ТРУЗИ с применением допплеровских методик в большинстве случаев определялась гиперваскуляризация как предстательной железы, так и опухолевого очага.
При ТРУЗИ по истечении 3 месяцев у 40 (61,5 %) пациентов отмечено значительное снижение васкуляризации. Проведенное ТРУЗИ через 6 месяцев показало дальнейшее снижение васкуляризации, с сохранением лишь отдельных сосудов, а через 12 месяцев сосуды в области опухолевого очага не визуализировались.
Заключение
Анализ полученных данных свидетельствует о том, что РПЖ визуализировался в большинстве случаев как гипоэхогенное образование, с преимущественной локализацией в периферической зоне.
Характерным допплерографическим признаком РПЖ является патологическая васкуляризация с дезинтеграцией и деформацией сосудистого рисунка.
Использование современных методов ультразвуковой диагностики (ультразвуковое исследование с ЦДК кровотока, ЭД,3Д, соноэластография) в комплексе позволяет повысить эффективность диагностики рака предстательной железы, что, несомненно, способствует выбору рациональной тактики лечения.
Применение ТРУЗИ с допплеровскими методиками значительно улучшает качество обследование и динамический контроль за эффективностью проводимой терапии у пациентов с раком предстательной железы. При ТРУЗИ после окончания курса консервативной терапии по поводу рака предстательной железы установлено повышение эхогенности опухоли и васкуляризации ткани железы и опухолевого очага, с последующим (через 3-6 месяцев) снижением васкуляризации и к 12 месяцам васкуляризацией опухолевого очага.
Рецензенты:

Рак предстательной железы способен обладать разнообразными эхографическими вариациями:
- гипоизоэхогенность;
- смешанная эхогенность;
- гиперэхогенность.
Чаще всего, более чем в 50% раковых заболеваний предстательной железы, рак представляет собой гипоэхогенный узел со слабовыраженными контурами. Он формируется на периферическом участке. Гиперэхогенные зоны подобной локализации могут быть хорошо видны в поле зрения эхогенной паренхимы периферического участка предстательной железы.
Эхогенность опухолевого образования зависит от множества критериев, например, от его параметров. Опухоли небольших размеров являются гипоэхогенными, При увеличении ее в размерах эхогенность начинает увеличиваться, в результате преобразуется в изоэхогенную.
Трудности визуализации наблюдаются при изоэхогенном раке предстательной железы. В подобной ситуации опухоль сплывается с паренхимой. Как показывает практика, около 40% опухолей изоэхогенного характера обнаруживаются лишь при оперировании простаты. Они имеют достаточно большие параметры, их невозможно обнаружить при помощи ТРУЗИ. После распространения рака железы на переходный участок, между опухолевым образованием и доброкачественной тканью пропадает граница, эхогенность опухоли увеличивается.

Изменение опухолевой эхогенности можно объяснить такими факторами:
- фиброзные изменения опухолевого образования;
- изменился уровень дифференцировки опухолевых клеток;
- увеличение количества акустически отражающих сфер;
- смешение по акустическим характеристикам тканей неоднородного типа – опухолевой, аденоматозной;
- новообразование значительно увеличилось в размерах.
При предположениях инфильтрующего роста, изоэхогенного рака простаты нужно провести полноценное обследование эхоструктуры внутри железы для сопоставления с контрлатеральным отделом, применяя срезы продольного, поперечного сечения. Асимметрия простаты, неровность контуров, не отчетливая дифференцировка по участкам, асимметрия, выбухание капсулы органа, неоднородность ее эхогенности, дают возможность предусмотреть злокачественное формирование. Также можно применять сравнение срезов продольного сечения в нескольких окнах уровня периферического участка предстательной железы. В этом случае различия в эхоструктуре органа будут заметны, если сопоставлять два изображения, выполненных на одной линии.
Гиперэхогенные узлы эхогенности смешанного характера тоже наблюдаются при раковой опухоли простаты. Микро кальцинация достаточно часто встречается на злокачественных участках. Диагностировать подобные опухоли очень трудно. Опухоли подобной эхоструктуры обладают мультифокальным, диффузным качеством.

Новообразование железы

Раковая опухоль предстательной железы сегодня для медицины является принципиальной проблемой, угрожающей здоровью людей. Среди заболеваний онкологического характера раковая опухоль предстательной железы мужской стати Швеции, Америки занимает первое место, во многих европейских государствах второе после рака легких. На территории России раковое заболевание предстательной железы уступает первую позицию меланоме кожи по проценту ежегодного прироста – порядка 32%.
Начальная дифференциальная диагностика ракового заболевания железы имеет трудности не лишь из-за бессимптомного развития первых стадий опухолевого образования, также из-за сопутствующих недомоганий простаты. Сегодня полностью не изучены причины проявления ракового заболевания предстательной железы. Но эпидемиологические обследования предоставили возможность выделить комплекс причин риска формирования болезни.

Доказано, что раковое заболевание простаты редко проявляется у возрастной категории мужчин до 50 лет. В результате досконального микроскопического анализа органа мужчин, которые умерли после 50 лет не от ракового заболевания, у 15 процентов были обнаружены очаги новообразований. У мужчин, умерших после 85 лет – у 35%. Необходимо понимать, что бессимптомный период формирования рака простаты от начального этапа до клинических проявлений способен продолжаться от нескольких месяцев до нескольких лет.
В этиологии ракового заболевания железы имеет большое значение гормональный статус организма. Работоспособность простаты мужчин старшей возрастной категории зависит от количества в крови тестостерона, который благодаря ферменту 5-альфа редуктазы преобразуется в гормон дигидротестостерон, регулирующий рост, развитие железы. Гормонотерапия успешно подтверждает гормональное предположение в этиологии раковой опухоли простаты.
Признаки рака простаты

Симптоматика ракового заболевания простаты обладает большим количеством разных проявлений. Очень часто на практике при раке простаты встречаются признаки обструкции пузыря мочеиспускательной системы, что связано с возрастной категорией больных, которым уже за 60 лет. Достаточно часто у них дополнительно присутствует доброкачественная гиперплазия железы. Признаки обструкции выражаются в затруднении вывода, слабой струе мочи и пр. Они связаны со сдавливанием канала мочеиспускания образовавшейся опухолью. Обструкция пузыря способна вызывать сопутствующие признаки – повторяющиеся воспалительные процессы путей выведения мочи, которые способны проявляться частым мочеиспусканием с болевыми ощущениями. От большой силы сдавливания может произойти хроническая задержка мочи.
Раковая опухоль простаты способна перейти на кишку. В таких ситуациях болезнь будет сопровождаться запорами, проявлением слизи, кровотечения.

В случае появления дальних метастазов, заболевшие раком простаты пациенты, обращаются к специалистам с жалобами на болевые ощущения в костях. Локализация боли часто аналогична локализации метастазов, кроме конечностей, в которых болевые ощущения происходят из-за сдавливания нервных корешков в случае метастатического поражения позвоночника. Ориентированность боли – ее постепенное увеличение.
Диссеминация опухолевого образования способна привести к поражению почти любой категории лимфоузлов: шейных, надключичных, пр. Состояние пациента со временем становится хуже, появляется кровотечение, кахексия. На первых стадиях раковое образование простаты клинически почти не проявляется, его невзначай диагностируют у 10% больных после хирургического вмешательства.
Анализ железы пальцевым ректальным способом

На первых этапах формирования рак железы развивается без определенной симптоматики. Обычно его выявляют при проведении анализов иных заболеваний. Для обнаружения рака простаты медики часто используют пальцевое раковое обследование больного. Данный метод обследования заключается во введении пальца (двух) руки в прямую кишку для пальпации поверхности простаты. По результатам такого исследования в большей степени определяется размер опухолевого образования, его локализация. При ректальном методе обследования пациент должен находиться лежа на правом боку, коленно-локтевой позе.

Пальпация предстательной железы дает возможность обнаружить следующие признаки опухоли:
- пальпируемые семенные пузыри;
- асимметрия органа;
- неподвижность простаты;
- уплотнение участка простаты в виде индивидуальных узлов, инфильтратов.
Частота обнаружения раковой опухоли простаты у мужчин возрастной категории за 50 лет в результате пальцевого ректального обследования до 2%. В случае отклонений от нормы при таком исследовании органа вероятность присутствия клинически важной интракапсулярной опухоли простаты (более 0,5 см. куб.) увеличивается в 1,5-2 раза, экстракапсулярной опухоли – в 3-9 раз.
Ультразвуковая диагностика раковой опухоли простаты
Самой характерной приметой рака простаты является гипоэхогенный очаг на периферическом участке предстательной железы. Таких очагов может быть большое количество. Некоторые заболевания органа также способствуют возникновению гипоэхогенных зон: атрофия простаты, воспалительный процесс, острый простатит, туберкулез и пр. Поэтому для установления характеристики гипоэхогенного очага требуется проведение биопсии.
а) Терминология:
1. Аббревиатура:
• Рак предстательной железы (РПЖ)
2. Синоним:
• Аденокарцинома предстательной железы
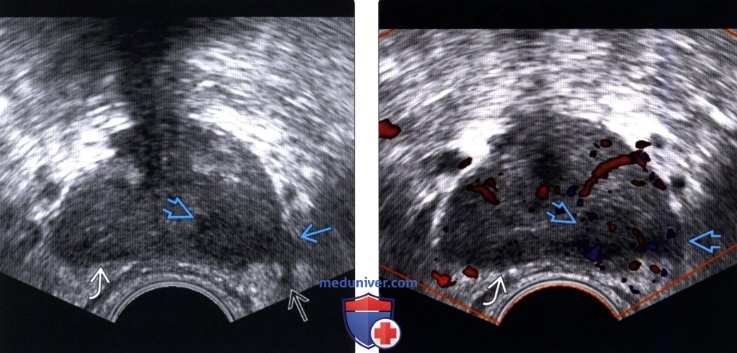
(Левый) На поперечном ТРУЗ срезе визуализируется гипоэхогенный очаг в левой ПфЗ с выбуханием капсулы и узлами, прорастающими в прилежащую жировую клетчатку и левый сосудисто-нервный пучок (СНП). В правой ПфЗ визуализируется более мелкий очаг.
(Правый) При цветовой допплерографии соответствующей области в образовании левой ПфЗ визуализируется локальная гиперваскуляризация. Очаг в правой ПфЗ имеет умеренную васкуляризацию При простатэктомии подтвержден мультифокальный РПЖ (аденокарцинома 5+5 по Глисону) с левосторонним экстрапростатическим распространением и лимфогематогенной и периневральной инвазией. 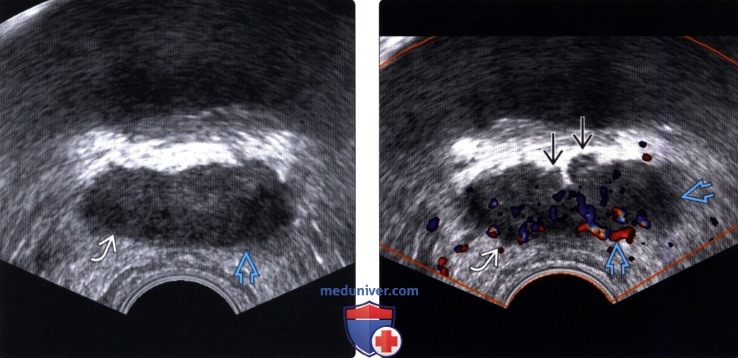
(Левый) На поперечном ТРУЗ срезе визуализируются гипоэхо-генные новообразования в правой и левой ПфЗ, прорас тающие кверху в семенные пузырьки (СП) и основание мочевого пузыря с левосторонним выбуханием капсулы и неровностью контуров.
(Правый) На поперечном ТРУЗ срезе на немного более высоком уровне (основания и семенных пузырьков) визуализируется гиперваскуляризация в соответствующих гипоэхогенных очагах правой и левой ПфЗ и СП. Двусторонняя инвазия в СП была подтверждена при простатэктомии. СП инвазия (стадия Т3В) корреллирует с повышенным риском рецидива после лечения. 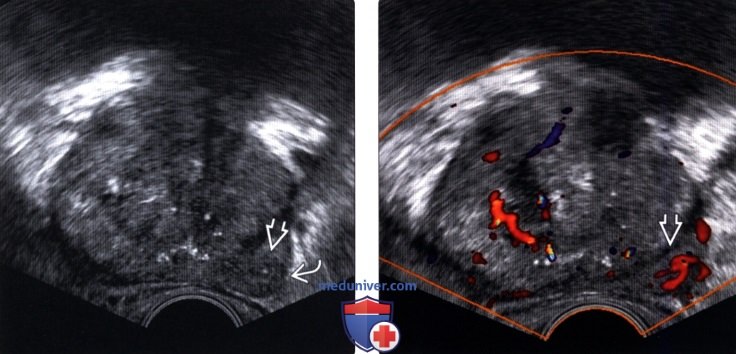
(Левый) На поперечном ТРУЗ срезе визуализируется локализованная гипоэхогенная область в левой ПфЗ с небольшим выпячиванием контура.
(Правый) При цветовой допплерографии на том же уровне визуализируется гиперваскуляризация в этой области. При гистологическом исследовании после прицельной биопсии был диагностирован локализованный простатит.
3. КТ при раке предстателььной железы:
• Неточный метод выявления рака предстательной железы
• Glazer и соавт. выявили, что опухолевидное контрастирование ПфЗ позволяет заподозрить низкодифференцированный рак (≥Глисон 4 + 3)
• Оценить местное/отдаленное распространение только у пациентов с опухолями среднего и высокого риска:
о Клиническая стадия >Т2b или 3 (по разным классификациям), Глисон >8, ПСА> 10 или 20, или вероятность поражения лимфатических узлов > 20% (на основе номограмм)
5. Радионуклидная диагностика:
• Сцинтиграфия костей:
о Сканирование костей с Тс-99m МДФ является стандартным методом диагностики костных метастазов: чувствительность 62-89%, специфичность 57%; отражает реакцию остеобластов в компактном веществе кости, не выявляет раннего поражения костного мозга
о Следует выполнять только пациентам с опухолью высокого риска или симптомами поражения костей: клиническая стадия ≥Т2с или 3 (разные классификации), Глисон ≥8, ПСА>10 или 20 или симптомы поражения костей
о ОФЭКТ (однофотонная эмиссионная КТ) с Тс-99m МДФ обладает большей чувствительностью (92%) и специфичностью (82%)
• ПЭТ-КТ:
о Основная роль ПЭТ-КТ заключается в начальном установлении стадии и оценке биохимических рецидивов заболевания; не используется в диагностике или постановке Т-стадии
о ПЭТ-КТ с 18F-ФДГ: ограниченное применение вследствие относительно низкого метаболизма глюкозы при большинстве типов РПЖ
о ПЭТ-КТ с 18F-фторидом натрия (NaF): для выявления костных метастазов; более высокая диагностическая точность, однако, возможно, более дорогой метод, чем сцинтиграфия + ОФЭКТ
о ПЭТ-КТ с 11С-холином: ограниченная доступность, требует наличия циклотрона в клинике; возможность выявления опухоли в неувеличенных лимфоузлах и раннего вовлечения костного мозга; применяется при подозрении на рецидив заболевания
6. Рекомендации по визуализации:
• Важнейшие методы визуализации:
о МРТ-наиболее чувствительный метод диагностики рака предстательной железы и установления стадии
о ТРУЗ-метод выбора при биопсии предстательной железы
в) Дифференциальная диагностика рака предстательной железы:
1. Доброкачественная гиперплазия предстательной железы:
• Гиперплазия ПЗ и периуретральных желез; гетерогенное, узловое увеличение железы ± кистозная дегенерация, кальцинаты
2. Простатит:
• Острый и хронический простатит может имитировать рак предстательной железы
• ПфЗ: может вызывать ↓ сигнал на Т2ВИ и карте измеряемого коэффициента диффузии (ИКД); также может быть гиперваскулярной
3. Атрофия:
• В норме при старении или хроническом воспалении
• Обычно клиновидные очаги ↓ Т2 сигнала и умеренно ↓ ИКД на картах указывают на потерю железистой ткани (однако обычно сигнал не такой низкий, как при раке)
4. Фиброз:
• Может развиваться в исходе воспалительного процесса, при визуализации имеет клиновидную или лентовидную форму с низкоинтенсивным сигналом на Т2-ВИ
5. Простатическая интраэпителиальная неоплазия (ПИН):
• Дисплазия эпителиального слоя предстательной железы
• Тактика ведения низкодифференцированной ПИН является спорной; диагноз РПЖ при повторной биопсии аналогичен таковому у мужчин, у которых при исходной биопсии изменения не выявлены
6. Атипия (или атипическая мелкоацинарная пролиферация [АМАП]):
• Описательный термин: когда результаты тонкоигольной биопсии, очень подозрительны на РПЖ, но не удовлетворяют критериям РПЖ
• При других отрицательных показателях требуется повторная биопсия в динамике, так как примерно у 40% мужчин с атипией при повторной биопсии будет диагностирован РПЖ
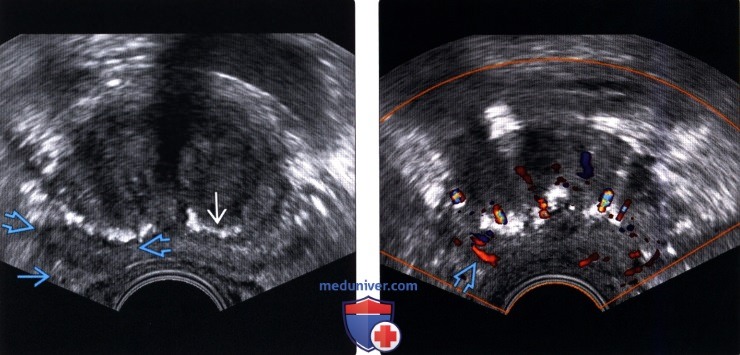
(Левый) На поперечном трансректальном УЗ срезе среднего отдела предстательной железы визуализируется едва различимый ограниченный гипоэхогенный очаг в правой ПфЗ. Кальцинированные амилоидные тельца с акустическим затенением по краю хирургической капсулы указывают на границу между центральной зоной и ПфЗ. Правый сосудисто-нервный пучок не изменен.
(Правый) На соответствующем УЗ срезе с цветовой допплерографией в гипоэхоген-ном очаге правой ПфЗ визуализируется локальная гиперваскуляризация При прицельной биопсии этого участка верифицирована аденокарцинома 3+3 по Глисону 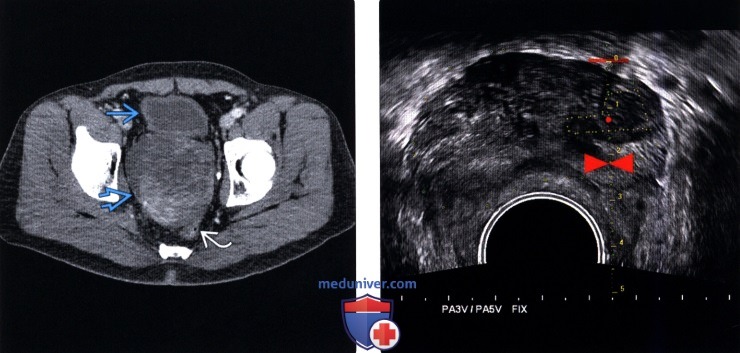
(Левый) На аксиальном КТ срезе с контрастированием визуализируется крупное новообразование, неоднородно накапливающее контраст, с очагами некроза. Мочевой пузырь отделен, а прямая и сигмовидная кишка смещены опухолью в латеральном направлении. При гистологическом исследовании верифицирована веретеноклеточная синовиальная саркома.
(Правый) На поперечном трансректальном УЗ срезе в левой ПЗ визуализируется локализованное гипоэхогенное образование (частично выделено желтой пунктирной линией). Разметка соответствует ходу иглы при биопсии. При гистологическом исследовании после биопсии под МР-УЗИ контролем верифицирована аденокарцинома 4+4 по Глисону 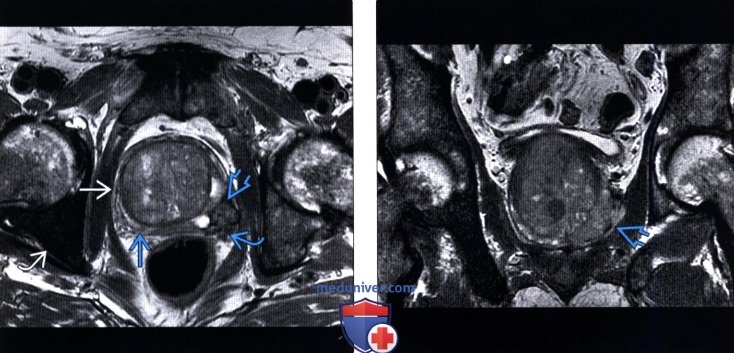
(Левый) На аксиальном Т3 МР срезе визуализируется увеличенная предстательная железа, в левой ПфЗ которой расположен очаг с нечеткими контурами и экстрапростратическим распространением, прорастающий в левый СНП. Обратите внимание на гиперплазированную переходную зону, сдавливающую ПфЗ, и сигнал неоднородной интенсивности от костного мозга со значительно гипоинтенсивной правой вертлужной впадиной, что соответствует распространенным костным метастазам (подтвержденным позднее при сцинтиграфии костей).
(Правый) На фронтальном Т2-МР срезе у этого же пациента визуализируется образование в левой ПфЗ с экстра простатическим распространением в левую мышцу, поднимающую задний проход; рак предстательной железы 3-й стадии.
1. Общая характеристика:
• Этиология:
о Неизвестна: вклад вносят возраст, гормоны, окружающая среда и генетические факторы
• Наиболее распространенная некожная злокачественная опухоль в западном мире, вторая по распространенности причина смерти от рака среди мужчин
2. Стадирование, степени и классификации рака предстательной железы:
• Стадирование на основе TNM-классификации, уровня ПСА в момент постановки диагноза и шкалы Глисона
• Оценка по шкале Глисона: два параметра; первый — преобладающее гистологическое строение [в первом биоптате]; второй-гистологическая картина во втором биоптате; каждое значение варьирует от 1 до 5 (от наименее до наиболее злокачественного)
• Т-классификация:
о Т1: клинически локализованная (опухоль не пальпируется при пальцевом ректальном исследовании (ПРИ))
о Т2: опухоль ограничена предстательной железой
о Т3: местное распространение за пределы капсулы предстательной железы
о Т4: Несмещаемая опухоль или опухоль, прорастающая в соседние структуры (кроме семенных пузырьков): наружный сфинктер уретры, прямую кишку, мочевой пузырь, мышцы, поднимающие задний проход и/или стенку малого таза
• N-классификация: N0: метастазы в [региональных] лимфоузлах отсутствуют, N1: имеются метастазы в региональных лимфоузлах
• М-классификация: МО: отсутствуют отдаленные метастазы, М1: метастазы в нерегиональных лимфатических узлах, костях или другой локализации
3. Микроскопия:
• 95% опухолей-ацинарная аденокарцинома
г) Клинические особенности:
1. Проявления рака предстательной железы:
• Основные симптомы:
о Ранние стадии: бессимптомное течение, повышенный уровень ПСА при скрининге
о Поздние: нарушения мочеиспускания, гематоспермия, гематурия, боль/дискомфорт в области таза, недержание мочи, эректильная дисфункция, боли в костях, в редких случаях -прямокишечная непроходимость
о В целом, большинство специалистов согласны с необходимостью выполнения биопсии предстательной железы под ТРУЗ контролем при изменениях во время ректального исследования или повышении ПСА (>4,0 нг/мл):
— Осложнения тонкоигольной биопсии под ТРУЗ контролем: сепсис (1 -4%), гематурия (чаще всего), ректальное кровотечение, вазовагальный криз, гематоспермия
• Диагностика: патологоанатомическое исследование
• Современные методы выявления рака предстательной железы: ПРИ, уровень ПСА в сыворотке крови, биопсия под ТРУЗ контролем ± МРТ
2. Демография:
• Возраст:
о Средний возраст при постановке диагноза — 66 лет, редко не испаноговорящие европейцы > азиаты и латиноамериканцы
3. Эпидемиология:
о Гетерогенное заболевание, и большинство мужчин с раком предстательной железы (РПЖ) в конечном итоге умирают от других причин
4. Течение и прогноз:
• Пятилетняя относительная выживаемость:
о Локализованный в предстательной железе (стадии I и II по AJCC): почти 100%
о Региональное поражение (III и IV стадии по AJCC без отдаленных метастазов): почти 100%
о Отдаленные метастазы (другие типы рака IV стадии по AJCC = поздние стадии): 28%
• Несмотря на большие объем опухоли и значения ПСА при диагностике, рак ПЗ реже сопровождается инвазией в семенные пузырьки, экстрапростатическим и лимфо- и гематогенным распространением
5. Лечение рака предстательной железы:
• Сложная тактика ведения вследствие трудности точного стадирования и прогноза скорости прогрессирования заболевания
• Разновидности лечения: динамическое наблюдение, таргетированная местная терапия, радикальная простатэктомия, различные формы лучевой терапии, гормональная терапия, химиотерапия, комбинированное лечение
д) Диагностическая памятка. Советы по интерпретации изображений:
• Классическое описание гипоэхогенного очага предстательной железы при РПЖ имеет меньшую ценность в эпоху ПСА, когда рак диагностируют на ранних стадиях; более 30-40% РПЖ не визуализируются при ТРУЗИ
е) Список использованной литературы:
1. Trabulsi EJ et al: Enhanced transrectal ultrasound modalities in the diagnosis of prostate cancer. Urology. 76(51:1025-33, 2010
2. Trabulsi E, Halpern E, Gomella L. Ultrasonography and Biopsy of the Prostate. In Campbell-Walsh Urology (10th ed., pp. 2735-2747). Philadelphia:Saunders.
3. Harvey Q et al: Applications of transrectal ultrasound in prostate cancer. Br J Radiol. 85 Spec No 153-17, 2012
4. Onur R et al: Contemporary impact of transrectal ultrasound lesions for prostate cancer detection. J Urol. 172(2):512-4,2004
5. Wollin DA et al: Guideline of Guidelines: Prostate Cancer Imaging. BJU Int. ePub, 2015
6. Bouchelouche К et al: Advances in imaging modalities in prostate cancer. Curr Opin Oncol. ePub, 2015
Редактор: Искандер Милевски. Дата публикации: 19.11.2019
