Для равномерного распределения препарата в молочной железе и зонах регионарного метастазирования катетеризируют подключичную артерию. Используют тонкий катетер (внутренний диаметр 1,5 мм), который через просвет, иглы после пункции артерии вводят в одну из ветвей (лучше всего в a. thoracoacromialis) и фиксируют 2—3 шелковыми лигатурами. Чаще всего лечение проводят сочетанием 5-ФУ (суточная доза 0,5—1 г, курсовая — 2—6 г) с циклофосфаном (суточная доза 0,2—0,4 г, курсовая— 1,6—6 г) или тиофосфамидом (суточная доза 10—30 мг, курсовая — 70—240 мг) на протяжении 4—30 дней.
Применение такой методики внутриартериальной химиотерапии позволило А. П. Баженовой и Ю. Д. Лазичеву 1973) в дальнейшем оперировать 89 из 119
леченых больных, а в других случаях при сочетании с местным лучевым воздействием добиться длительной стабилизации процесса.
Внутриартериальная химиотерапия, помимо технических трудностей, имеет ряд недостатков, значительно сужающих возможности метода. Во-первых, даже после достижения клинического эффекта большая часть клеток опухоли остаются жизнеспособными и опухоль может вновь быстро развиваться. Во-вторых, отмечаются местные осложнения, связанные как с самой катетеризацией артерий и инфузией, так и с сосудистыми расстройствами, возникающими после введения растворов.
Гораздо более широкое применение при лечении первичных форм рака молочной железы не только операбельных, но и местнораспространенных форм получила так называемая системная химиотерапия, проводимая внутривенно. Простота выполнения и относительная безопасность делают ее общедоступной. Кроме того, при системной химиотерапии происходит подавление опухолевых клеток и их комплексов главным образом в отдаленных органах и тканях; при этом экспериментально доказано исчезновение карцинемии. Указанная методика широко используется в качестве дополнительного лечения первичных операбельных раков, а при местнозапущенных процессах — в комбинации с лучевым лечением и гормонотерапией. Не столь редки случаи регресса первичного опухолевого узла и регионарных метастазов под воздействием многократных курсов системной моно- или полихимиотерапии.
При внутривенном введении химиотерапевтических препаратов следует иметь в виду ряд моментов, связанных с разовой и суммарной дозировкой, длительностью курсов и интервалов между ними, необходимостью стимуляции гемопоэза во время лечения.
В настоящее время разовые и суммарные дозы рассчитывают с учетом площади тела, однако для практических врачей удобнее приводить их абсолютное значение, что мы и будем делать при последующем изложении.
2. Длительность курсов химиотерапии и режим введения препаратов варьируют в зависимости от используемых средств. При монохимиотерапии тиофосфамидом или бензотэф введение начинают во время мастэктомии (после диссекции подключичной вены) в дозе 20—40 мг * (для бензотэф 24—47 мг). В дальнейшем препараты вводят через 1—2 дня. Курс обычно длится 3—4 нед. Суммарная доза для тиофосфамида 200—260 мг, бензотэф — 240—480 мг, циклофосфана (циклофосфамида) и эндоксана — 4—6 г. Хорошо зарекомендовал себя при монохимиотерапии йодбензотэф. Схема его применения наиболее проста: внутрь по 200 мг (4 таблетки по 50 мг во время еды, запивать киселем) через день 7 раз (т. е. 1400 мг), затем после двухдневного перерыва — через 2 дня до развития лейкопении. Суммарная доза не превышает 3000 мг. Перерыв между курсами 6—8 нед. Как указано выше, курсы монохимиотерапии с интервалами не более 6—8 нед необходимо повторять 3—4 раза и более.
Применение антиметаболитов (5-ФУ, фторафур, метотрексат) без алкилирующих или других препаратов при дополнительной терапии первичных операбельных форм, по нашим данным, недостаточно эффективно не только из-за сравнительно высокой токсичности этих средств и быстрого развития резистентности к ним, но так же из-за узости терапевтического действия. Значительно выгоднее использовать антиметаболиты в сочетании с алкилирующими агентами, винкаалкалоидами, противоопухолевыми антибиотиками. Такие сочетанные курсы проводили главным образом при рецидивах и метастазах, но в последнее время нередко и при дополнительной химиотерапии после мастэктомии, получили широкое распространение в виде схемы CMFVP **, более известной в СССР как схема Купера (Cooper, 1969), по которой лечение проводят 4—6 нед без перерыва.
* Введение больших разовых доз этих препаратов нецелесообразно, поскольку не приводит ни к увеличению концентрации препарата в крови, ни к задержке его в организме (Филов В. А., Бавли Я. Л., 1974).
** Аббревиатура из начальных букв названий препаратов: С — циклофосфан, М — метотрексат, F — фторурацил, V — винкристин, Р — преднизолон.
Химиотерапевтический метод лечения онкологии предполагает токсическое воздействие на ткани опухоли посредством специальных лекарственных препаратов. При этом происходит избирательное ингибирование процессов роста и деления опухолевых клеток.
Процедура внутриартериальной химиотерапии
Для больного в индивидуальном порядке подбирается препарат, который вводят в основную артерию, питающую область расположения опухолевого образования. В результате противоопухолевое средство доставляется именно к пораженной зоне, попадая в первичное капиллярное русло. Медленный кровоток способствует хорошей абсорбции препарата патологическими клетками.
Для внутриартериальной химиотерапии применяются те же препараты, что и в классической химиотерапии, но в процессе процедуры можно избежать серьезных отравлений. Этот метод очень эффективен в случае значительных образований, но стоит отметить тот факт, что каждый вид опухоли по-разному реагирует на высокодозную химиотерапию, что объясняется во многом их васкуляризацией и анатомическим положением.
Для одних опухолей нужна очень большая концентрация цитостатика, а для других – достаточно не очень высокой дозы, чтобы достичь ожидаемого результата. В региональной химиотерапии в зависимости от методики больному вводят средство в концентрации 3-10 (иногда доходит и до 70) раз больше, чем при системной химиотерапии.
Когда необходима внутриартериальная химиотерапия
На сегодняшний день внутриартериальная химиотерапия применяется как часть комплексного лечения многих онкологических болезней. В частности его используют для уменьшения объема опухоли перед операцией, что позволяет минимизировать хирургическое вмешательство и уменьшить способность опухолевого очага к метастазированию в процессе операции (неоадъювантная химиотерапия).
С целью профилактики внутриартериальную химиотерапию применяют для угнетения скрытых очагов распространения онкологического процесса после хирургической операции либо поле сеансов лучевой терапии.
Побочные явления и общее токсическое воздействие при региональной химиотерапии являются незначительными даже при значительной интенсивности локального воздействия ввиду того, что данный метод ограничивается одним органом или зоной. Практика доказала, что в 95% случаев пациенты хорошо переносят данную процедуру, качество жизни не становится хуже, а иногда и улучшается.
При каких заболеваниях проводится внутриартериальная химиотерапия
Замечено, что на внутриартериальную химиотерапию лучше всего реагируют опухоли головы и шеи, рак желудка, пищевода, молочной железы, ротоглотки, яичников, мочевого пузыря, анального канала, карциноид, холангиоцеллюлярный рак, саркомы нижнего брюшного отдела, саркомы мягких тканей конечностей и костей.
Меньшую эффективность метод показывает при гепатоцелюллярной и бронхиальной карциноме, при раке шейки матки, простаты, поджелудочной железы, щитовидной железы. Злокачественная меланома, рак желчевыводящих путей, желчного пузыря, колоректальный рак слабо отвечают на воздействие внутриартериальной химиотерапии.
Для подбора эффективного метода лечения вы можете обратиться за
— методы инновационной терапии;
— возможности участия в экспериментальной терапии;
— как получить квоту на бесплатное лечение в онкоцентр;
— организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.

В настоящее время рак молочной железы (РМЖ) занимает первые ранговые места как в онкологической заболеваемости среди женщин, так и в онкологической смертности [4]. Отёчный рак молочной железы (ОРМЖ) выделяется в особую клинико-морфологическую форму и, по данным разных авторов, встречается у 1-6% больных РМЖ. Данная форма заболевания известна своим неблагоприятным прогнозом: общая 5-летняя выживаемость вследствие агрессивности ОРМЖ не превышает 12-50%.
Для отечного РМЖ характерны признаки агрессивного поведения: на момент постановки диагноза у 95% пациенток регистрируется поражение регионарных лимфоузлов над- и подключичной, аксиллярной групп; стремительное прогрессирование болезни у большинства больных, неизбежно заканчивающееся смертью пациенток [5; 9]. Подходы к лечению ОРМЖ значительно изменились за последние десятилетия. Продолжительность жизни больных в случае использования только оперативного лечения составляет от 12 до 32 месяцев [9]. Комбинация хирургического и радиотерапевтического методов позволяет значительно улучшить местный контроль, но не влияло на появление отдаленных метастазов; не было выявлено и изменения выживаемости больных. Целью введения в практику системной химиотерапии явилась девитализация определяемых и возможных скрытых метастазов в различных органах, а также местная ликвидация первичного опухолевого процесса [2].
При ОРМЖ особой задачей химиотерапии, как этапа комплексного лечения, является резорбция опухоли и расширение возможности последующего хирургического, лучевого и лекарственного воздействия [6; 8]. Поэтому определенный интерес вызывает изучение возможности сочетания регионарной внутриартериальной полихимиотерапии с облучением, для получения синергизма эффектов этих воздействий. Преимущество направленной внутриартериальной доставки цитостатических препаратов заключается в создании повышенной концентрации в зоне поражения, а также радиомодификации. По данным ряда авторов, направленная доставка цитостатиков обеспечивает повышение их локальной концентрации более чем в 10 раз по сравнению с системной химиотерапией [3; 9]. Чем больше концентрация препарата, тем скорее можно ожидать уменьшения массы и объема новообразования и регионарных метастазов, перевода нерезектабельной опухоли в резектабельную [11; 12]. Сочетание системной химиотерапии с внутриартериальным введением ХТ предполагает не только улучшение локального контроля с переводом опухоли в операбельное состояние, но и улучшение отдаленных результатов лечения (общей и безрецидивной выживаемости) [3; 5]. Однако результаты лечения данной категории пациенток до сих пор остаются неудовлетворительными. В связи с этим возникла необходимость в комбинации существующих методов – сочетанного применения химиолучевой терапии с использованием селективной внутриартериальной полихимиотерапии в режиме химиоэмболизации или химиоинфузии внутренней и (или) наружной грудных артерий, с последующей радикальной лучевой терапией. Наряду с взаимным усилением действия, приводящим к повышению эффективности, сочетание данных методов может привести к развитию серьезных нежелательных явлений, что существенно может сказаться на качестве жизни больных. Исследование в данном направлении является актуальным и позволит проанализировать безопасность новой методики комбинированного лечения РМЖ, определить частоту и степень возникающих осложнений [1].
Цель исследования: оценка частоты лучевых реакций и осложнений, определение переносимости и безопасности комбинированного химиолучевого лечения больных ОРМЖ с использованием селективной внутриартериальной полихимиотерапии в режиме химиоэмболизации или химиоинфузии внутренней и (или) наружной грудных артерий, с последующей радикальной лучевой терапией.
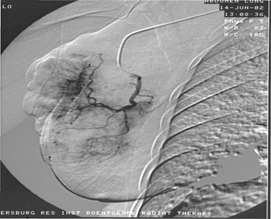
Методика внутрисосудистой (рентгеноэндоваскулярной) ХТ заключалась в пунктировании бедренной, подмышечной или плечевой артерии со стороны, соответствующей пораженной молочной железе. Катетер 4-5F (IF=0,33) устанавливали в подключичной артерии и выполняли ангиографию. Особенности кровоснабжения молочной железы и опухолевого узла оценивали на экране монитора и снимках (рис. 1). Тем же катетером или микрокатетером 2,5 F выполнялась селективная катетеризация сосуда/сосудов, наиболее заинтересованных в кровоснабжении опухоли или МЖ (катетеризировалась внутренняя и/или наружная грудная артерия).
a 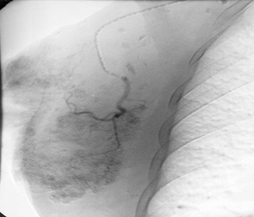
b
Рис. 1. Ангиограмма левой медиальной грудной артерии: a — выраженная неоваскуляризация опухолевого узла; b — отсроченное накопление масляного эмболизата в опухоли, окклюзия питающих артерий
Далее выполнялась селективная ангиография внутренней и наружной грудной артерий, посредством того же катетера осуществляли инфузию 2-3 мл раствора Methylenum coeruleum. Перекрашивание кожи грудной стенки и молочной железы (обычно в интервале 1-3 минут) позволяло высказать предположение об особенностях кровоснабжения опухолевого узла и прилежащих к нему тканей из бассейна внутренней или наружной грудной артерий (рис. 2).
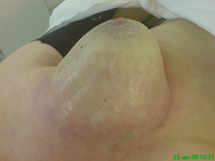
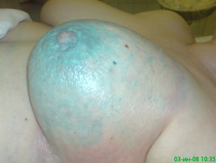
Рис. 2. Введение раствора Methylenum coeruleum выявило, что кровоснабжение опухоли осуществляется из левой внутренней и наружных грудных артерий
Катетер (или микрокатетер) устанавливали в выбранном сосуде и, в зависимости от задач, проводили селективную эмболизацию или химиоинфузию. После ХЭ или ХИ начинали лучевую терапию (ЛТ). Облучение проводили 5 р/нед., в режиме среднего фракционирования дозы (3 Гр) до суммарной дозы (СОД) на основание МЖ 48 Гр, что соответствовало СОДэкв 60 Гр в пересчете на стандартное фракционирование 2 Гр, на зоны регионарного лимфооттока 36-39 Гр фигурным полем – СОДэкв 46-48 Гр.
Всем больным в оцениваемой группе непосредственно перед введением специфических противоопухолевых препаратов, учитывая высокую эметогенность применяемой схемы комбинированной химиотерапии, вводили противорвотные препараты – антагонисты 5-НТ3 рецепторов, в ряде случаев назначение противоопухолевых препаратов сочетали с внутривенным введением дексаметазона с целью потенцирования эффекта противорвотных препаратов. Во 2-3 дни после проведенного курса химиотерапии назначались антагонисты 5-НТ3 рецепторов с целью профилактики отсроченных тошноты и рвоты. В качестве антиэметиков применялись следующие препараты:
ондансетрон (зофран, латран) в дозе 4-8 мг/сут., гранисетрон (китрил) в дозе 3-6 мг/сут., по показаниям дозы антиэметиков увеличивали. Больным, получавшим ХТ по схеме АТ проводилась поддержка КСФ (филграстим 5 мкг/кг п/к во 2-3 дни).
С целью регистрации возможных непосредственных и отсроченных осложнений перед каждым курсом и далее 1 раз в 2 недели определяли уровни общего билирубина, креатинина сыворотки, уровня аминотрансфераз, щелочной фосфатазы, клинический анализ крови, ЭКГ. Степень гематологической токсичности определялась согласно критериям ВОЗ по шкале Common Toxicity Criteria NCIC. Для профилактики осложнений больным проводилась соответствующая медикаментозная терапия.
Все больные оцениваемой группы завершили запланированное лечение в соответствии с планом лечения. Кожные лучевые реакции на фоне проводимой лучевой терапии были выражены умеренно (1-2 степени), для их купирования применялись салфетки колетекс-димексид, колегель с инкорпорированными лекарственными препаратами с деринатом и лидокаином, а также Колетекс-СМЧ с мочевиной на текстильной основе. Необходимо упомянуть о том, что применение салфеток Колетекс для профилактики начиналось с 1-го дня и завершалось спустя 1 месяц после заключительного сеанса лучевой терапии. Ранние кожные реакции 3 степени были зарегистрированы у 5 пациенток, в общей группе составили 6,5%. У 4 из 5 пациенток это было связано с наличием в анамнезе сахарного диабета 2 типа, а у 1 пациентки с погрешностями при использовании профилактических средств (табл. 1, рис. 3).
Ранние лучевые реакции со стороны кожи
Пациенты группы CMF (n=39)
Пациенты группы АТ (n=38)
0. Нет изменений по сравнению с исходным состоянием

Неоадъювантная внутриартериальная селективная полихимиотерапия
местнораспространенного рака молочной железы
Институт общей и неотложной хирургии АМН Украины
Постоянно и повсеместно продолжающийся в мире рост онкологической заболеваемости и смертности от злокачественных новообразований ставит на повестку дня разработку наиболее эффективных методик лечения. Не вызывает сомнения тот факт, что хирургический метод лечения, как самостоятельный, постепенно утрачивает свои позиции, что особенно остро ощущается на примере рака молочной железы (РМЖ), который согласно концепции B . Fisher является системным заболеванием, при котором на самых ранних этапах уже имеются отдаленные микрометастазы, что является основанием для проведения системной предоперационной или послеоперационной терапии у больных операбельным РМЖ. Необходимо учитывать и тот факт, что многие пациенты обращаются за медицинской помощью на той стадии развития заболевания, когда проведение на первом этапе оперативного лечения уже невозможно. Это больные с местнораспространенными формами РМЖ III ( T 3 N 1 M 0, T 0-3 N 2-3 M 0 и T 4 N 0-3 M 0) и IV стадии во всех случаях, когда единственным отдаленным метастазом является поражение ипсилатеральных надключичных лимфатических узлов. Сюда относится РМЖ с метастатическими конгломератами в подмышечной области, которые вызывают лимфатический отек руки, с диссеминацией опухоли по коже железы, с фиксацией опухоли к грудной стенке, первичные и вторичные отечно-инфильтративные формы, все острые формы (рожеподобная, маститоподобная, панцирная) [2, 3].
Успехи в лечении связаны не только с созданием новых лекарственных препаратов, но и с возросшими хирургическими и радиологическими возможностями, позволяющими активно выполнять циторедуктивные вмешательства.
У больных с сильнозапущенными формами подобные вмешательства позволяют в дальнейшем проводить полноценное противоопухолевое лечение, приводят к избавлению от источника интоксикации, уменьшают опухолевые массы, приводят к ослаблению клинической симптоматики, а также благотворно сказываются на психоэмоциональном состоянии больных, что способствует повышению качества жизни.
Кроме того, у этого контингента больных в последние годы стали широко применять неоадъювантную полихимиотерапию, которая способна индуцировать непосредственный противоопухолевый эффект, снизить биологическую активность опухоли, уменьшить стадию заболевания как за счет уменьшения размеров первичной опухоли, так и подмышечных лимфоузлов, увеличить резектабельность, повысить абластику, определить чувствительность опухоли к химиотерапии (лекарственный патоморфоз). Эффект от химиотерапии коррелирует с продолжительностью безрецидивного периода, а достижение морфологически подтвержденной полной регрессии опухоли достоверно улучшает отдаленные результаты лечения [3, 4].
В связи с незначительным прогрессом в лечении местно-распространенного РМЖ актуальным является также и усовершенствование новых методов лекарственного воздействия, одним из которых является селективная внутриартериальная химиотерапия.
С помощью внутриартериальной химиотерапии селективно повреждаются ткани опухоли, индуцируется состояние клинической ремиссии в виде уменьшения массы и объема новообразования и регионарных лимфатических узлов, уменьшается стадия заболевания, нерезектабельные опухоли переводятся в резектабельное состояние. Неоадъювантная внутриартериальная химиотерапия является альтернативой предоперационной лучевой терапии и сокращает в 2-3 раза период реализации терапевтического эффекта [5].
Применение селективной внутриартериальной химиотерапии рекомендовано как метод выбора в лечении резистентных к системной химиотерапии форм РМЖ, а также как первый этап лечения местно-распространенных форм РМЖ в качестве одного из компонентов комплексного лечения. Реальным стало использование этого метода не только в поздних стадиях заболевания, но и на более ранних этапах.
В Институте общей и неотложной хирургии АМН Украины больным с местнораспространенными формами РМЖ с 2001 г. проводится современная технология неоадъювантной катетерной селективной внутриартериальной полихимиотерапии (ПХТ).
Целью настоящей работы явилось повышение эффективности консервативного лечения местнораспространенного РМЖ.
Материалы и методы. С мая 2001 г. по май 2006 г. в клинике ИОНХ АМНУ было пролечено 26 больных с местнораспространенным РМЖ в возрасте от 32 до 77 лет с морфологически доказанным раком. Коррекция доз химиопрепаратов осуществлялась с учетом показателей общего и биохимического показателей крови. Оценку результатов лечения проводили согласно критериям ВОЗ через 7 недель после начала лечения. Больные получали, как правило, 2 курса селективной внутриартериальной ПХТ с интервалом 24 дня препаратами доксорубицин 40 мг/м2 в первый день и цисплатин 60 мг/м2 во второй день.
Селективная катетеризация афферентных сосудов опухоли молочной железы производилась по методике Сельдингера из бедренного или плечевого доступа. Для внутриартериальной химиотерапии узловых местно-распространенных опухолей молочной железы, расположенных в медиальных квадрантах или в центральной части органа, катетеризировали внутреннюю грудную артерию. При локализации опухолей в наружных квадрантах производили катетеризацию боковой грудной или подлопаточной артерии. Внутриартериальную ПХТ отечно-инфильтративных форм РМЖ производили путем чередования катетеризации внутренней грудной и боковой группы артерий. Инфузию препаратов проводили с помощью автоматического дозатора в течение 3-х часов. Основными проявлениями системной токсичности были миелосупрессия І и ІІ c тепени по шкале токсичности ВОЗ (18 больных — 85%), которые носили обратимый характер. В целях профилактики тошноты и рвоты больные получали ондансетрон по 8 мг и дексаметазон по 12 мг внутривенно.
Оценка объективного эффекта проводилась после 2-х полных курсов ПХТ, как правило, через 6-7 недель после начала лечения. У 5 больных лечение было прекращено после одного цикла ПХТ по следующим причинам: одна пациентка отказалась от дальнейшего лечения, у 3-х отмечено местное прогрессирование болезни, одна пациентка прооперирована по поводу а ррозивного кровотечения из распадающейся опухоли молочной железы.
Полученные результаты: У 15 больных (71,4%) удалось достичь частичной регрессии опухоли и регионарных лимфоузлов. Полной регрессии зарегистрировано не было. Стабилизация заболевания диагностирована в 4 наблюдениях (19,1%). У 2 больных (9,5%) зафиксировано дальнейшее прогрессирование заболевания.
Выводы. 1. Режим цисплатин/доксорубицин является эффективным режимом у больных с местнораспространенными формами РМЖ. Применение данного режима позволило получить в 90% случаев уменьшение объема опухоли более чем на 50%.
2. Токсичность 2-х циклов ПХТ в режиме цисплатин/доксорубицин относительно невысока, проявлялась тошнотой, миелосупрессией І и ІІ ст. по шкале токсичности ВОЗ.
3. Объективным преимуществом использования внутриартериальной ПХТ в не о адъювантном режиме явилось обеспечение возможности перевода в операбельное состояние 71,4% пациенток с первично-неоперабельным РМЖ, а в паллиативном режиме одинаково эффективно в лечении больных как с локорегиональными рецидивами основного заболевания, так и с отдаленными метастазами, что позволяет увеличить продолжительность и качество жизни этой группы пациентов.
4. Селективная внутриартериальная ПХТ для лечения больных с местнораспространенными формами РМЖ может быть широко использована в повседневной практике специализированных клиник и институтов, которые имеют соответствующую аппаратуру.
1. , Махсон операции у больных раком молочной железы // Российский онкологический журнал. – 2005. — №3. – С. 13-14.
2. , Белик и рак молочной железы. Краткое руководство. – Киев. – 2005. – C . 73-80.
3. , , Аблицова отечных форм рака молочной железы // Российский онкологический журнал. – 2003. — №5. – С. 25-26.
4. Руководство по химиотерапии опухолевых заболеваний / Под ред. . – Практ. Мед. – М., 2005. – С. 289.
5. Тарутінов В. І., Югрінов О. Г., Скляр ’ювантна (індукційна) селективна внутрішньоартеріальна поліхіміотерапія місцево-поширених форм раку молочної залози // Методичні рекомендації. – Київ. – 2002. – 5 с.
+7 495 50 254 50
В основе химиотерапевтического метода лечения онкологической патологии лежит токсическое воздействие специальных лекарственных форм на опухолевую ткань, заключающееся в избирательном ингибировании процессов деления и роста раковых клеток.
На сегодняшний день в профильных клиниках Германии успешно используются не только традиционные методы химиотерапии, но и инновационные подходы и, в частности внутриартериальная химиотерапия. При этом введение индивидуально подобранного для пациента противоопухолевого препарата осуществляется непосредственно в основную артерию, питающую зону расположения опухоли. Таким образом, лекарственное средство поступает непосредственно к очагу поражения, попадая в первичное капиллярное русло, медленный ток крови по которому способствует высокой абсорбции медикамента злокачественными клетками.
Внутриартериальная химиотерапия предполагает использование тех же сильнодействующих препаратов, что применяются в классической химиотерапии, однако во время такой процедуры удается избежать тяжелых отравлений. Наиболее эффективен метод при солидных новообразованиях, но, следует отметить, что отнюдь не все разновидности опухолей в одинаковой степени реагируют на высокодозную химиотерапию, что во многом зависит от их васкуляризации и анатомического расположения.
Так, некоторые из них требуют крайне высокой концентрации цитостатического средства, в то время как другим видам достаточно меньшей дозы для ожидаемой реакции. В зависимости от конкретной методики региональной химиотерапии пациенту вводится препарат в концентрации от 3-х до 10-ти (в некоторых случаях до 70-ти!) раз выше, чем при системной химиотерапии.
Сейчас метод внутриартериальной химиотерапии нашел свое место в комплексном лечении целого ряда онкологических заболеваний. В частности он применяется в целях дооперационного уменьшения объема новообразования до таких размеров, чтобы сделать хирургическое вмешательство предельно минимальным и снизить способность опухоли к метастазированию во время операции (принцип неоадъювантной химиотерапии).
Профилактически внутриартериальная химиотерапия назначается для подавления скрытых очагов распространения злокачественного онкопроцесса после проведенного хирургического вмешательства или после курсов лучевой терапии.
Благодаря тому, что региональная химиотерапия всегда ограничена одной областью (органом), побочные эффекты и общее токсическое влияние остаются незначительными даже при очень высокой интенсивности локального воздействия. Как показывает практика, в 95% случаев процедура хорошо переносится больными, не снижая, а временами даже улучшая качество их жизни.
Считается, что лучше всего на внутриартериальную химиотерапию реагируют новообразования головы и области шеи, рак молочной железы, желудка, пищевода, ротоглотки, мочевого пузыря, яичников, анального канала, холангиоцеллюлярный рак, карциноид, саркомы нижнего брюшного отдела, а также саркомы костей и мягких тканей конечностей. Менее эффективен метод при бронхиальной и гепатоцеллюлярной карциноме, при раке поджелудочной и щитовидной желез, простаты и шейки матки. Хуже всего такому лечению поддается злокачественная меланома, колоректальный рак, рак желчного пузыря, желчевыводящих путей.
+7 495 50 254 50 — срочная организация лечения в Германии

Протонная терапия имеет неоспоримые преимущества по сравнению с лучевой терапией, предполагающей использование электронов и фотонов. Заключается она в радиационном воздействии на находящуюся в глубине человеческого тела опухоль потоком ионизированных частиц – протонов, которые несут в себе положительный заряд энергии. Подробнее
На сегодняшний день для лечения такой злокачественной онкопатологии кожи, как базальноклеточный рак (меланома) и сквамозно-клеточная карцинома немецкие доктора применяют инновационный метод оперирования по Мосу (MOHS). Подробнее
Полный текст:
Введение. Рак молочной железы в настоящее время является наиболее часто встречающимся злокачественным новообразованием, с ежегодно увеличивающимися показателями заболеваемости. Одним из новых, перспективных и малоинвазивных направлений лечения рака молочной железы является селективная внутриартериальная химиотерапия. Основной целью данной работы является анализ результатов внутриартериальной химиотерапии у 30 пациенток с раком молочной железы за период 2004-2006 гг. Материалы и методы. Внутриартериальную химиотерапию проводили путем селективной катетеризации внутренней грудной артерии, кровоснабжающей зону опухолевого поражения молочной железы. Применялась общепринятая схема химиотерапии – Таксотер 75мг/м2 + Доксорубицин 60мг/м2 в дозировках для внутривенного введения, скорость инфузии составляла 800-1000 мл/ч. Последовательное внутриартериальное введение химиопрепаратов занимало 3-4 часа. Предоперационная химиотерапия состояла из 4 курсов. Интервал между курсами составлял 3 недели. Результаты. В результате лечения после 2-х курсов химиотерапии частичная регрессия процесса отмечена у 19 (63,3%), стабилизация у 11 (36,7%) больных. После 4-х курсов лечения полная регрессия отмечена у 15 (50%) больных, частичная регрессия у 12 (40%) больных, стабилизация процесса у 3 (10%) больных. В результате вышеуказанного вида лечения 27 (90%) больным удалось провести радикальную мастэктомию. Заключение. Применение внутриартериальной химиотерапии у пациентов в поздних IIIа, IIIб стадиях рака уже после 2-х курсов терапии способствует достижению частичной регрессии. Однако, несмотря на эффективность метода, внутриартериальная химиотерапия является лишь этапом, предшествующим лучевому или хирургическому лечению, поэтому данный метод должен применяться как начальное и важное звено комплексного лечения рака молочной железы.
Ганцев Шамиль Ханафиевич – доктор медицинских наук, профессор, заведующий кафедрой онкологии с курсами онкологии и патологической анатомии ИДПО ФГБОУ ВО БГМУ Минздрава России.
Умарова Карлыгаш Раушановна – врач отделения химиотерапии Южно-Казахстанского областного онкологического диспансера.
Арыбжанов Дауранбек Турсункулович – кандидат медицинских наук, заведующий отделением химиотерапии и эндоваскулярной онкологии Южно-Казахстанского областного онкологического диспансера.
1. Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. 2015;136(5):E359-86. Int J Cancer. DOI: 10.1002/ijc.29210.
2. Гранов АМ, Давыдов МИ, Таразов ПГ, Гранов ДА, и др. Интервенционная радиология в онкологии (пути развития и технологии). СПб:Фолиант;2007. 344 с. [Davydov MI, Granov AM, Tarazov PG, Granov DA, et al. Interventional radiology in oncology (the path of development and technology. St. Petersburg:Foliant;2007. 344 p (in Russ.)].
3. Крытова ЛИ, Гранов АМ, Хазова ТВ, Тарасов ПГ, Суворова ЮВ, Арзуманов АС. Способ лечение инфильтративно-отечного рака молочной железы. Патент 2177349 Российская Федерация от 20.02.2001. [Korytova LI, Granov AM, Khazova TV, Tarazov PG, Suvorova JuV, Arzumanov AS, Method for treating the cases of infiltrating edematous mammary gland cancer. Russian Federation patent 2177349. 2001 Feb 20 (in Russ).]
4. Doughty JC, Mccarter DHA, Kane E, Reid AW, Cooke TG, McArdle CS. Anatomical basis of intra-arterial chemotherapy for patients with locally advanced breast cancer. Br J Surg. 1996;83(8):1128-30. PMID: 8869324.
5. Kitagava K, Yamakado K, Nakatsuka A, Tanaka N, Matsumura K, Takeda K, et al. Preoperative transcatheter arterial infusion chemotherapy for locally advanced breast cancer (stage IIIb) for down-staging and increase of respectability. Eur J Radiol. 2002;43(1):31-36. DOI: 10.1016/S0720048X(01)00417-X.
6. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet. 2005;365(9472):1687-717. DOI:10.1016/S0140-6736(05)66544-0.
7. Бондарь ГВ, Седаков ИЕ, Балашова ОИ, Хоменко А.В. Селективная двухэтапная внутриартериальная химиотерапия в комплексном лечении больных раком молочной железы. Новообразование. 2012;5(1-3):262-269. [Bondar GV, Sedakov IY, Balashova OI, Khomenko AV. The selective twostage intraarterial chemotherapy in complex treatment of patients with breast cancer. Neoplasm. 2012;5(13):262-269 (in Russ.)].
8. Бесова НС. Выбор адъювантной лекарственной терапии на основе молекулярной классификации рака молочной железы. Опухоли женской репродуктивной системы. 2012;(3-4):61-73. [ Besova NS. Choice of adjuvant drug therapy on the basis of the molecular classification of breast cancer. Tumors of female reproductive system. 2012;(3-4):61-73 (in Russ.)].
9. Артамонова ЕВ. Адъювантная химиотерапия рака молочной железы, значение молекулярно-генетического подтипа. Онкогинекология. 2014;(1):418. [Artamonova EV. Adjuvant chemotherapy for breast cancer, the relevance of molecular genetic subtype. Oncogynecology. 2014;(1):4-18 (in Russ.)].
10. Смирнов ВН, Хлопушин ЕЮ, Трухин ДВ. Cочетанное применение внутриартериальной полихимиотерапии и криодеструкции в лечении распространенного рака молочной железы. Унiверситетська клiнiка. 2013;9(1):78-82. [Smirnov VN, Hlopushin YeYu, Trukhin DV. Combined application of intra-arterial polychemotherapy and cryolysis in treatment of advanced breast cancer. University Hospital. 2013;9(1):78-82 (in Russ.)].
11. Veronesi U, Boyle P, Goldhirsch A, Orecchia R, Viale G. Breast cancer. Lancet. 2005;365(9472):172741. DOI: 10.1016/S0140-6736(05)66546-4.
12. Vinh-Hung V, Verschraegen C, Promish DI, Cserni G, Van de Steene J, Tai P, et al. Ratios of involved nodes in early breast cancer. Breast Cancer Res. 2004;6(6): R680-88. DOI: 10.1186/bcr934.
13. Lee YT. Breast carcinoma pattern of metastasis at autopsy. J Surg Oncol. 1983;23(3):175-80. PMID: 6345937.
14. Buijs M, Kamel IR, Vossen JA, Georgiades CS, Hong K, Geschwind JF. Assessment of metastatic breast cancer response to chemoembolization with contrast agent enhanced and diffusion-weighted MR imaging. J Vasc Interv Radiol. 2007;18(8):957-63. DOI: 10.1016/j.jvir.2007.04.025.
15. Семиглазов ВФ, Семиглазов ВВ, Палтуев РМ, Дашян ГА, Донских РВ, Комяхов АВ, и др. Aдъювантная химиотерапия рака молочной железы: поиск новых путей планирования. Вопросы онкологии. 2014;60(1):102-108. [Semiglazov VF, Semiglazov VV, Paltuev HM, Dashyan GA, Donskikh RV, Komyakhov AV, et al. Adjuvant chemotherapy for breast cancer: search for new ways of planning. Problems in ongology. 2014;60(1):102-108 (in Russ.)].
16. Болотина ЛВ, Дешкина ТИ, Крамская ЛВ. Эволюция адъювантной химиотерапии при раке молочной железы. Онкология. Журнал им. П.А. Герцена. 2014;2(1):37-44. [Bolotina LV, Deshkina TI, Kramskaia LV. Evolution of adjuvant chemotherapy for breast cancer. Onkologiya. Zhurnal imeni P.A. Gertsena. 2014;2(1):37-44 (in Russ.)].
17. Семиглазов ВФ. Рак молочной железы: клинико-экспериментальные исследования. Вопросы онкологии. 2016;62(2):208-213. [Semiglazov VF. Breast cancer: clinical and experimental research. Problems in oncology. 2016;62(2):208-213 (in Russ.)].
18. Кононенко ИБ, Манзюк ЛВ, Гребенникова ОП. Адъювантная овариальная супрессия и особенности оценки менструального цикла после химио терапии у женщин с гормоночувствительным раком молочной железы. Онкогинекология. 2017;(2):2128. [Kononenko IB, Manzyuk LV, Grebennikova OP. Adjuvant ovarian suppression and specific considerations regarding a recognition of menstrual cycle after chemotherapy in women with hormone receptor-positive breast cancer. Oncogynecology. 2017;(2):21-28 (in Russ.)].
19. Ni S, Liu L, Shu Y. Sequential transcatheter arterial chemoembolization, three-dimensional conformal radiotherapy, and high-intensity focused ultrasound treatment for unresectable hepatocellular carcinoma patients. J Biomed Res. 2012;26(4):260-67. DOI: 10.7555/JBR.26.20120016.
20. Kim B, Kim K, Im KH, Kim JH, Lee JH, Jeon P, et al. Multiparametric MR imaging of tumor response to intraarterial chemotherapy in orthotopic xenograft models of human metastatic brain tumor. J Neurooncol. 2016;127(2):243-51. DOI: 10.1007/s11060-015-2041-5.
21. Zhang W, Liu R, Wang YY, Qian S, Wang JH, Yan ZP et al. Efficacy of intraarterial chemoinfusion therapy for locally advanced breast cancer patients: a retrospective analysis of 28 cases. Onco Targets Ther. 2013;6: 761-765. DOI: 10.2147/OTT.S44882.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
