Тамоксифен — это препарат, который используется во всем мире для лечения рецепторного рака эстрогена (ER) в течение более 30 лет; он использовался как в метастатических, так и в адъювантных условиях. Утверждение Тамоксифена по снижению риска рака молочной железы относится к 1998 году, после результатов исследования по профилактике рака молочной железы, которое спонсировалось Национальным институтом рака и Национальным проектом хирургической адъювантной груди и кишечника, показало 49% -ное сокращение числа инвазивных, ER-положительный рак молочной железы у женщин высокого риска. Тем не менее, несмотря на эти позитивные результаты, отношение общественности к химиопрофилактике рака молочной железы остается неоднозначным, а токсичность, связанная с тамоксифеном, особенно раком эндометрия и тромбоэмболическими осложнениями, препятствует поглощению препарата женщинами высокого риска, которые должны извлечь выгоду из своих превентивных эффектов. Среди стратегий преодоления таких препятствий для профилактического тамоксифена в настоящем документе обсуждаются два новых и потенциально безопасных способа доставки этого агента. Низкодозовый тамоксифен, который, как ожидается, даст меньше побочных эффектов, исследуется как в клинических исследованиях на основе биомаркеров, так и в обсервационных исследованиях. Известно, что ряд системных биомаркеров (включая уровни липидного и инсулиноподобного фактора роста) и тканевые биомаркеры (включая Ki-67) благоприятно влияют на обычное дозирование тамоксифена и, как было показано, модулируются в направлении, согласующемся с предполагаемым анти- -касканный эффект. Эти данные свидетельствуют о возможных благоприятных клинических профилактических эффектах режимами приема тамоксифена с низкой дозой, и они подтверждаются обсервационными исследованиями. Альтернативным подходом является местное введение активных метаболитов тамоксифена непосредственно на грудь, место, где следует предотвратить рак. Ожидается, что предотвращение системного введения уменьшит распределение лекарственного средства в тканях, восприимчивых к токсичности, индуцированной тамоксифеном. Клинические испытания местного тамоксифена с биологическими конечными точками все еще продолжаются, тогда как фармакокинетические исследования уже показали, что подходящие препараты препарата успешно проникают в кожу для достижения ткани груди, где требуется профилактический эффект.
В настоящее время тамоксифен является единственным доказанным пероральным средством для адъювантной гормональной терапии гормонально-рецепторно-позитивного рака молочной железы у женщин в пременопаузе [1], и его можно использовать как у женщин до и после менопаузы, у которых повышенный риск рака молочной железы [ 2]. Однако токсичность тамоксифена, такая как тромбоэмболические события и рак эндометрия, по-прежнему представляет собой клинически значимую проблему в целом, особенно в условиях профилактики. В настоящее время изучаются новые стратегии снижения неблагоприятных побочных эффектов тамоксифена, сохраняя при этом свои полезные противораковые свойства. Одной из таких стратегий улучшения профиля риска / пользы этого агента было изучение эффективности более низких доз, которые, как ожидается, будут связаны с более низкой токсичностью. Еще одна новая профилактическая стратегия, которая в настоящее время находится на стадии расследования, является актуальным применением либо тамоксифена, либо его активных метаболитов. Эти две перспективные альтернативы, пероральная низкая доза и местное введение тамоксифена или его активных метаболитов обсуждаются в настоящем обзоре (рисунок 1). Здесь мы представляем результаты нескольких испытаний фазы II (перечисленные в таблице 1), описание текущих исследований III фазы и перспективы на будущее с использованием этого подхода.
Влияние тамоксифена на ткани человека. (a, b) Системное введение низкого тамоксифена (a) и местное введение метаболитов тамоксифена (b). Актуальный тамоксифен позволяет избежать системного воздействия 4-гидрокситамоксифена по сравнению со стандартным оральным тамоксифеном, разница в 16-18 раз, что снижает риск системных побочных эффектов. Концентрации молочной железы, по-видимому, достаточны для достижения ингибирования пролиферации опухолевых клеток в той же степени, что и при стандартной дозе орального тамоксифена (20 мг / сут), но с гораздо более низким уровнем в плазме. Тамоксифен обладает хорошими и плохими эффектами для конкретных тканей человека. Разработка новых подходов должна максимизировать хорошие эффекты и минимизировать неблагоприятные последствия.
Резюме основных опубликованных исследований по применению тамоксифена с низкой дозой
АНА, анастрозол; БК, рак молочной железы; DIN, проточная интраэпителиальная неоплазия; ER, рецептор эстрогена; ER +, положительный эстроген-рецептор; FEN, фенретинид; ЗГТ, заместительная гормональная терапия; IGF, инсулиноподобный фактор роста; PgR, рецептор прогестерона; ТАМ, тамоксифен.
Обзор клинических испытаний адъювантных тамоксифенов показал, что эффективность тамоксифена в дозе 20 мг / день эквивалентна эффективности более высоких доз препарата (то есть от 30 до 40 мг / сут) [3]. Клинические исследования, касающиеся минимальной активной дозы тамоксифена, до сих пор не проводились. С другой стороны, данные исследований на животных показывают, что снижение дозы тамоксифена до эквивалентной человеку дозы 1 мг / сут не снижает ингибирующую активность лекарственного средства при образовании опухоли молочной железы [4]. Дополнительные доклинические данные показали, что противоопухолевый эффект препарата достигает плато над концентрацией, которая насыщает рецепторы эстрогенов [5,6].
Учитывая последовательные данные исследований адъювантной терапии риска, связанного с дозой и длительностью рака эндометрия во время лечения тамоксифеном 9, и с учетом длительного периода жизни в плазме (от 4 до 11 дней после достижения устойчивого состояния [10 ]), снижение дозы и прерывистое введение предлагают правдоподобные способы улучшения профиля безопасности тамоксифена. Вместе все эти наблюдения показывают, что использование более низких доз препарата предлагает разумный подход к минимизации токсичности при сохранении активности.
Чтобы выяснить, связано ли снижение обычной дозы 20 мг / день с уменьшенной биологической активностью, Депенси и его коллеги [11] оценивали влияние различных доз тамоксифена на различные биомаркеры, которые, как известно, отражают фармакодинамическую активность тамоксифена на разных целевых тканей. Эти биомаркеры включают липидный профиль крови [12], количество клеток крови [13,14], остеокальцин [15], фибриноген и антитромбин III [13,14] и циркулирующий инсулиноподобный фактор роста (IGF) -I [16, 17]. Важно отметить, что некоторые из этих биомаркеров были замечены как предполагаемые суррогатные биомаркеры риска рака молочной железы. Например, экспериментальные данные показывают, что при активации ось гормона роста / IGF-I не только способствует пролиферации клеток рака молочной железы [17,18], но также стимулирует пролиферацию нормальных эпителиальных клеток груди [19]. Более того, положительная связь между циркулирующей концентрацией IGF-I и риском развития рака молочной железы была обнаружена во вложенном контрольном исследовании в рамках потенциальной когорты исследования здоровья медсестер [20], что было недавно подтверждено анализом объединенных индивидуальных данных 17 проспективные исследования [21].
Decensi и его коллеги провели два эксперимента для оценки влияния низкодозного тамоксифена у 127 здоровых женщин с гистерэктомией в возрасте от 35 до 70 лет, случайным образом назначенных на плацебо (n = 31) или тамоксифен 20 мг / день (n = 30) (первый эксперимент) , и тамоксифен 10 мг / сут (n = 34) или тамоксифен 10 мг альтернативных дней (n = 32) (второй эксперимент) [11]. Исходные и 2-месячные измерения сравнивались для общего холестерина (первичной конечной точки) и других суррогатных маркеров сердечно-сосудистых заболеваний, а в подгруппе из 103 женщин — IGF-I.
Снижение обычной дозы тамоксифена (20 мг / сут) на 75% не влияло на активность препарата на большом количестве биомаркеров, большинство из которых являются суррогатными маркерами сердечно-сосудистых заболеваний. В частности, после корректировки исходных значений было отмечено снижение количества общего холестерина и уровня IGF-I в всех трех группах лечения тамоксифеном.
Дальнейший анализ был сфокусирован на влиянии низкодозного тамоксифена на систему IGF [22]. Между концентрацией тамоксифена в сыворотке и изменениями биомаркера не наблюдалось существенной зависимости концентрация-реакция, за исключением соотношения IGF-I / IGF-связывающего белка (IGFBP) -3, которое уменьшилось на 1,53% (± 0,68%, P = 0,02) для каждого увеличение 10 нг / мл в концентрации тамоксифена в сыворотке [22].
Дальнейшее исследование фармакодинамических свойств тамоксифена в более низких дозах в условиях профилактики включало изучение влияния на уровни сверхчувствительного С-реактивного белка (CRP), показателя воспаления сосудов низкого уровня и важного маркера риска сердечно-сосудистых заболеваний [23]. Тамоксифен в низких дозах способен снизить сверхчувствительный CRP, и это может быть связано с положительным эффектом на сердечно-сосудистые заболевания [24].
В исследовании 2003 года де Лима и его коллеги [25] сравнили влияние низких доз тамоксифена на 50 дней на биомаркеры груди, измеренные в нормальной ткани груди у 56 женщин в пременопаузе с диагнозом фиброаденома груди. Экспериментальную биопсию проводили на 50-й день терапии, и во время операции были собраны образцы здоровой ткани молочной железы. Пациенты были рандомизированы двойным слепым способом для следующих групп: группа А, плацебо (n = 11); группа B, тамоксифен 5 мг (n = 16); группа С, тамоксифен — 10 мг (n = 14); и группа D, тамоксифен 20 мг (n = 15). В этом исследовании различия в наблюдаемых изменениях экспрессии рецептора эстрогена (ER) альфа, рецептора прогестерона (PgR), индекса метки метки Ki-67 (LI), апоптотических тел и митотических индексов среди четырех различных групп после лечения были замечены в нормальная ткань груди. Не было отмечено различий среди групп B, C и D в значениях после лечения для KI-67 LI. Эти наблюдения привели авторов к выводу, что более низкая доза тамоксифена, которая, как ожидается, будет связана с меньшим количеством побочных эффектов, не окажет отрицательного влияния на химиопрофилактическую активность препарата в молочной железе [25].
Сто двадцать женщин с ER-положительным раком молочной железы были рандомизированы на тамоксифен на 1, 5 или 20 мг / день в течение 4 недель до операции. Кроме того, Ki-67 оценивали в двух нерандомизированных контрольных группах, которые не получали тамоксифен (34 женщины с ER-отрицательным раком молочной железы и 29 дополнительных женщин с ER-положительным раком молочной железы). Экспрессия Ki-67 снижалась во всех трех группах дозового уровня тамоксифена без разницы в величине снижения среди групп (P = 0,81). Соотношение доза-концентрация наблюдалось для уровней тамоксифена и его метаболитов в сыворотке и раковой ткани. Преимущественное накопление тамоксифена в грудной клетке было предложено наблюдением, что концентрации в этой ткани в 2-15 раз превышали уровни лекарственного средства и метаболитов, наблюдаемые в соответствующих образцах сыворотки. Следует отметить, что доза тамоксифена 1 мг / сут приводила к уровням 4-гидрокситамоксифена (4-OHT) в ткани, которые были примерно в 10-20 раз больше, чем 50% -ный диапазон ингибирующих концентраций, наблюдаемый в ряде случаев рака молочной железы MCF-7 клеточных клонов через 48-72 часа, а именно от 0,5 до 5 нМ или от 0,2 до 2 нг / мл [27].
Тамоксифен

На сегодняшний день тамоксифен продолжает оставаться основным препаратом при антигормональной эндокринотерапии рака молочной железы. Это золотой стандарт в лечении гормонозависимых опухолей молочной железы.
Механизм действия тамоксифена:
Его действие основано на способности блокировать рецепторы эстрогенов. Тамоксифен, попадая на поверхность опухолевой клетки, блокирует рецепторы и не дает опухолевой клетке размножаться.
Показания к назначению тамоксифена:
Эстрогенозависимый рак молочных желез у женщин и грудных желез у мужчин
Препарат может быть применен для лечения рака яичников, рака эндометрия, рака почки, меланомы при наличии в опухоли эстрогенных рецепторов, а также для лечения рака предстательной железы при нечувствительности к другим лекарственным препаратам.
Как определяют чувствительность опухоли к тамоксифену?
Определяют с помощью иммуногистохимического исследования на рецепторы к эстрогену и прогестерону.
Противопоказания:
Повышенная чувствительность к тамоксифену
Беременность и кормление грудью
Как принимать тамоксифен?
Тамоксифен принимают не разжевывая вне зависимости от приема пищи, запивая небольшим количеством воды.
Преимущества тамоксифена заключаются в том, что это доступный препарат с доказанной высокой эффективностью в отношении рака молочной железы.
При приеме тамоксифена необходимо находиться под наблюдением лечащего врача и регулярно проходить осмотр у гинеколога.
Поиск путей профилактики рака молочной железы (РМЖ) продолжается много лет.
Тамоксифен (трифенилэтилен) — антиэстроген, несмотря на химическую принадлежность к эстрогенам, стал по-настоящему первым селективным модулятором эстрогеновых рецепторов (ЭР). Накоплен опыт более чем за четверть века применения тамоксифена в адъювантной терапии рака молочной железы (РМЖ). В последнем межклиническом исследовании, оценивавшем эффективность тамоксифена у больных раком молочной железы (РМЖ), было показано, что назначение тамоксифена эффективно у всех женщин с ЭР-положительными опухолями независимо от наступления менопаузы и состояния лимфоузлов.
После подтверждения эффективности профилактики рака второй молочной железы у получающих тамоксифен женщин в отличие от его не получающих в 1992 г. было начато крупное исследование по профилактике рака молочной железы (РМЖ) — National Surgical Adjuvant Breast Project (NSABPJ/NCI). Планировали включить 16 000 женщин с высоким риском рака молочной железы (РМЖ) для участия в проспективном рандомизированном исследовании, сравнивающем плацебо и тамоксифен в дозе 20 мг/сут в течение 5 лет.
Из-за высокой степени риска заболевания было решено набрать только 13 000 женщин. Высокий риск определялся моделью Gail. Эта многомерная логистическая регрессионная модель комбинирует факторы риска для оценки вероятности рецидивирования рака молочной железы (РМЖ) с течением времени. Переменные, включенные в модель: возраст, количество родственниц первой степени родства с раком молочной железы (РМЖ), отсутствие родов или возраст при первых родах, количество биопсий молочной железы, гистологический диагноз атипии или гиперплазии эпителия и возраст менархе.
Модель прогнозирует риск рака молочной железы (РМЖ) в течение 5 лет или ожидаемую продолжительность жизни. Возраст подходящих для этого исследования женщин был 60 лет и старше, или между 35 и 59 годами с 5-летним риском рака молочной железы (РМЖ), равным по крайней мере 1,66 %, или имевших в анамнезе LCIS.
Из 368 случаев инвазивного и неинвазивного рака молочной железы (РМЖ) 244 отнесены в группу плацебо и 124 — в группу лечения тамоксифеном. При инвазивном раке наблюдалось снижение общего риска на 49 % с кумулятивным падением через 69 мес. до 43,4 и 22 случая на 1000 женщин в каждой из двух групп соответственно. При неинвазивном РМЖ снижение составило 50 %.
Снижение частоты неинвазивного рака молочной железы (РМЖ) относилось как к протоковому раку in situ (DCIS), так и LCIS. Тамоксифен уменьшил рецидивирование ЭР-положительных опухолей на 69 %, но изменений в рецидивировании ЭР-отрицательных опухолей не отмечалось. Однако разницы в выживаемости между двумя группами не было; летальный исход отмечен в 9 случаях, связанных с раком молочной железы (РМЖ): 6 — в группе плацебо и 3 — тамоксифена. В группе пациенток, получавших тамоксифен, риск злокачественных новообразований эндометрия был в 2,5 раза выше по сравнению с группой пациенток, получавших плацебо; однако больным не проводился скрининг злокачественных новообразований эндометрия до исследования.
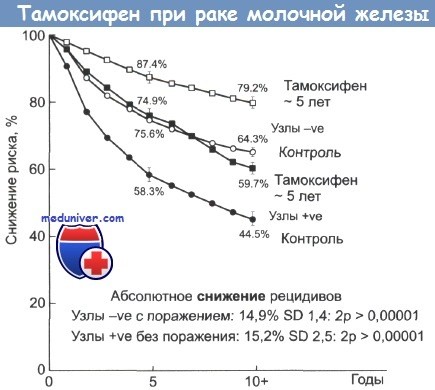
Абсолютное снижение риска возникновения рецидивов рака молочной железы при приеме тамоксифена.
Светлые значки — пациентки без признаков поражения лимфатических узлов; затемненные значки — пациентки с признаками поражения лимфоузлов.
Как предполагалось, увеличение риска касалось главным образом женщин старше 50 лет. В группе пациенток, получавших тамоксифен, было 36 случаев инвазивных злокачественных новообразований, в группе плацебо — 15 случаев. Когда оценивались все случаи злокачественных новообразований, их общее число было равным (97) как в группе плацебо, так и в группе тамоксифена.
По-видимому, отсутствуют различия в частоте ишемической болезни сердца или летального инфаркта миокарда в группе пациенток, получавших тамоксифен, и в контрольной группе. Сосудистые осложнения, включая инсульт, венозный тромбоз и тромбоэмболию, чаще наблюдались у больных, получавших тамоксифен, по сравнению с получавшими плацебо (91 vs 52). Отмечалось снижение риска переломов бедра, лучевой кости и позвоночника при лечении тамоксифеном по сравнению с группой плацебо, но статистически незначимое.
Хотя общие результаты этого исследования обнадеживают, остается несколько вопросов. Был ли положительный эффект, связанный с появлением и ростом опухоли или препятствием росту скрытых опухолей? Какой отрезок времени необходим для лечения тамоксифеном? Планировалось исследование продолжительностью 5 лет; однако анализ был проведен раньше. Что произойдет через 5 лет? Не будет ли обратного эффекта с существенным количеством злокачественных новообразований между 5 и 10 годами? В дополнительных исследованиях после 5 лет терапии оказалось, что число рецидивов при лечении тамоксифеном в период 5 — 10 лет было больше по сравнению с группой плацебо.
Вскоре после публикации исследования NSABP были представлены 2 исследования по профилактике рака молочной железы (РМЖ) с помощью тамоксифена из Европы (Великобритания и Италия). Их выводы отличались от заключений исследования NSABP, главным образом отсутствием разницы в профилактике РМЖ при лечении тамоксифеном и в контрольной группе. В исследовании из Великобритании отмечены 34 случая РМЖ в группе пациенток, получавших тамоксифен, и 36 — в группе плацебо; в итальянском исследовании выявлено 19 случаев РМЖ при лечении тамоксифеном и 22 — в группе плацебо.
Два европейских исследования отличались от исследования, проведенного в США, меньшим числом больных. Несмотря на сходную семейную отягощенность РМЖ в исследованиях, проведенных в Великобритании и США, в итальянском исследовании таковая не обнаружена. Оказалось, что в последнем риск РМЖ был гораздо ниже в обеих группах по сравнению с исследованиями в США и Великобритании. Что касается группы плацебо, снижение заболеваемости РМЖ в британском исследовании было несколько меньше, чем в американском; однако снижение этого показателя при лечении тамоксифеном было более значительным в британском исследовании по сравнению с американским.
Идентификация соответствующей группы больных и оптимальной продолжительности терапии пока еще не может быть точно определена.
Позднее были проведены исследования с целью оценить эффективность других селективных модуляторов ЭР. Изучение тамоксифена и ралоксифена в качестве средств для профилактики инвазивного РМЖ проводилось у женщин в период постменопаузы при максимальном риске этого заболевания.
Это было рандомизированное двойное слепое исследование у 22 000 женщин в постменопаузе. Каждой участнице регулярно проводились маммография, физикальное и гинекологическое исследования, по крайней мере, в течение 7 лет. Это одно из самых больших исследований III фазы, включавшей профилактику РМЖ, разработанное для определения эффективности ралоксифена и тамоксифена в снижении РМЖ в период постменопаузы.

Несколько лет назад (в период с 1992 по 2001 годы) в США было проведено исследование, в котором участвовали более 7000 женщин в возрасте от 35 до 70 лет. Случайным образом испытуемые были поделены на 2 группы, в первом случае участницы получали препарат тамоксифен на протяжении 5 лет, во второй группе женщины принимали плацебо в течение такого же срока. В общей сложности каждая из испытуемых находилась под наблюдением врача около 15 лет.
В течение всего исследования был зарегистрирован 601 случай заболевания раком молочной железы. При этом количество женщин, принимавших тамоксифен и заболевших раком, составило 251 человек (7% из 3579 пациентов), а количество участниц из второй группы, принимавших плацебо и заболевших, оказалось 350 человек (9,8% из 3575 испытуемых). Риск развития рака молочной железы был одинаков в обеих группах как в первые, так и в последующие 10 лет. Тамоксифен в большей степени снизил заболеваемость инвазивной и неинвазивной формой рака молочной железы с HER положительным результатом. И никакого эффекта не оказал на заболевания раком молочной железы с HER отрицательным результатом.
Результаты исследования также показали, что тамоксифен обеспечивает длительный период защиты после прекращения лечения, поэтому некоторые специалисты предлагают использовать этот препарат в качестве профилактического средства рака молочной железы. Но в ученых кругах ведутся оживленные споры по этому вопросу, не все онкологи согласны с таким предложением. Например, доктор Изабель Альварес Лопес и доктор Джоан Ашворт считают нецелесообразным использование тамоксифена для профилактики рака молочной железы, во-первых, потому что в мире увеличивается тенденция к заболеваниям с Her отрицательной формой, а во-вторых, тамоксифен имеет множество побочных действий, влияющих на здоровье и, соответственно, на образ жизни женщины.
