Лучевая терапия при раке эндометрия — это метод лечения онкологической опухоли естественными и искусственными радиоактивными элементами. В результате действия радиотерапии происходит изменение структуры ДНК и нарушение митоза, прекращение роста и разрушение мутировавших клеток.
Когда применяется лучевая терапия при раке эндометрия?
Онкологическая опухоль развивается из эпителиальных клеток внутреннего слоя матки, которые чувствительны к действию радиации. Принципы применения лучевой терапии при раке эндометрия предусматривают назначение гамма-терапии по индивидуальным показателям, использование щадящих методов, тщательный расчет разовых и суммарных доз радиации, запрет на радиооблучение беременных женщин. Показанием к радиологической терапии является:
- поражение стенок матки на 30 % и более;
- большие размеры новообразования, при которых хирургическое воздействие невозможно;
- высоко дифференцированные быстрорастущие типы опухолей. Учитывая результативность ионизирующей терапии, сеансы назначают:
- как самостоятельный вид при наличии ограничений к оперативному вмешательству;
- до операции для уменьшения объема онкообразования;
- после хирургического вмешательства для предупреждения рецидива;
- как паллиативную терапию для улучшения состояния пациентки на последних стадиях заболевания.
Проведение лучевой терапии при раке эндометрия после химиотерапии позволяет добиться лучшей эффективности лечения.
Противопоказания
Перед составлением персонального протокола, пациентки проходят медицинское обследование для выявления противопоказаний к проведению лучевой терапии при раке эндометрия. Ограничением являются:
- маточные кровотечения, вызванные распадом новообразования;
- множественные метастазы;
- болезни сердечно-сосудистой, эндокринной системы и органов дыхания в фазе обострения;
- понижение уровня гемоглобина, тромбоцитов и лейкоцитов в крови;
- выраженная кахексия;
- снижение иммунитета, интоксикация, воспалительные процессы с высокой температурой и лихорадкой.
Как проходит и сколько длится лучевая терапия при раке эндометрия?
При подготовке к радиационной терапии рассчитывают дозы и интенсивность ионизирующего излучения, выбирают метод, разрабатывают макет положения пациентки. В зависимости от локализации ракового очага проводятся дистанционная, внутренняя (брахитерапия) или сочетанная терапия. Во время наружного радиооблучения онкобольная лежит на процедурном столе рядом с линейным излучателем. Угол подачи лучей меняется несколько раз. Компьютерная программа позволяет создать поле облучения, совпадающее с формой патогенного очага, и выходящее за границы периметра на 0,5-1 см. Для защиты здоровых участков тела используют ширмы из свинца. Сеансы длятся 10-15 минут, их проводят 5 раз в неделю, продолжительность курса составляет 5-8 недель. При брахитерапии низкоэнергетические радиоактивные изотопы вводят в полость матки в виде микрокапсул, проволоки или игл и располагают поблизости от очага. При таком способе небольшая доза радиации действует в течение нескольких часов.
Стоимость лучевой терапии при раке эндометрия
В клиниках Москвы на стоимость лучевой терапии (облучения) при раке эндометрия влияют цены на лекарственные препараты и топометрию, внутренние расценки на услуги онколога-радиолога и медицинской бригады, вид используемого оборудования, персональный план процедур. Ознакомиться с информацией и оформить заявку на радиотерапию можно у наших менеджеров.
Реабилитация
После сеансов радиолучевой терапии у женщин могут наступить побочные реакции: влагалищные выделения и кровотечения, жжение при мочеиспускании, расстройство пищеварения, тошнота, отеки ног и гениталий. Эти реакции обратимы и исчезают через 2-4 недели после завершения процедур. К поздним осложнениям относят ранний климакс, бесплодие. В таких случаях длительность восстановления при раке эндометрия после курса лучевой терапии зависит от полученной порции излучения, индивидуальных особенностей, стадии онкопроцесса. Для нивелирования нежелательных последствий требуются дополнительные терапевтические процедуры.
Целесообразность назначения адъювантной лучевой терапии (ЛТ) после операции определяется данными, получаемыми с помощью хирургического стадирования. Как подчеркивалось выше, если опухоль ограничена маткой, эффективность послеоперационной ЛТ спорна.
Согласно данным большинства исследований, послеоперационная лучевая терапия (ЛТ) снижает частоту возникновения местных рецидивов, но не улучшает общую выживаемость. Среди больных, которым не назначали ЛТ, возникшие впоследствии рецидивы удалось излечить в 2/3 случаев.
При общей выживаемости при раке эндометрия (РЭ) I стадии 98 %, согласно данным некоторых исследований, ЛТ как одному из этапов первичного лечения рака эндометрия (РЭ) отводится весьма ограниченная роль. Результаты годовых отчетов показывают, что если РЭ переходит на шейку матки, но заболевание продолжает быть ограниченным маткой, ЛТ, по-видимому, не дает значимого эффекта.
В случае распространения опухоли за пределы матки (метастазы в придатках и лимфоузлах, брюшине, наличие злокачественных клеток при цитологическом исследовании перитонсальных смывов) частота рецидивирования после первичного лечения высокая.
Так, из 48 больных с этими данными, которым проведено лечение в нашей клинике, у 21 (43 %) были выявлены рецидивы заболевания, у 18 — отдаленные метастазы. Необходимость поиска новых адъювантных методов воздействия на метастазы очевидна.
При наличии метастазов в тазовых или парааортальных лимфоузлах послеоперационная лучевая терапия (ЛТ) на эти области достаточно эффективна, о чем свидетельствует отсутствие рецидивов у 40 % пациенток, у которых были поражены лимфоузлы. Нуждаются ли все больные с метастазами в лимфоузлах в проведении ЛТ?
Накопленные данные говорят о том, что лимфаденэктомия вызывает терапевтический эффект, особенно при ограниченном процессе в лимфоузлах. По данным недавнего исследования GOG, XT у больных с выраженными стадиями рака эндометрия (РЭ) оказалась более эффективной, чем ЛТ.
Недавно медики из Осло, Норвегия, подвели итоги полномасштабного исследования, длившегося не один год (с 1968 по 1974). Как оказалось после обработки статистических данных, при лечении начальной стадии рака эндометрия лучевая терапия не всегда протекает без побочных явлений. Более того, облучение даже является опасным для жизни пациентки, когда речь идет об общем облучении.
По словам доктора медицины Кристины Линдеманн, женщины, которые перенесли операцию по поводу удаления рака эндометрия с последующей наружной лучевой терапией, имели меньший шанс на выживание, чем те, кто получил локализованное (вагинальное) облучение (доза P = 0,186). При этом при наружном общем облучении в группе женщин до шестидесятилетнего возраста показатель смертности был на 36 % больше, чем у представительниц контрольной группы.

Такие данные были обнародованы группой исследователей в одном популярном медицинском журнале и вызвали нешуточные дебаты в ученом мире. Главным аргументом, который привела доктор Линдеманн в своей научной работе, был тот факт, что у молодых женщин, подвергавшихся активному общему облучению, был намного больше риск развития вторичных опухолей в облученных областях тела.
Исследователи в опубликованной работе в подтверждение своей правоты приводят показатели статистики, собранной во время исследования. Так, на самом деле женщины в возрасте до 60 лет, подвергнутые обычному (не слишком щадящему) типу лучевой терапии, в два раза чаще, чем представительницы контрольной группы, страдали от вторичного рака. При этом разница в выживаемости становилась с каждым годом все более и более существенной, достигнув своего пика на отметке двадцать лет после ЛТ (лучевой терапии).
Учитывая полученные данные, медики рекомендуют на начальных стадиях заболевания лечить пациенток, используя точную лучевую терапию (вагинальное облучение). Получаемый от него эффект является по своей сути таким же, как и при стандартном облучении, но вот побочных эффектов у данного метода на порядок меньше.
Дополнительно стоит отметить, что в исследовании, продлившемся два десятка лет, принимали участие 568 пациенток с раком эндометрия первой стадии. После постановки диагноза им было предложено оперативное вмешательство с последующим проведением лучевой терапии по истечении 2—6 недель после операции.
Причем все пациентки были разделены на две группы. Первая группа, в которой было 288 человек, подвергалась облучению, а вторая группа — 280 человек — была контрольной. После лечения за пациентками в течение пяти лет наблюдали медики, при этом разница в пятилетнем периоде после лечения была несущественной, а вот в плане долгосрочной выживаемости у пациенток, подвергшихся стандартному облучению, показатели были ниже.
Полученные норвежскими медиками данные также были подтверждены и в ходе других исследований. Так, в ходе исследования NSGO/EORTC были получены такие результаты — химиотерапия и облучение в комплексе в плане канцер-специфической выживаемости были более приемлемыми, но не отражались на общей выживаемости. А все из-за токсичности облучения. Так что медикам стоит принять данный факт к сведению.
МЕГАФОН: 8-928-36-46-111
Аннотация научной статьи по клинической медицине, автор научной работы — Шарабура Т.М., Жаров А.В., Важенин А.В., Васильева Т.А.
Большинство больных раком эндометрия (РЭ) имеют I стадию заболевания, основным методом лечения которой является тотальная гистерэктомия с двухсторонней сальпингоовариоэктомией с или без тазовой лимфаденэктомии. Отношение к адъювантной лучевой терапии при раннем раке эндометрия неоднозначно и определяется риском рецидива. В соответствие с глубиной инвазии миометрия, гистологическим типом и степенью дифференцировки РЭ I ст классифицируется на низкий, промежуточный и высокий риск поражения лимфатических узлов и отдаленного метастазирования. В рандомизированных исследованиях доказано достоверное улучшение локального контроля после облучения малого таза и/ или внутриполостного облучения влагалища без улучшения общей выживаемости среди пациенток высокого и промежуточного риска. При этом больше всего разногласий связано с назначением адъювантной лучевой терапии при РЭ промежуточного риска в связи с неоднородностью данной группы, что потребовало выделение подгруппы высокого промежуточного риска с учетом дополнительных факторов: лимфоваскулярная инвазия и возраст. В подгруппе высокого промежуточного риска локо-регионарный эффект адъювантной лучевой терапии оказался более значимым. С учетом неоднородности пациенток ранним РЭ, сложностью оценки прогноза в случае невыполнения регионарной лимфаденэктомии и риска поздних лучевых осложнений предпринимаются попытки оптимизировать показания, объем и способ адъювантной лучевой терапии в соответствие с факторами риска.
Похожие темы научных работ по клинической медицине , автор научной работы — Шарабура Т.М., Жаров А.В., Важенин А.В., Васильева Т.А.
Мультидисциплинарное лечение рака эндометрия
Адъювантная лучевая терапия рака эндометрия низкого и умеренного риска: аргументы ЗА
ШАРАБУРА Т. М., ЖАРОВ А. В., ВАЖЕНИН А. В., ВАСИЛЬЕВА Т. А.
Большинство больных раком эндометрия (РЭ) имеют I стадию заболевания, основным методом лечения которой является тотальная гистерэктомия с двухсторонней сальпингоовариоэктомией с или без тазовой лимфаденэктомии. Отношение к адъювантной лучевой терапии при раннем раке эндометрия неоднозначно и определяется риском рецидива. В соответствие с глубиной инвазии миометрия, гистологическим типом и степенью дифференцировки РЭ I ст классифицируется на низкий, промежуточный и высокий риск поражения лимфатических узлов и отдаленного метастазирования. В рандомизированных исследованиях доказано достоверное улучшение локального контроля после облучения малого таза и/ или внутриполостного облучения влагалища без улучшения общей выживаемости среди пациенток высокого и промежуточного риска. При этом больше всего разногласий связано с назначением адъювантной лучевой терапии при РЭ промежуточного риска в связи с неоднородностью данной группы, что потребовало выделение подгруппы высокого промежуточного риска с учетом дополнительных факторов: лимфоваскулярная инвазия и возраст. В подгруппе высокого промежуточного риска локо-регионарный эффект адъювантной лучевой терапии оказался более значимым. С учетом неоднородности пациенток ранним РЭ, сложностью оценки прогноза в случае невыполнения регионарной лимфаденэктомии и риска поздних лучевых осложнений предпринимаются попытки оптимизировать показания, объем и способ адъювантной лучевой терапии в соответствие с факторами риска.
Ключевые слова: рак эндометрия, высокий промежуточный риск, дистанционное облучение малого таза, внутриполостное облучение влагалища.
Tatiana Sharabura, Aleksandr Zharov, Andrej Vazhenin, Tamara Vasiljeva
Проблема адъювантной лучевой терапии рака эндометрия не теряет своей актуальности несмотря на обилие завершенных рандомизированных исследований. Это объясняется слабостью доказательной базы, что, в свою очередь, обусловлено гетерогенностью больных, низкой частотой рецидивирования раннего рака эндометрия (РЭ), преобладанием среди заболевших старшей возрастной группы и причин смерти, не связанных с РЭ [3].
В России в 2013г было диагностировано 20663 новых случаев РЭ, 60% заболевших имели I стадию заболевания [1]. Основным методом лечения раннего РЭ традиционно является тотальная гистерэктомия с двухсторонней саль-пингоовариоэктомией. Тазовая лимфаденэктомия (ЛАЭ) позволяет оценить состояние регионарных лимфатических узлов (ЛУ) и завершить, так называемое, хирургическое стадирование. Вместе с тем, отношение к лимфаденэкто-мии при I стадии РЭ неоднозначно, так как нет убедительных данных влияния ЛАЭ на выживаемость при высоком риске осложнений [2]. С учетом последнего обстоятельства значительной части больных РЭ I ст ЛАЭ не выполняется. Между тем, риск метастатического поражения ЛУ малого таза и, соответственно, риск рецидива определяет
показания для адъювантной лучевой терапии, включающей дистанционное облучение малого таза (ДОМТ), вну-триполостное облучение влагалища (ВОВ) или сочетание этих методов. В отсутствие тазовой ЛАЭ оценить риск поражения регионарных ЛУ позволяют такие факторы, как глубина инвазии миометрия и степень дифференцировки опухоли (Grade), гистологический тип и наличие лимфова-скулярной инвазии (ЛВИ) [3]. В соответствие с факторами риска и на основании проспективных и ретроспективных данных РЭ I ст классифицируется на низкий, промежуточный и высокий риск поражения лимфатических узлов (ЛУ) и отдаленного метастазирования.
В группу низкого риска входят пациентки с IA стадией по классификации International Federation of Gynecology and Obstetrics (FIGO) 2009 эндометриоидно-го рака Grade 1 или 2. К группе высокого риска отнесена пациентки с Ш стадией эндометриоидного рака Grade 3 и все случаи неэндометриоидного РЭ.
Больше всего разногласий связано с определением критериев промежуточного риска. Пациентки РЭ IA ст Grade 3 и Ш ст Grade 1 или 2 были отнесены к группе промежуточного риска. Вместе с тем, данная группа оказалась
Адъювантная лучевая терапия рака эндометрия низкого и умеренного риска: аргументы ЗА
Таблица 1. Критерии высокого промежуточного риска
Возраст Факторы риска: Grade 2 или 3, ЛВИ, инвазия более 50% эндометрия
> 70 лет + 1 фактор риска
> 50 лет + 2 фактора риска
> 18 лет + 3 фактора риска
весьма неоднородной в зависимости от дополнительных факторов риска, что потребовало выделение подгруппы высокого промежуточного риска (ВПР). Критерии ВПР определены Keys Н et al в рандомизированном исследовании Gynecologic Oncology Group (GOG) -99 [4] (табл. 1).
Не вызывает сомнение необходимость облучения малого таза при высоком риске поражения тазовых лимфатических узлов. Ценные сведения о риске метастази-рования в регионарные ЛУ в зависимости от различных факторов были представлены Creasman W et al в исследовании GOG 33 по результатам хирургического стадиро-вания у 621 пациентки РЭ [5]. Риск поражения тазовых лимфатических узлов значительно возрастает при сочетании таких признаков, как глубокая инвазия миометрия и низкая степень дифференцировки, а так же при наличии ЛВИ [5]. Если у пациенток РЭ IA ст без инвазии или поверхностной инвазией Grade 1 или 2 риск регионарных метастазов низкий и стандартная операция без ДОМТ обеспечивает хороший прогноз, то у пациенток промежуточного и высокого риска проблема адъювантой лучевой терапии (АЛТ) весьма актуальна.
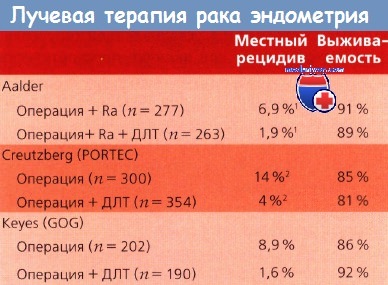
Роль ДОМТ была изучена в нескольких рандомизированных исследованиях. Результаты одного из первых, Норвежского исследования были опубликованы в 1980 г. Авторы включили в свое исследование 540 больных РЭ I ст. Всем выполнялась тотальная гистерэктомия с двухсторонней сальпингоовариоэктомией и вагинальной брахи-терпией в режиме LDR до дозы 60Гр на слизистую влагалища с рандомизацией на получивших дополнительно на ЛУ малого таза 40Гр и не получивших такого облучения. Не получено достоверных различий в 5-летней общей выживаемости (89% против 91%) в исследуемых группах. При этом у пациенток с инвазией миометрия менее 50% и Grade1 и 2 частота локо-регионарных рецидивов (вагинальных и тазовых) была низкой и составила всего 2,3% и 4,0% в группах с ДОМТ и без [6]. Эти данные послужили поводом для отказа от адъювантной ЛТ у пациенток низкого риска, и данная подгруппа не включалась в последующие рандомизированные исследования.
Kong A et al в 2012 г опубликовали мета-анализ 8 рандомизированных исследований (Aalders 1980, ASTEC/EN.5, GOG 99, PORTEC-1, PORTEC-2, Soderini 2003, Sorbe 2009 и Sorbe 2011), из которых 7 оценивали результаты ДОМТ в сравнении с наблюдением или ВОВ (3628 пациенток) и 1 исследование сопоставляло ВОВ и наблюдение (645 пациенток). Авторы подтвердили ставшие уже очевидными результаты. ДОМТ достоверно снижает риск ЛРР в сравнении с наблюдением или одним ВОВ (Отношение рисков [ОР] = 0.36; 95% Доверительный интервал [ДИ] 0.25-0.52; р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
ДОМТ на основании этих данных не могло быть рекомендовано к рутинному применению у пациенток РЭ I ст независимо от степени риска. Но результаты мета-анализа были подвергнуты критике [8]. Заключение об отсутствии влияния ДОМТ на показатели выживаемости справедливо для всей группы больных РЭ I ст. Между тем, известно, что при наличии неблагоприятных факторов риска эффект от ДОМТ может быть более значим. Данная подгруппа была представлена меньшим количеством больных, кроме того, критерии оценки риска не всегда совпадали. Значительная доля больных имела поверхностную инвазию миометрия, при которой риск рецидива не превышает 5-10% и для этих пациенток даже незначительная токсичность, связанная с ЛТ может перевесить ожидаемый эффект. Если в целом среди пациенток РЭ промежуточного риска ДОМТ снизило частоту 2-летних рецидивов с 12% до 3% (р=0.007), то в подгруппе высокого промежуточного риска выигрыш был наибольшим. 2-летняя частота рецидивов снизилась с 26% до 6%, а 4-летняя выживаемость выросла с 86% до 92%, но различия не достигли достоверного уровня, р=0.557 [4]. Keys H et al считают, что адъювантная ЛТ у больных ранним раком эндометрия промежуточного риска снижает риск рецидива, но должна быть ограничена для подгруппы высокого промежуточного риска [4].
Другая проблема связана с точностью морфологического заключения. Градация РЭ субъективна и требует участия опытных морфологов, что отмечают и сами авторы мета-анализа (Kong A et al, 2012 [7]). Лишь в исследовании GOG-99 препараты были консультированы в центральной лаборатории, и, в этой связи, именно это исследование ближе всего к точной идентификации пациенток высокого промежуточного риска. В Норвежском исследовании ретроспективный анализ в центральной лаборатории привел к увеличению доли больных с Grade1 с заявленных 11% до 48%, а доля больных с минимальной инвазией выросла до 58% [9]. Принимая во внимание неопределенности морфологического диагноза авторы мета-анализа и не пытаются делать заключение в зависимости от принадлежности к группам риска, но, суммируя результаты, утверждают, что ДОМТ не улучшает выживаемость больных РЭ I ст.
Включенные в мета-анализ исследования оказались неоднородны и по признаку выполнения регионарной лимфаденэктомии. В исследовании GOG-99 ЛАЭ была
Мультидисциплинарное лечение рака эндометрия
выполнена всем пациенткам, в исследовании ASTEC/ EN.5 ЛАЭ выполнена 50% пациенток, а в исследованиях PORTEC1 и Норвежском не выполнялась вовсе. Тем не менее, результаты применения ДОМТ и связанная с лечением токсичность оказались сопоставимы. В исследовании ASTEC/EN.5 не было различий в результатах ДОМТ в зависимости от выполнения или невыполнения ЛАЭ для общей выживаемости и специфической раковой выживаемости, р = 0.79 и p = 0.22, соответственно [14]. Однако Chan J et al на основании анализа базы данных Surveillance, Epidemiology and End Results (SEER) с 1988 по 2001 среди 39396 женщин с РЭ, из которых в 31% была выполнена ЛАЭ, отметили, что ЛАЭ увеличивает 5-летнюю выживаемость (90% против 85%, р = 0.0001) для РЭ I ст Grade 3 [2].
Анализ базы данных SEER позволил по новому оценить и роль ДОМТ у пациенток ранним РЭ. Из 21249 женщин РЭ I ст 19.2% получили ДОМТ, что позволило достоверно улучшить выживаемость пациенток с инфильтрацией более 50% миометрия [10]. Аналогичные результаты получили Chino J et al у 56360 оперированных пациенток РЭ I ст. При РЭ промежуточного и высокого риска выживаемость была выше после ЛТ (p 60 лет для ЛРР (ОР 3.9, p = 0.002) и для риска смерти от РЭ (2.7, p=0.01) и глубины инвазии > 50% миометрия для ЛРР (ОР 1.9, p = 0.03) и для риска смерти от РЭ (ОР 1.9, p = 0.02). Для пациенток с данными факторами риска, составляющих подгруппу ВПР, частота 5-летних ЛРР без адъювантной терапии достигает 20%, что определяет необходимость ДОМТ [3].
Лимфоваскулярная инвазия один из наиболее важных предикторов метастатического поражения ЛУ и рецидива при раннем РЭ, что подтвердили Bendifallah S et al на основании анализа результатов лечения 496 пациенток ранним РЭ. Рецидивы встречались в целом в 16,1% [12]. Частота рецидивов с учетом ЛВИ составила: 8.2% (8 из 98), 23.1% (15 из 65), 25.9% (15 из 58), и 45.1% (28 из 62) для подгрупп промежуточного риска без ЛВИ, промежуточного риска с ЛВИ, высокого риска без ЛВИ и высокого риска с ЛВИ, соответственно (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Адъювантная лучевая терапия рака эндометрия низкого и умеренного риска: аргументы ЗА
наблюдения и среди получивших ВОВ [17]. У пациенток РЭ промежуточного риска ВОВ оказалась сопоставимой с ДОМТ в предупреждении вагинальных рецидивов и по показателям ОВ при меньшей токсичности [15, 16] и, в этой связи, может считаться методом выбора адъювант-ной лучевой терапии (табл. 2).
Сочетание ДОМТ и ВОВ у пациенток с I ст РЭ не привело к улучшению выживаемости в сравнении с ВОВ при более высокой токсичности [18, 19]. Onsrud M et al при медиане наблюдения 20.5 лет отметили, что у женщин моложе 60 лет ДОМТ увеличивало риск смерти (ОР = 1.36; 95% ДИ 1.06-1.76), что связано с повышенным риском вторых опухолей (ОР = 2.02; 95% ДИ 1.30-3.15) [19].
Таким образом, определяя место адъювантной ЛТ при РЭ I ст низкого и умеренного риска необходимо отметить: 1. Пациентки РЭ IA ст Grade 1 или 2 и без ЛВИ не нуждаются в адъювантной лучевой терапии.
2. Пациенткам с РЭ I ст промежуточного или высокого промежуточного риска необходима адъювантная ЛТ.
3. Внутриполостное облучение влагалища является методом выбора у пациенток с полным хирургическим стадированием при наличии РЭ 1А ст и дополнительных факторах риска (ЛВИ, возраст более 60 лет) и 1В ст.
4. Внутриполостное облучение влагалища является методом выбора у пациенток оперированных без ЛАЭ при наличии РЭ I ст промежуточного риска и без ЛВИ.
5. ДОМТ является методом выбора у пациенток оперированных без ЛАЭ при наличии РЭ I ст высокого промежуточного риска или при наличии ЛВИ.
6. После ДОМТ внутриполостное облучение влагалища необходимо лишь при высоком риске рецидива (переход на внутренний маточный зев, поражение желез канала шейки матки).
2. Chan J. K., Wu H., Cheung M. K., Shin J. Y., Osann K., Kapp D. S. The outcomes of 27,063 women with unstaged endometrioid uterine cancer, Gynecologic Oncology, 2007, vol. 106, no. 2, pp. 282-288.
3. Creutzberg C. L., Nout R. A., Lybeert M. L. et al. Fifteen-year radiotherapy outcomes of the randomized PORTEC-1 trial for endometrial carcinoma. Int J Radiat Oncol Biol Phys. 2011 Nov 15;81 (4): 631-8.
4. Keys HM, Roberts JA, Brunetto VL, Zaino RJ et al. A phase III trial of surgery with or without adjunctive external pelvic radiation therapy in intermediate risk endometrial adenocarcinoma: a Gynecologic Oncology Group study. Gynecol Oncol. 2004 Mar;92 (3):744-51.
5. Creasman W. T., Morrow C. P., Bundy B. N., et al. Surgical pathologic spread patterns of endometrial cancer.
A gynecologic oncology group study. Cancer. 1987; 60 (8): 2035-2041.
6. Aalders J, Abeler V, Kolstad P, Onsrud M. Postoperative external irradiation and prognostic parameters in stage I endometrial carcinoma: clinical and histopathologic study of 540 patients. Obstet Gynecol 1980 56 (4):419-427.
7. Kong A., Johnson N., Kitchener H. C., Lawrie.
T. A. Adjuvant Radiotherapy for Stage I Endometrial Cancer: An Updated Cochrane Systematic Review and Meta-analysis. JNCI J Natl Cancer Inst, 2012; Volume 104, Issue 21, Pp. 1625-1634.
8. Eifel P. J. The Role of Adjuvant Radiation Therapy for Stage I Endometrial Cancer: Does Meta-Analysis Reveal the Answer? JNCI J Natl Cancer Inst Volume 104 Issue 21: 1615-1616.
9. Lindemann K, Onsrud M, Kristensen G, et al. Survival after radiation therapy for early-stage endometrial carcinoma: the Oslo study revisited after up to 43 years of follow-up J Clin Oncol 2012 30 (suppl): abstr 5008.
10. Lee C. M., Szabo A., Shrieve D. C., Macdonald O. K., Gaffney D. K. Frequency and effect of adjuvant radiation therapy among women with stage I endometrial adenocarcinoma. Journal of the American Medical Association, 2006, vol. 295, no. 4, pp. 389-397
11. Chino JP, Jones E, Berchuck A, et al. The influence of radiation modality and lymph node dissection on survival in early-stage endometrial cancer. Int J Radiat Oncol Biol Phys. 2012 Apr 1;82 (5):1872-9.
12. Bendifallah S, Canlorbe G, Raimond E et al. A clue towards improving the European Society of Medical Oncology risk group classification in apparent early stage endometrial cancer? Impact of lymphovascular space invasion. British Journal of Cancer, 2014. 110, 2640-2646.
13. Mundt, A.J., Roeske, J.C., Lujan, A.E. et al. Initial clinical experience with intensity-modulated whole-pelvis radiation therapy in women with gynecologic malignancies. Gynecol Oncol. 2001; 82: 456-463
14. Blake P., Swart A. M., Orton J, Kitchener H. et al. Adjuvant external beam radiotherapy in the treatment of endometrial cancer (MRC ASTEC and NCIC CTG EN.5 randomised trials): pooled trial results, systematic review, and meta-analysis The Lancet, 2009, Volume 373, Issue 9658, Pages 137-146.
15. Nout RA, Smit VT, Putter H. et al. Vaginal brachytherapy versus pelvic external beam radiotherapy for patients with endometrial cancer of high-intermediate risk (PORTEC-2): an open-label, non-inferiority, randomised trial. Lancet. 2010 Mar 6;375 (9717):816-23.
16. Nout RA, Putter H, Jürgenliemk-Schulz IM, et al Five-year quality of life of endometrial cancer patients treated in the randomised Post Operative Radiation Therapy in Endometrial Cancer (PORTEC-2) trial and comparison with norm data. Eur J Cancer. 2012 Jul;48 (11):1638-48.
17. Sorbe B, Nordström B, Mäenpää J, et al. Intravaginal brachytherapy in FIGO stage I low-risk endometrial cancer: a controlled randomized study. Int J Gynecol Cancer 2009 19 (5):873-878
18. Sorbe B, Horvath G, Andersson H, et al. External pelvic and vaginal irradiation versus vaginal irradiation alone as postoperative therapy in medium-risk endometrial carcinoma-a prospective randomized study. Int J Radiat Oncol Biol Phys 2012 82 (3):1249-1255
19. Onsrud M, Cvancarova M, Hellebust TP et al. Long-term outcomes after pelvic radiation for early-stage endometrial cancer. J Clin Oncol. 2013 Nov 1;31 (31):3951-6.


