Клиническое наблюдение
Доброкачественные образование лоханки и мочеточника чаще представлены полипами и встречаются довольно редко, составляя 1-3% всех опухолей почки и верхних мочевых путей. Чаще всего они обычно выявляются в возрасте 50-70 лет и в основном имеют односторонний характер поражения. Диагностика и выбор лечения при данной патологии считаются одним из сложнейших разделов современной реконструктивной хирургии, в связи с редкостью возникновения, онкологической настороженностью врачей, а также — сходством клинических проявлений с рядом других урологических и онкоурологических заболеваний. В результате часто устанавливается ошибочный диагноз, что может привести к неправильному выбору оперативного лечения. В результате 30-60% всех опухолей лоханки диагностируют только во время операций. Реконструктивные операции при опухолях верхних мочевых путях редки и выполняются, как правило, при локальном поражении мочеточника или лоханки единственной почки.
В диагностике заболевания ведущая роль отводится мультиспиральной компьютерной томографии органов брюшной полости с контрастированием. Кроме того, оптическая уретеропиелоскопия позволяет осмотреть мочеточник и лоханку и при необходимости выполнить биопсию.
Тактика хирургического лечения зависит от расположения и размеров образования. При небольших доброкачественных образованиях мочеточника и/или лоханки производят эндоскопическую трансуретеральную резекцию лоханки или мочеточника при помощи, используя электрохирургию или лазерное воздействие. При больших образованиях, располагающихся на широком основании, методом лечения является резекция мочеточника и/или лоханки с последующей пластикой:
Приводим клиническое наблюдение, необычность которого обусловлена органосохраняющим характером хирургического лечения при крупном новообразовании верхних мочевых путей у молодого человека с сохранной противоположной почкой.
Больной Ш., 18 лет, поступил с жалобами на боль в поясничной области слева. По данным проведенного обследования заподозрено образование прилоханочного отдела левого мочеточника, гидронефроз слева (рис. 1, 2).
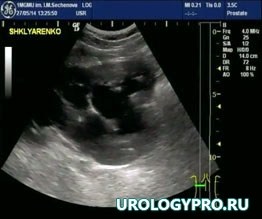
Рис. 1. Эхосонограмма. Левая почка увеличена в размерах, Чашечно-лоханочная система расширена.
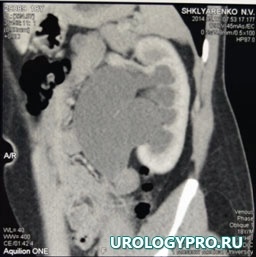
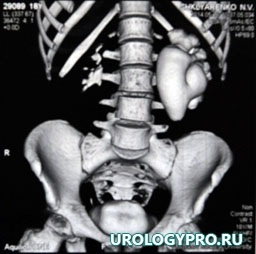
Рис. 2. Мультиспиральная компьютерная томограмма органов брюшной полости.
Чашечно-лоханочная система левой почки расширена: чашечки до 28 мм, лоханка 43х48 мм. В позднюю отсроченную фазу ЧЛС левой почки и верхняя треть левого мочеточника заполнены контрастным препаратом, диаметр мочеточника до 30 мм, мочеточник извит. На этом уровне (на границе верхней и средней трети) создается впечатление о наличии образования, размерами 16х11 мм, с неровными нечеткими контурами, не активно накапливает контрастный препарат. Ниже уровня образования мочеточник не заполняется контрастным препаратом.
17.06.2014г — для уточнения характера патологического процесса и получения ткани для морфологического исследования выполнена уретеропиелоскопия слева (рис 3), щипковая биопсия мочеточника, стентирование верхних мочевых путей слева.
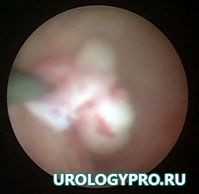
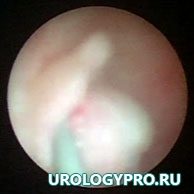
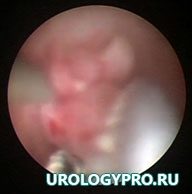
Рис. 3. Уретеропиелоскопия. Определятся полиповидное образование в прилоханочном отделе мочеточника. Слизистая вокруг не изменена.
Гистологическое заключение: фиброэпителиальный полип со склерозом и лимфогистиоцитарной инфильтрацией в строме.
При радионуклидном исследовании функция левой почки нарушена преимущественно за счет экскреторного компонента (рис 4).
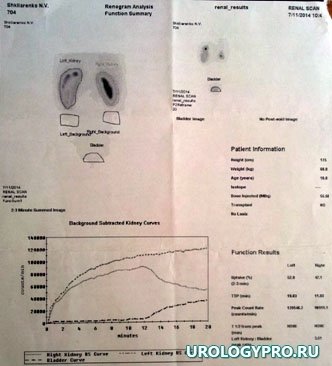
Рис. 4. Статическая нефросцинтиграмма (на фоне стентирование ВМП). Секреторная функция почек сохранена. Экскреция РФП слева замедлена.
Принимая во внимание результат морфологического исследования, молодой возраст, функциональную состоятельность почечной паренхимы, принято решение о возможности органосохраняющей операции.
Интраоперационно почечная паренхима состоятельна (рис 7), почка нормальных размеров, тургора; после вскрытия мочевых путей выявлено опухолевое образование розового цвета на довольно широком основании (рис. 6). Мочевые пути вне образования, такни вокруг мочеточника не изменены (рис 5). Произведена резекция верхней трети мочеточника, лоханки – удален фрагмент мочевых путей до 3 см с опухолью. При экспресс биопсии подтвержден фиброэпителиальный полип, хирургические края отрицательные. Выполнена нефроскопия и уретероскопия — патологических изменений лоханки и мочеточника не выявлено.
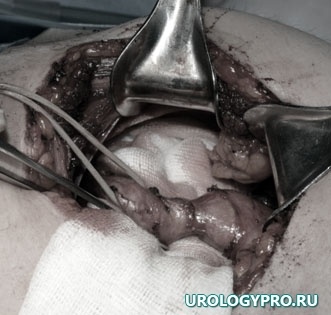
Рис. 5. Этап операции. Мобилизация верхних мочевых путей в зоне расположения опухоли.
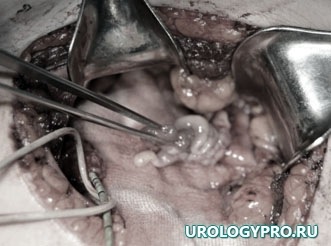
Рис. 6. Этап операции. Резекция мочевых путей с опухолью.
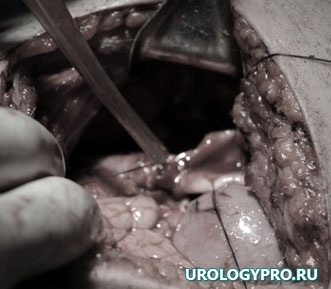
Рис. 7. Этап операции. Формирование анастомоза.
Мочевые пути дренированы стентом, сформирован уретеропиелоанастомоз по Хайнсу-Андерсену (рис 8).
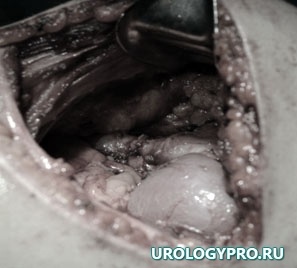
Рис. 8. Этап операции. Сформирован уретеропиелоанастомоз по Хайнсу-Андерсену.
Плановое гистологическое заключение — полип
Заключение
Представлено довольно редкое наблюдение крупного полипа прилоханочного отдела мочеточника. Реконструктивный характер хирургического лечения обусловлен морфологическими подтверждениями доброкачественной природы образования, молодым возрастом пациента, сохранностью мочевых путей и функциональной состоятельностью почечной паренхимы.
Симптоматика. Выявляемые в последнее время опухоли паренхимы почки у 35–70% больных бессимптомны. Эти опухоли стали обнаруживать при профилактических УЗИ с частотой 0,4–0,95% обследованных. Симптомы рака почки чрезвычайно многообразны и разделяются на ренальные и экстраренальные. Ренальные симптомы включают классическую триаду: гематурия, боль и пальпируемое образование в подреберье. Эта триада не позволяет установить диагноз своевременно, так как она характерна для далеко зашедшего опухолевого процесса и наблюдается лишь у 8% больных. Сочетание двух из этих симптомов, а именно боли и гематурии, встречается также при нефролитиазе. При этом дифференциально-диагностическим признаком является последовательность появления этих симптомов: при мочекаменной болезни сначала появляется почечная колика и лишь после ее купирования или стихания определяется наличие крови в моче, а при опухоли почки колика возникает после тотальной безболевой макрогематурии вследствие обтурации мочеточника сгустком крови. Все же необходимо отметить, что боль при опухоли почки обычно имеет ноющий характер. Эпизод тотальной безболевой макрогематурии может внезапно возникнуть среди полного здоровья и также неожиданно прекратиться. Причиной гематурии является разрыв варикозно расширенных вен форникальной зоны. Как уже отмечалось, в моче нередко появляются сгустки крови, которые являются слепком мочеточника и имеют червеобразную форму. При появлении крови в моче необходимо проведение цистоскопии для определения источника кровотечения. При цистоскопии можно выявить опухоль и другие заболевания мочевого пузыря или поступление мочи, окрашенной кровью, из устья мочеточника, что направит диагностику в определенном направлении. Несмотря на то что пальпируемое образование в подреберье зачастую трактуется как проявление запущенности, оно может явиться и первым симптомом заболевания. Далеко не всегда при пальпации живота и поясничной области можно определить признаки, характерные для опухоли почки: плотность, бугристость. Доступность пальпации неизмененной нижней половины почки может быть обусловлена смещением почки книзу в случае локализации новообразования в верхнем ее сегменте. При этом ошибкой будет отказ от поиска опухоли почки, связанный с тем, что врач на основании пальпации диагностирует нефроптоз. Экстраренальные симптомы: гипертермия, артериальная гипертензия, ускорение СОЭ, анемия (токсическое угнетение красного ростка костного мозга), эритроцитоз (повышение выработки эритропоэтина), симптоматическое варикоцеле (опухолевый тромбоз почечной или нижней полой вены, сдавление яичковой вены опухолью или лимфатическими узлами), неметастатическое нарушение функции печени (синдром Штауффера), гиперкальциемия.
Появилось мнение, что рак почки небольшого размера метастазирует очень редко. Вместе с тем у 5% больных первые проявления заболевания бывают обусловлены метастазами в отдаленных органах (кашель, кровохарканье при метастазах в легких; упорная головная боль при метастазах в головном мозге; часто рецидивирующие или постоянные радикулиты, межреберные невралгии при метастазах в костях и т.д.). Установить первоисточник опухоли в таких ситуациях бывает чрезвычайно трудно, тем более что новообразование в почке может оказаться очень небольшого размера.
Симптоматика. Бессимптомное течение в 10–25% наблюдений. У большинства пациентов (70–90% наблюдений) впервые возникает тотальная гематурия, зачастую (30–40%) сопровождающаяся болью в поясничной области из-за обтурации мочеточника червеобразным (слепок мочеточника) сгустком крови. У 10% пациентов имеется классическая триада опухоли паренхимы почки — боль, гематурия и пальпируемое образование, что указывает на распространенность процесса и плохой прогноз заболевания. Также о распространенном характере заболевания говорят потеря массы тела, общая слабость, отсутствие аппетита.
Опухоли верхних мочевых путей
Опухоли верхних мочевых путей (ВМП) начали изучать с середины XIX в. Первое описание первичного рака мочеточника принадлежит французскому патологоанатому P. Rayer (1841). Однако только в 1902 г J. Albarran впервые диагностировал опухоль мочеточника до операции. Улучшение диагностики опухолей ВМП сопровождалось разработкой тактики лечения. С начала XX в при злокачественных опухолях ВМП стали производить нефроуретерэктомию.
Однако результаты операции не были успешными, и только в 1914 г описан первый случай выживания после нефроуретерэктомии по поводу рака мочеточника.
Первичные опухоли ВМП относительно редки и составляют около 3% всех онкоурологических заболеваний. Большинство (до 80%) новообразований ВМП обнаруживают у больных в возрасте от 40 до 70 лет.
Опухоли почечной лоханки составляют 7 – 10% всех опухолей почки. Частота возникновения первичной опухоли почечной лоханки составляет 1,4 на 100 000 мужчин и 0,6 на 100 000 женщин на год. Первичные опухоли мочеточника встречаются реже и составляют примерно 1% всех опухолей почек и ВМП.
Опухоли чашечно-лоханочного комплекса почки с одинаковой частотой исходят из верхней и нижней чашечек и почечной лоханки, реже опухоли развиваются в средней чашечке или поражается вся чашечно-лоханочная система. Согласно другим исследованиям, опухоли чашечно-лоханочного комплекса чаще возникают в верхней чашечке.
Опухоли мочеточника преимущественно развиваются в его дистальном отделе. Такая локализация наблюдается в 68% случаев, в 20,3% поражается средняя треть мочеточника, в 9,4% — верхняя треть и в 2,3% — весь мочеточник.
Опухоли ВМП с одинаковой частотой обнаруживают справа и слева, в 2-4 случаев – двустороннее поражение.
Наличие опухоли ВМП значительно увеличивает риск развития новообразования мочевого пузыря. Установлено, что переходно-клеточный рак мочевого пузыря развивается у 30-50% больных раком мочеточника. Значительно выше (до 75%) частота последующего выявления рака мочевого пузыря при мультифокальном поражении ВМП, в 70% случаев опухоли мочевого пузыря развиваются в первые два года после возникновения новообразования ВМП.
Этиология и патогенез
Уротелий весьма чувствителен к различным химическим канцерогенам, находящимся в моче. Для возникновения опухоли, помимо канцерогенов, также необходимы так называемые ко-канцерогены или инциаторы онкогенеза. Последние вызывают гиперплазию уротелия, что увеличивает его чувствительность к химическим канцерогенам. Важную роль в развитии переходно-клеточного рака отводят длительности контакта канцерогенов и клеток уротелия. Роль застоя мочи в возникновении ВМП подтверждается чрезвычайно высокой (до 30%) частотой развития опухолей в дивертикулах мочеточников.
Значительное число химических веществ – канцерогены для уротелия: бензидин, ?-нафтиламин, аминобифенил, нитробифенил, диаминобифенил и другие. Установлена связь между количеством потребляемого с водой мышьяка и заболеваемостью переходно-клеточным раком ВМП. Наличие химических канцерогенов объясняет также большую частоту переходно-клеточного рака ВМП у городских жителей по сравнению с сельскими.
Многие исследователи считают важным фактором развития опухолей ВМП курение, около 77% наблюдавшихся ими больных с новообразованиями ВМП курили. Риск возникновения опухолей ВМП находится в прямой зависимости от числа выкуренных за день сигарет и продолжительности курения. Полагают, что у курящих в моче повышается концентрация промежуточных продуктов метаболизма триптофана, имеющих подобную ортоаминофенолу структуру, и являющихся сильными канцерогенами.
Установлено, что длительное нахождение конкрементов в почечной лоханке, выступающих в качестве ко-канцерогенов и вызывающих гиперплазию уротелия, приводит к увеличению риска развития плоскоклеточного рака почечной лоханки. С этим связаны до 60% случаев плоскоклеточного рака ВМП. Риск развития опухоли более чем в два раза возрастает при инфекции ВМП.
Частота опухолей ВМП повышается при некоторых заболеваниях. В частности, балканская эндемическая нефропатия повышает риск развития новообразований мочеточника и почечной лоханки в 100 раз.
У больных с артериальной гипертензией частота развития опухолей ВМП увеличена. При этом риск возникновения новообразований повышается в два раза при лечении таких больных диуретиками. Указывают также на незначительное возрастание риска развития переходно-клеточного рака ВМП при отягощенной наследственности по этому заболеванию.
Различают первичные и вторичные опухоли почечной лоханки и мочеточника. Под первичными понимают новообразования, исходящие непосредственно из ВМП, в то время как вторичные опухоли представляют метастазы злокачественных новообразований других органов. Вторичные поражения ВМП встречаются чрезвычайно редко, причем преимущественно в мочеточнике.
Опухоли почечной лоханки и мочеточника можно разделить на доброкачественные и злокачественные. Первые наблюдаются значительно реже. Из-за чрезвычайно высокого потенциала малигнизации доброкачественных эпителиальных опухолей ВМП отношение к ним должно быть как к высокодифференцированному неинвазивному раку.
При злокачественных опухолях ВМП часто обнаруживают несколько очагов малигнизации уротелия, поэтому клинически и прогностически важно выделить единичные и множественные (мультифокальные) новообразования. Последние определяют примерно в 20% случаев первичного рака ВМП.
Опухоли ВМП могут происходить из эпителиальной и мезенхимальной тканей. Частота последних крайне низка и составляет менее 1% всех случаев первичных опухолей почечной лоханки и мочеточника. Неэпителиальные доброкачественные опухоли ВМП – фиброма, нейрофиброма, ангиофиброма, липома, рабдомиома. Описаны единичные случаи злокачественных лейомиосаркомы фибросаркомы ВМП.
Первичные опухоли ВМП, таким образом, в подавляющем большинстве случаев происходят из уротелия. По гистологическому строению среди злокачественных эпителиальных новообразований выделяют переходно-клеточный рак, плоско-клеточный рак и аденокарциному. Большинство новообразований почечной лоханки и мочеточника представлено переходно-клеточным раком. Его частоту оценивают в 92-99% всехопухолей ВМП. Частота плоскоклеточного рака составляет 1-8%. Опухоли такого гистологического строения чаще обнаруживают в почечной лоханке. Аденокарциномы ВМП встречаются исключительно редко.
Общеупотребительной и клинически важной является классификация рака по системе TNM:
Чрезвычайно важное клиническое и прогностическое значение имеет определение степени дифференцировки опухолевых клеток.
По данным некоторых авторов, дифференцировка клеток при переходно-клеточном раке ВМП высокая (G1) в 4,8% случаев, умеренная (G2) – в 68% случаев, низкая или отсутствует (G3 и G4) – в 26,8%.
Опухоли ВМП разделяют на локализованные, региональные и метастатические. К локализованным относятся новообразования ВМП, не выходящие за пределы почечной лоханки, почки или мочеточника, при отсутствии поражения лимфатических узлов и отдаленных метастазов.
При региональной форме заболевания опухоль распространяется за пределы почечной лоханки или паренхимы почки и прорастает в перипельвикальную, периренальную или периуретеральную клетчатку, лимфатические узлы, лимфатические сосуды и соседние органы.
Признаком метастатических новообразований является распространение опухолевых клеток в отдаленные органы и ткани.
Наиболее частым симптомом опухолей почечной лоханки и мочеточника является гематурия. Она присутствует у 70-95% больных. Макрогематурия у 65-70% больных является первым симптомом опухоли у ВМП и в большинстве случаев служит причиной обращения к врачу, промежуток времени с момента появления гематурии до установления диагноза опухоли ВМП составляет в среднем 1 год.
Другим частым симптомом опухолей ВМП являются боли в поясничной области. Они отмечены у 20-50% больных и связаны с обтурацией мочеточника или лоханочно-мочеточникового сегмента опухолью.
Значительно реже опухоли ВМП проявляются дизурией (5-10%) и общими симптомами (5-15%), такими как похудание, снижение аппетита и субфебрилитет.
На поздних стадиях заболевания в 10-20% случаев можно пропальпировать в животе объемное образование, представляющее собой либо значительных размеров опухоль, либо гидронефротически измененную почку, у 13% больных с новообразованиями ВМП отсутствуют какие-либо клинические симптомы болезни.
В комплексе диагностических исследований для выявления опухолей ВМП включены физикальное обследование больного, цитологическое исследование мочи, экскреторная урография, ретроградная уретеропиелография, цистоскопия, уретеропиелоскопия, компьютерная томография и, при необходимости, почечная артериография.
При физикальном исследовании больных с опухолями ВМП иногда удается пропальпировать объемное образование в животе.
Цитологическое исследование мочи (ЦИМ) позволяет выявить атипичные опухолевые клетки. При ЦИМ частота ложно-негативных результатов достигает 65% и особенно велика (96%) при стадии Т1. Диагностическая ценность ЦИМ повышается при сборе мочи путем катетеризации мочеточника.
Экскреторная урография является важным и обычно начальным методом обследования больных с подозрением на опухоль ВМП.
При новообразованиях мочеточника экскреторная урография менее информативна.
Другим важным рентгенологическим методом исследования является ретроградная уретеропиелография. Характерными признаками опухоли мочеточника является дефект наполнения мочеточника с характерным контуром его нижнего края в виде бокала и локальное расширение мочеточника дистальнее дефекта наполнения. Во время подготовки к ретроградной уретеропиелографии при катетеризации мочеточника можно выявить два достаточно специфичных для опухоли мочеточника симптома. Первый из них заключается в выделении мочи с примесью крови до и во время прохождения препятствия в мочеточнике и прекращение гематурии после его преодоления (симптом Шевассю). Другим признаком опухоли мочеточника является изгиб мочеточникового катетера в расширенном пространстве дистальнее опухоли мочеточника (симптом Бергмана).
Цитоскопия позволяет выявить пролабирующую из устья мочеточника опухоль, состояние слизистой оболочки вокруг его устья, а также обнаружить выделение крови из устья мочеточника.
Уретеропиелоскопию используют для диагностики новообразований почечной лоханки и мочеточника последние 15-20 лет. Совершенствование эндоскопической техники, в частности, появление гибких уретеропиелоскопов, позволило считать уретеропиелоскопию одним из наиболее ценных методов исследования при опухолях ВМП. Помимо визуальной оценки стенки мочеточника и почечной лоханки во время уретеропиелоскопии можно сделать биопсию подозрительных участков для проведения морфологического исследования, а в некоторых случаях – выполнить операцию.
Диагностическая уретеропиелоскопия не повышает риск диссеминации опухолевых клеток и не оказывает влияния на отдаленные исходы и выживаемость пациентов с переходно-клеточным раком ВМП.
Компьютерная томография (КТ) широко применяется в диагностике опухолей ВМП и позволяет выявить прорастание переходно-клеточного рака в почечную паренхиму, распространение опухолей за пределы почки в соседние ткани, поражение лимфатических узлов и наличие отдаленных метастазов.
Ультразвуковое исследование (УЗИ) позволяет выявить инфильтрацию переходно-клеточного рака в почечную паренхиму, проявляющуюся образованьями с пониженной эхогенностью. УЗИ играет важную роль в дифференциальной диагностике новообразований почечной лоханки и рентгенонегативных камней почки.
Почечная артериография может оказаться полезной при проведении дифференциальной диагностики почечно-клеточного и переходно-клеточного рака, прорастающего в почечную паренхиму. Инфильтрирующие опухоли, исходящие из почечной лоханки, на артериограммах обычно гиповаскулярны.
Для обнаружения отдаленных метастазов используют рентгенографию грудной клетки, сцинтиграфию костей, сцинтиграфию и УЗИ печени.
В ранней диагностике злокачественных эпителиальных новообразований ВМП перспективным представляется выявление специфических маркеров опухолевого процесса. С этой целью предлагали определять концентрацию продуктов деградации фибриногена в моче, повышение уровня которых может быть при переходно-клеточном раке.
Основным методом лечения опухолей ВМП является оперативный. Помимо хирургического лечения применяют химио- и радиотерапию, однако чувствительность опухолевых клеток к ним мала.
Выбор тактики лечения новообразований ВМП зависит от стадии заболевания, степени дифференцировки опухолевых клеток, локализацию новообразований, множественности поражения, состояния противоположной почки, а также от наличия у больного противопоказаний к оперативному лечению.
Стандартными и общепризнанными методами лечения больных с локализованным переходно-клеточным раком почечной лоханки и мочеточника являются нефроуретерэктомия с резекцией мочевого пузыря и, в некоторых случаях, сегментарная резекция мочеточника.
Нефроуретерэктомия с резекцией мочевого пузыря показана при локализованных злокачественных опухолях почечной лоханки и мочеточника (кроме дистального отдела) при сохраненной функции противоположной почки. Выбор этой операции основан на высоком риске распространения опухоли по мочеточнику дистальнее первичного очага и редком развитии синхронных асинхронных опухолей ВМП с противоположной стороны.
Длительное время нефроуретерэктомию с резекцией мочевого пузыря выполняли через два разреза: первый – в подвздошной области для резекции мочевого пузыря вокруг устья соответствующего мочеточника; второй – в поясничной области (люмботомия) для выполнения нефроуретерэктомии. Считали, что при этом снижается риск имплантационного метастазирования. Однако в настоящее время в большинстве случаев нефроуретерэктомию и резекцию мочевого пузыря выполняют из одного разреза, поскольку такой доступ на самом деле не повышает риск развития рецидивов и не ухудшает выживаемость больных.
Некоторые исследователи рекомендуют выполнять нефроуретерэктомию после предварительной эндоскопической резекции стенки мочевого пузыря в окружности устья мочеточника.
Другим направлением является выполнение лапароскопической нефроуретерэктомии с предварительной резекцией мочевого пузыря из трансуретрального доступа. Некоторые авторы считают лапароскопическую нефроуретерэктомию методом выбора при минимально инвазивном переходно-клеточном раке ВМП, рекомендуют лапароскопическую нефроуретерэктомию больным с сопутствующими соматическими заболеваниями, так как она, по мнению авторов, лучше переносится больными.
Сегментарная резекция мочеточника выполняется при высоко (G1) и умеренно дифференцированных (G2) поверхностных (неинвазивных) опухолях дистальной третьи мочеточника при отсутствии проксимального поражения. Такая операция возможна из-за исключительной редкости распространения опухолевых клеток проксимальнее первичного очага.
Трех- и десятилетняя выживаемость после сегментарной резекции дистального мочеточника по поводу поверхностного высоко или умеренно дифференцированного переходно-клеточного рака не отличались от таковых после нефроуретерэктомии.
При низкодифференцированных и инвазивных опухолях дистальной трети мочеточника методом выбора является нефроуретерэктомия с резекцией мочевого пузыря.
После проведения сегментарной резекции мочеточника необходимо обеспечить пассаж мочи путем выполнения уретеронеоцистоанастомоза.
В настоящее время изучают возможности эндоскопических методов лечения опухолей ВМП. В настоящее время мало данных относительно отдаленных исходов и выживаемости после этих операций, поэтому эндоскопические методы преждевременно рассматривать в качестве стандартных для лечения новообразований ВМП. Эндоскопические оперативные методы лечения включают уретеропиелоскопическую и перкутанную электрорезекцию, электрокоагуляцию и лазерную коагуляцию опухоли. Эти оперативные вмешательства должны применяться только в случаях поверхностного высокодифференцированного локального переходно-клеточного рака ВМП.
Отбор больных основан на результатах биопсии. Однако такая хирургическая тактика требует осторожности, так как возможна неточная оценка степени инвазии и распространенности опухоли. Для своевременного обнаружения рецидивов опухоли после проведения эндоскопических оперативных вмешательств необходимо периодически выполнять цитологическое исследование мочи, экскреторную урографию и уретеропиелоскопию.
Эндоскопические методы лечения в основном применяются у больных с опухолями ВМП при хронической почечной недостаточности, единственной почке, двустороннего поражения и тяжелых сопутствующих заболеваниях, когда невозможно выполнить более радикальное оперативное вмешательство.
В послеоперационном периоде возможно проведение адъювантной терапии, основными направлениями которой являются системная химиотерапия, радиотерапия и топическая химио- и иммунотерапия.
Новым направлением в лечении является применение топической (внутрилоханочной и внутримочеточниковой) цитотоксической и иммунотерапии. Описан опыт применения цитотоксических средств (митомицин, доксорубицин) и иммунотропных препаратов (вакцина БЦЖ, интерферон), при переходно-клеточном раке мочевого пузыря, для местного лечения поверхностных опухолей ВМП в качестве адьювантной терапии после эндоскопических органосохраняющих операций. В просвет лоханки и мочеточника препараты доставляются соответственно через нефростому и мочеточниковый катетер. Отдаленные результаты изучены недостаточно. Лечение применялось, главным образом, у больных с противопоказаниями к радикальной операции (единственная почка, билатеральные поражения, хроническая почечная недостаточность).
При распространении переходно-клеточного рака ВМП на лимфатические узлы эффективность лечения остается низкой.
Злокачественные новообразования ВМП отличаются высоким уровнем метестазирования. Весьма высока частота рецидивирования рака ВМП. Она оценивается в 12-18%. Прогноз для больных с метастатическим или рецидивным переходно-клеточным раком почечной лоханки и мочеточника, как правило, плохой.
Режимы химиотерапии, относительно эффективные при лечении метастатического рака мочевого пузыря, могут применяться и при переходно-клеточном раке ВМП. Необходимо назначать одновременно несколько химиопрепаратов. Наиболее распространенным в настоящее время можно считать режим химиотерапии M-VAC (метотрексат, винбластин, доксорубицин, цисплатин). Другими химиотерапевтическими препаратами, используемыми при метастатическом переходно-клеточном раке, являются ифосфамид, галлиум-нитрат, гемцитабин.
Проведение агрессивной химиотерапии при метастатическом и рецидивном переходно-клеточном раке ВМП может сопровождаться выраженными побочными эффектами. Чаще всего отмечаются тошнота или рвота, лейкопения, анемия, тромбоцитопения.
Переходно-клеточный рак почечной лоханки и мочеточника излечим в 90% пациентов, если он поверхностный и ограничен почечной лоханкой и мочеточником. Инвазивные опухоли, но также ограниченные почечной лоханкой и мочеточником, имеют благоприятный исход в 10-15% случаев. Опухоли, прорастающие в соседние ткани, а также метастазирующие в отдаленные органы, остаются практически неизлечимыми.
В настоящее время продолжается поиск новых возможностей для точного прогнозирования и лечения больных.
- КЛЮЧЕВЫЕ СЛОВА: опухоль верхних мочевыводящих путей, уротелиальный рак
Последние рекомендации Европейской ассоциации урологии (ЕАУ) относительно уротелиального рака верхних мочевыводящих путей (УРВМП) были опубликованы в 2013 г. [1]. Группа экспертов ЕАУ по УРВМП подготовила настоящие рекомендации для обеспечения врачей доказательной подкрепленной информацией , используемой в клиническом лечении этих редких опухолей, и для помощи врачам при включении этих рекомендаций в практику. Данные обновленные рекомендации составлены на основании структурированного литературного поиска.
2.1. Поиск литературных данных
Поиск литературных данных на ресурсе Medline по теме УРВМП осуществлялся при использовании следующих терминов: рак мочевых путей, уротелиальная опухоль, верхние мочевыводящие пути (ВМП), карцинома, переходно-клеточный рак, почечная лоханка, мочеточник, рак мочевого пузыря, химиотерапия, нефроуретерэктомия, адъювантное лечение, неоадъювантное лечение, рецидив, факторы риска, выживаемость. Исследования, касающиеся УРВМП, в большинстве случаев были ретроспективными, в том числе несколько больших многоцентровых исследований. Из-за недостатка рандомизированных исследований отбор статей для данных рекомендаций осуществлялся согласно следующим критериям: оценка дизайна исследования, среднесрочные и отдаленные клинические результаты, актуальность. Более ранние публикации включены выборочно, если они были исторически релевантны , при условии недостатка данных в современных источниках. Для помощи в оценке качества приводимой информации используются уровни доказательности (УД) и степени рекомендаций (СР), которые были установлены в соответствии с основными принципами доказательной медицины [2].
2.2. История публикаций
Первая публикация рекомендаций ЕАУ относительно опухолей верхних мочевыводящих путей представлена в 2004 г. [3]. Эти рекомендации были обновлены, включены в новую редакцию рекомендаций ЕАУ и изданы в 2013 г. Настоящий вариант рекомендаций от 2014 г. представляет собой частично обновленный и дополненный вариант рекомендаций от 2013 г.
2.3. Заявление о потенциальном конфликте интересов
3. СИНТЕЗ ДОКАЗАТЕЛЬСТВ
Уротелиальный рак занимает 4-е место по распространенности среди злокачественных опухолей после рака простаты (или рака молочных желез), легкого и колоректального рака [4, 5]. Данный вид опухоли может возникать как в нижних (в мочевом пузыре или уретре), так и в верхних мочевых путях — ВМП (в чашечно-лоханочной системе почки или мочеточнике). Рак мочевого пузыря (РМП) составляет 90–95% всех случаев уротелиального рака и является наиболее распространенной злокачественной опухолью мочевыводящих путей [1, 5]. УРВМП встречается довольно редко и составляет 5–10% всех случаев уротелиального рака [4, 6]. Ежегодная заболеваемость УРВМП в западных странах составляет около двух случаев на 100 тыс. населения. Опухоли лоханки почки встречаются в 2 раза чаще, чем опухоли мочеточника. В 17 % случаев одновременно присутствует рак мочевого пузыря [7]. Рецидив заболевания в мочевом пузыре встречается у 22–74% пациентов, страдающих УРВМП [10, 11], в то время как рецидив с контралатеральной стороны встречается только в 2–6% случаев [11, 12].
Характеристика УРВМП иная при РМП: 60% уротелиальных опухолей ВМП являются инвазивными на момент установления диагноза по сравнению с 15% при РМП [13, 14]. Пик заболеваемости УРВМП приходится на возраст от 70 до 80 лет, и у мужчин такие опухоли встречаются втрое чаще, чем у женщин .
Наследственные случаи УРВМП сочетаются с наследственным неполипозным колоректальным раком [17]. Среди пациентов с УРВМП эти случаи могут быть определены в ходе сбора анамнеза. Подозревать наследственную форму УРВМП можно в том случае, если пациент моложе 60 лет, имеет в анамнезе неполипозный колоректальный рак и у него есть родственник первой степени родства моложе 50 лет с неполипозным колоректальным раком или два родственника первой степени родства с неполипозным колоректальным раком [180]. Этим пациентам следует провести секвенирование ДНК с целью выявления наследственного рака, который мог быть неверно классифицирован как спорадический за счет недостаточных клинических данных [19]. Следует также оценить наличие других типов рака, ассоциируемых с неполипозным колоректальным раком. За такими пациентами нужно тщательно наблюдать, им рекомендуется консультация генетика [17, 19].
3.2. Факторы риска
Существует большое количество природных факторов, способствующих возникновению УРВМП. Некоторые из них ассоциированы с развитием РМП, но есть факторы, специфичные для УРВМП. Курение табака и профессиональная деятельность остаются основными экзогенными факторами риска для развития этих опухолей. Курение увеличивает риск развития УРВМП с 2,5 до 7 % [20, 21]. Профессиональная деятельность, связанная с определенными ароматическими аминами, также является фактором риска (лакокрасочная, текстильная, химическая, нефтяная и угольная промышленность). У людей, занятых на таких производствах, реализуется канцерогенный эффект определенных химических веществ, таких как бензидинин и β-нафталин. Эти два вещества были запрещены с 60-х годов ХХ в. в большинстве индустриальныхстран. Средняя продолжительность воздействия данных веществ, необходимая для развития УРВМП, составляет приблизительно 7 лет, с латентным периодом до 20 лет. Приблизительный риск (отношение шансов) развития УР после контакта с ароматическими аминами составляет 8,3 [21, 22].
Уротелиальный рак верхних мочевыводящих путей как следствие применения фенацетина практически перестал встречаться после того, как данный продукт был запрещен в 1970-х гг.
Хотя частота балканской эндемичной нефропатии снижается, было высказано предположение о роли аристолохиевой кислоты и употребления китайских травяных препаратов в патофизиологии и индуцировании этой нефропатии [23, 24, 25, 26]. Некоторые исследования выявили канцерогенный потенциал аристолохиевой кислоты, которая содержится в растениях Aristolochia fangchi и Aristolochia clematis, эндемичных для Балкан. Эта кислота содержит ряд высокотоксичных производных-нитрофенолятов, которые имеют мощное мутагенное действие благодаря их способности образовывать ковалентные связи с клеточной ДНК. Производное аристолоховой кислоты d-аристолактам вызывает мутацию в гене р53, в кодоне 139. Эта мутация очень редка в популяции, не подверженной воздействию мутагена, и наблюдается в основном у пациентов с нефропатией, возникшей в результате приема китайских препаратов народной медицины, или у пациентов с балканской нефропатией, у которых был выявлен УРВМП [21 ,23, 24] .
Высокая заболеваемость УРВМП также описана на Тайване, особенно у населения юго-западной части острова, что составляет 20–25% всего уротелиального рака в регионе [21, 24]. Ассоциация УРВМП с редким заболеванием периферических сосудов ног с гангреноподобными симптомами, встречающимся только в провинции Тайвань в Китае, вызываемым соединениями мышьяка, попавшими в питьевую воду, остается неясной в данной популяции пациентов [21, 24].
Различия в способности взаимодействия канцерогенов могут объяснять особенности в восприимчивости и риске развития уротелиального рака. В одном случае определенная совокупность генов может быть защитным фактором, в другом случае — фактором, повышающим риск заболевания. Кроме того, УРВМП и УР мочевого пузыря могут иметь общие факторы риска развития или общие пути разрыва молекул , хотя каждое заболевание все же имеет свои конкретные проявления. Поскольку определенный полиморфизм генов ассоциирован с увеличением риска развития и прогрессирования болезни, имеет значение вариабельность в индивидуальной восприимчивости к фактору риска. До сих пор известно только два случая полиморфизма, характерного для УРВМП [27, 28]. Вариантный аллель SULT1A1*2, понижающий активность сульфотрансферазы, и полиморфизм в Т-аллеле rs9642880 на хромосоме 8q24 повышают риск развития УРВМП.
3.3. Классификация и гистология
3.3.1. Гистологические типы
Более 95% случаев уротелиального рака развивается из уротелия и относится к УРВМП или РМП [13, 29]. Что касается УРВМП, его морфологические варианты описаны как более часто встречаемые при уротелиальных опухолях почки. Они относятся к опухолям высокого злокачественного потенциала и соответствуют одному из следующих вариантов: микропапиллярному, светлоклеточному, нейроэндокринному и лимфоэпителиальному [29, 30]. Рак собирательных протоков имеет сходные характеристики с УРВМП благодаря общему эмбриологическому происхождению [31].
Опухоли ВМП с неуретральной морфологической структурой встречаются довольно редко [32, 33], но различные морфологические варианты могут наблюдаться почти в 25% случаев [34]. Эпидермоидный рак ВМП встречается менее чем в 10% случаев опухолей чашечно-лоханочной системы и еще реже — при опухолях мочеточника. Эпидермоидный рак мочевыводящих путей чаше встречается при хроническом воспалении и инфекции, при камнях в мочевыводящих путях. Другие морфологические типы представлены аденокарциномой ( 56 ]. Чувствительность МР-урографии составляет 75% после инъекции контрастного вещества для опухолей размером менее 2 см. Урография с использованием МРТ и некоторых контрастных веществе, содержащих гадолиний, противопоказана пациентам с тяжелой почечной недостаточностью (при клиренсе креатинина менее 30 мл/мин) ввиду высокого риска нефрогенного системного фиброза.
3.5.2. Цистоскопия и цитологический анализ мочи
Положительный цитологический анализ мочи при нормальных результатах цистоскопии мочевого пузыря и при том, что наличие CIS в мочевом пузыре или простатической уретре в целом исключено (например, по результатам биопсии подозрительных очагов, возможно, с помощью фотодинамической диагностики), позволяет с высокой степенью вероятности предположить, что у пациента имеет место УРВМП. Цитология менее чувствительна к УРВМП, чем к опухолям мочевого пузыря, даже в случае опухолей с высокой степень злокачественности, и идеальный вариант подразумевает выполнение ее in situ (т.е. в почечных лоханках [58]). Ретроградное обследование мочеточников и почечных лоханок (через катетер, введенный в мочеточник, или во время эндоскопии мочеточников) остается одним из вариантов исключения опухоли в верхних мочевыводящих путях. Однако цитологическое исследование мочи, содержащейся в почечных полостях и мочеточниках, желательно выполнять до введения значительных количеств контрастного вещества для ретроградной урографии мочеточников и почечных лоханок, так как контрастное вещество может испортить цитологические образцы.
Чувствительность флюоресцентной гибридизации in situ (FISH) для идентификации молекулярных аномалий, характеризующих УРВМП, сопоставима с показателями для этого метода в отношении мочевого пузыря. Однако использование метода может быть ограничено преобладанием низкорисковых рецидивирующих опухолей у изучаемого населения и минимальной инвазивной терапией при УРВМП [60, 61]. Кроме того, метод FISH имеет ограниченное наблюдательное значение для УРВМП в верхних мочевых путях [60, 61].
3.5.3. Диагностическая уретероскопия
Для визуализации и биопсии мочеточника, почечных лоханок и сборной системы используется гибкий эндоскоп, технический успех составляет около 95%. Такая биопсия мочеточника позволяет определить степень дифференцировки опухолевых клеток в 90% случаев с низким уровнем ложноотрицательных результатов вне зависимости от размера образца [ 62 ]. Диагностическая биопсия может привести к занижению степени развития опухоли, поэтому, если выбирается вариант лечения с сохранением почки, потребуется интенсивный последующий контроль. Эндоскопия мочеточника также облегчает селективное взятие биоптата для цитологического анализа in situ [59, 64, 65].
Эндоскопия с помощью гибкого эндоскопа особенно полезна в случаях диагностической неопределенности, когда рассматривается консервативное лечение или если у пациента всего одна почка. По возможности эндоскопию мочеточника следует выполнять в качестве предоперационной оценки любых пациентов с УРВМП. Сочетание степени развития опухоли по данным биопсии мочеточника, диагностической визуализации (признаком является гидронефроз) и цитологического анализа мочи помогает при принятии решений о выборе между радикальной нефроуретерэктомией (РНУ) и эндоскопическим лечением.
Техническое развитие гибких уретероскопов и использование новейшей технологии визуализации улучшают качество изображения и диагностику плоских очагов поражения. Наиболее многообещающей технологией является узкополосная визуализация, но ее результаты все еще предварительные [66, 67]. В табл. 3-2 приводятся рекомендации для диагностики.
3.6. Прогностические факторы
УРВМП, которые прорастают в мышечный слой, обычно имеют очень плохой прогноз. Пятилетняя выживаемость для этого вида опухоли составляет менее 50% в случае pT2/pT3 и
