
Лечение распространенных рецидивных и метастатических злокачественных опухолей остается одной из нерешенных проблем современной онкологии [4,5]. Причиной смерти таких больных, как правило, является прогрессирование опухолевого процесса в виде распространения и роста рецидивных и метастатических очагов. Основным методом лечения ЗНО был и остается хирургический компонент. Однако в тех случаях, когда вторичный опухолевый очаг невозможно или нецелесообразно удалить хирургическим путем, в онкологической практике применяют химиотерапевтическое лечение. Различные виды опухолей имеют различную степень чувствительности к цитостатическим препаратам [8]. Согласно современной классификации в зависимости от их чувствительности к противоопухолевой терапии различают три основных типа опухолей. Больных с такими опухолями, как лимфогранулематоз, семиномы, можно излечить при помощи химиотерапии. Другие опухоли не чувствительны к лечению цитостатиками (рак почки, рак щитовидной железы). Самая большая и самая распространенная группа опухолей обладает относительной чувствительностью к химиотерапевтическому лечению (рак молочной железы (РМЖ), меланомы кожи, колоректальный рак (КРР), саркомы мягкой ткани (СМТ), плоскоклеточный рак головы и шеи (ПРГШ)) [6]. Рецидивирование и метастазирование опухолей этого вида предопределяет неблагоприятный прогноз течения заболевания, и задачи вылечить больного, как правило, не ставится. Основная цель назначения лечения этих больных – продление жизни пациента. Срок дожития пациента является основным прогностическим фактором для пациентов с распространенным процессом. В свою очередь, срок дожития зависит от количества опухолевых очагов, их совокупной массы и их локализации. А также, по нашему мнению, в первую очередь, от скорости роста этих очагов.
Известно, что точка приложения любого из цитостатиков – пролиферативно-активная опухолевая клетка, находящаяся в процессе деления. Клетки опухоли, находящиеся в состоянии пролиферативного покоя, не чувствительны к цитостатикам. В свою очередь, опухолевый рост обусловлен увеличением числа клеток паренхимы вследствие их митотического деления. Одновременно с увеличением числа клеток в опухоли идут естественные процессы их убыли вследствие процессов некроза, апоптоза, миграции клеток в кроветворное и лимфатическое русло [1, 2, 3]. Совокупность всех этих процессов именуется фактором клеточных потерь (ФКП) [5]. Скорость роста опухолевых очагов определяется соотношением увеличения числа клеток (митотической активности опухоли (МАО)) и ФКП [7]. Чем быстрее скорость роста опухоли, тем быстрее опухолевый очаг достигнет величины, не совместимой с жизнедеятельностью организма. Медленно растущие опухоли будут определять более продолжительные сроки дожития пациентов с распространенным опухолевым процессом.
Мы определили две основные цели настоящей работы:
● определение влияния кинетических параметров роста рецидивных и метастатических опухолей на динамику прогрессирования онкологического заболевания.
● Оценка влияния, которое оказывает лечение цитостатиками на скорость роста рецидивных и метастатических опухолей.
К кинетическим параметрам в нашей работе были отнесены: митотическая активность опухоли (МАО), фактор клеточных потерь ФКП, а также скорость роста опухоли. Учитывая экспоненциальный характер роста опухолей за счет удвоения опухолевых клеток, скорость роста опухолей определялась как ВУО (время удвоения опухоли).
Для достижения указанных целей были поставлены следующие задачи:
1. Разработать математическую модель опухолевого роста, в которой бы учитывалось влияние структурных параметров на кинетику роста опухоли.
2. На основе указанной модели разработать компьютерную программу, позволяющую рассчитывать ФКП и скорость опухолевого роста для конкретных клинических случаев.
3. Исследовать кинетические свойства рецидивных и метастатических опухолей.
4. Оценить влияние кинетических параметров роста исследуемых опухолей на прогноз выживаемости.
5. Сопоставить кинетические параметры опухолей пациентов, получавших и не получавших химиотерапевтическое лечение.
Всего на базе Нижегородского областного онкологического диспансера было обследовано 130 пациентов с рецидивными и метастатическими опухолями различных локализаций, обладающих умеренной чувствительностью к химиотерапии. Было выбрано пять видов вторичных опухолей: саркомы мягких тканей (СМТ), колоректальный рак (КРР), меланомы кожи, рак молочной железы (РМЖ) и плоскоклеточный рак головы и шеи (ПРГШ). Информация о количественном соотношении больных в разных группах приведена в табл. 1. Каждому из исследуемых пациентов удалялись рецидивные или метастатические очаги (при технической невозможности или нецелесообразности их удаления бралась биопсия из нескольких участков очагов (преимущественно из их периферических отделов)). Проводилось морфометрическое исследование полученных гистологических препаратов. Определялись следующие структурные параметры опухолей: доля клеток паренхимы в состоянии митоза, доля клеток в интерфазе, доля клеток в состоянии пролиферативного покоя. Также определялись те доли объема, которые занимают в опухоли строма и некрозы. Прослежены результаты трехлетней выживаемости для вторичных опухолей пяти исследованных нами локализаций.
Распределение клинических наблюдений по локализациям первичных очагов и типу проведенного ранее лечения
Не получавшие химиотерапевтического лечения
Конкурирующие интересы: авторы заявили, что конкурирующих интересов не существует.
Задуманные и разработанные эксперименты: SAJ MJ. Выполняли эксперименты: SAJ HJS MV. Проанализированы данные: SAJ TVP. Используемые реагенты / материалы / инструменты анализа: SAJ HJS MV TVP PVD MJ. Написал газету: SAJ HSN MJ PVD. Просмотрел и отредактировал финальную рукопись: HJS MV TVP PVD MJ.
Индекс активности митоза (MAI) является важным независимым прогностическим фактором и неотъемлемой частью системы классификации рака молочной железы. Таким образом, правильная оценка этого прогностически значимого признака необходима для руководства принятием решения о лечении и оценки прогноза пациента.
Цель этого исследования состояла в том, чтобы утвердить использование изображений полного скольжения высокого разрешения (WSI) при оценке MAI в образцах рака молочной железы.
MAI оценивали в 100 последовательных образцах рака молочной железы тремя наблюдателями в двух случаях, микроскопически и на WSI с периодом вымывания 4 месяца. MAI также был переведен на митотические оценки, как при классификации. Измерялось меж- и внутрисерверное согласие между микроскопическими и цифровыми значениями МАИ и оценками.
Почти идеальные соглашения между наблюдателями были получены из подсчета MAI с использованием обычного микроскопа (коэффициент внутриклассовой корреляции (ICCC) 0.879), а также WSI (ICCC 0.924). Коэффициенты K отражали хорошие соглашения между наблюдателями среди микроскопических митотических оценок наблюдателей (средняя каппа 0,642). Сопоставимые результаты также наблюдались среди цифровых митотических оценок (средняя каппа 0,635). Существовало сильное совершенствование соглашений между наблюдателями между подсчетами МАИ и митотическими оценками для двух диагностических методов (ICCC 0,716-0,863, каппа 0,506-0,617). Существенных различий в митотических показателях не было, используя оба диагностических метода.
Скоринг митозов с использованием WSI при раке молочной железы кажется столь же надежным и воспроизводимым, как при использовании микроскопа. Дальнейшая разработка программного обеспечения и качества изображения определенно будет способствовать использованию WSI в обычной практике патологии.
Более десяти лет назад практика патологии начала меняться с внедрением слайд-сканеров, которые позволяют получать информацию о патологии из стеклянных слайдов и переводить ее в цифровую форму, обычно известную как цифровые слайды или целые слайд-изображения (WSI). WSI обеспечивает возможность просмотра и обработки образцов патологии на экране компьютера способом, сопоставимым с обычным микроскопом [1]. Кроме того, WSI обладает многими преимуществами по сравнению со стеклянными слайдами и обычным микроскопом; включая легкую доступность изображений, совместное использование, аннотирование и адаптацию к автоматизированному анализу изображений, который, как считается, повышает объективность и производительность в практике патологии. Эти функции способствовали интеграции WSI в различные приложения для патологии, в основном используемые для обучения, консультаций, диагностики замороженных участков, обеспечения качества, клинико-патологических конференций и исследований [1] — [4]. Несмотря на то, что несколько исследований валидации показали, что диагностические показатели с использованием WSI сопоставимы с показателями обычного микроскопа [5] — [12], внедрение WSI в первичной диагностике все еще находится в зачаточном состоянии. Однако WSI использовались для этой цели в некоторых лабораториях патологии после проведения собственных локальных исследований валидации [13], [14]. Одним из возможных факторов, препятствующих интеграции WSI в повседневную практику патологии, является то, что они еще не одобрены для первичной диагностики Управлением по контролю за продуктами и лекарствами (FDA) [15]. Кроме того, FDA классифицирует сканеры в целом как медицинские устройства класса III (классификация слайдов сканера), что требует обширных систематических исследований валидации и предварительного одобрения до того, как WSI станет платформой для первичной диагностики [16].
Из наших предыдущих исследований, касающихся валидации WSI для первичной диагностики различных систем организма [6] — [9], мы пришли к выводу, что WSI содержит достаточную информацию для большей части диагностики внутри патологии. Тем не менее, мы ожидаем, что изучение тонких клеточных деталей, таких как клеточное деление (митоз) на WSI, сканированное в одной фокальной плоскости, может вызвать некоторые диагностические трудности. Таким образом, проверка достоверности WSI при оценке этой теоретически сложной, но клинически значимой функции имеет решающее значение.
При раке молочной железы опухолевая пролиферация является одним из наиболее важных независимых прогностических факторов и является неотъемлемой частью системы оценки опухоли молочной железы [17], [18], которая также влияет на определение лечения пациентов [19]. Для оценки пролиферации можно использовать различные методы [20] — [22]; наиболее распространенным методом, используемым в общей практике, является оценка индекса митотической активности (МАИ). MAI определяется как число митотических фигур в данной области опухоли [23]. Традиционно MAI оценивают на стеклянных слайдах с использованием световой микроскопии, где митоз подсчитывается в 10 областях с высокой степенью мощности (увеличение 40 ×) или на единицу площади (2 мм2) в наиболее активной части опухоли [21], [23], [ 24]. Подсчет МАИ под микроскопом требует дифференциации истинных митозов от подобных фигур, таких как апоптотические тела, темные ядра и тканевые артефакты, для которых требуется трехмерный вид и тонкая микроскопическая фокусировка. Отсутствие оси z и способность тонкой микроскопической фокусировки на WSI, сканируемой на одной фокальной плоскости, могут привести к переоценке или переоценке баллов МАИ на WSI. Насколько нам известно, это первое многосерверное исследование, посвященное проверке оценки MAI при раке молочной железы на основе WSI и цифрового микроскопа.
Это исследование было проведено в экспертном центре Symbiant Pathology в Нидерландах, состоящем из лабораторий патологии в трех разных местах, обслуживающих 6 больниц в провинции Северная Голландия с населением около миллиона человек. Для этого исследования не требовалось одобрение комитета по этике или согласие с пациентом. Кроме того, все образцы были правильно закодированы и анонимизированы (Федеральные рекомендации).
В исследование были включены сто последовательных случаев рака молочной железы, которые были ранее оценены для их пролиферативной активности. Они касались 6 биопсий в случаях неоадъювантной химиотерапии и 94 резекции из двух лабораторий. Из каждого случая один представительный слайд был выбран двумя патологоанатомами, которые будут использоваться для оценки индекса митотической активности (MAI). Кроме того, области для подсчета митоза были отмечены заранее. Это исследование проводилось в два этапа. Во-первых, MAI был оценен тремя наблюдателями на той же отмеченной области на выбранных стеклянных слайдах с использованием световой микроскопии. После этого стеклянные слайды были отсканированы и после периода промывания не менее 4 месяцев WSI были представлены тем же наблюдателям, чтобы пересчитать митоз. В таблице 1 подробно описаны случаи, включенные в исследование.
Микроскопически только клетки с очень выраженной морфологией митоза были подсчитаны так, как они были определены ранее [17], [25] из-за отсутствия ядерной мембраны, четко видимого волосатого расширения ядерного материала (конденсированной хромосомы), либо свернутого (начало метафазы), в плоскости (метафаза / анафаза) или в отдельных сгустках (телофазе). Сомнительные клетки с гиперхроматическим ядром или клетками, подозреваемыми в апоптозе, были исключены. Вышеупомянутые критерии были приняты при подсчете митозов с использованием обычного микроскопа, а также WSI.
Время, необходимое для подсчета митоза, было зарегистрировано для первых десяти случаев в этом исследовании. Кроме того, все наблюдатели оценивали качество ткани (как плохое, приемлемое или хорошее) и качество сканирования (как туманное, приемлемое с некоторыми нечеткими областями, приемлемое или хорошее).
Два патолога отметили регионы для митозов, рассчитывая на слайды H & E. Эти области были отобраны в самой клеточной области опухоли, главным образом расположенной в периферической инвазивной части опухоли, как и раньше [26]. Были исключены районы с некрозом или карциномой прямой кишки. Подсчет митозов проводился с увеличением 400 × с использованием светового микроскопа Leica, оснащенного объективом 10 × окуляр и 40 × (0,85 Н / А) (с диаметром поля около 540 мкм) в 9 последовательных полях с общей площадью поверхности 2,06 мм2 , Общее количество митозов в этих 9 областях было принято в качестве МАИ.
1- Обзор изображения WSI, 2- Определенная область для подсчета митоза микроскопически, 3 — Определенная область для подсчета митоза в цифровом виде, 4 — Микроскопические снимки разных митотических фигур, 4b — Цифровые снимки разных митотических фигур.
Восприятие митотических фигур может быть более сложным при проверке WSI на одной фокальной плоскости, чем на обычных слайдах, где можно сосредоточиться на трехмерной структуре. Для этой цели и для того, чтобы получить представление о различиях во внешнем виде с использованием двух диагностических методов, митотические цифры из 15 случаев были идентифицированы под микроскопом и мгновенно сравнивались с соответствующим объектом на WSI. В цифровой форме эти митозы проявлялись как темные ядра с очень тонкими проекциями (ранняя метафаза), в плоскости с нерегулярными краями (поздняя метафаза), митозами с индивидуально рассеянными хромосомами и темными кольцеобразными формами (анафаза) или в виде отдельных параллельных тёмных сгустков (телофазы) , На рисунке 2 показаны снимки из нескольких WSI, показывающие эти различные формы реальных митотических фигур. На рисунке 3 показаны снимки из WSI, показывающие разные митозоподобные фигуры.
Эти снимки показывают различные проявления митотических фигур, окруженных зелеными кругами. Панели A-C показывают клетки в ранней метафазе. Панели D-G показывают различные формы митотического деления в поздней метафазе. Панель H-L показывает различные формы анафазы. Панели M-P показывают клетки в телофазе.
Значения MAI переносились в митотические оценки, как для оценки следующим образом: Оценка 1: 0-6 митоз / 2 мм2, Оценка 2: 7-12 митоз / 2 мм2, Оценка 3: 13 митоз или более / 2 мм2.
Следует отметить, что медленнорастущие типы опухолей, как правило, обладают достаточно высокой митотической активностью. Например, рецидивный и метастатический колоректальный рак, рак молочной железы (см. табл. 4). Причина относительно медленного роста при высокой митотической активности — высокие показатели ФКП (см. табл. 4).
Быстрорастущие опухоли могут обладать как низкой (СМТ), так и высокой (меланомы) митотической активностью (см. табл. 4). Объединяют эти типы опухолей низкие клеточные потери.
Прогноз при рецидивных и метастатических опухолях, как правило, коррелирует со скоростью роста этих опухолей (рис. 4).

Рис. 4. Трехлетняя выживаемость пациентов со вторичными опухолями различных локализаций
Как и следовало ожидать, пациенты с медленнорастущими опухолями показывают лучшие результаты выживаемости. Медиана выживаемости пациентов с рецидивным и метастатическим РМЖ — 30,5 месяцев, КРР — 13,5 месяцев. Наихудшие результаты трехлетней выживаемости обнаружились у пациентов с рецидивными и метастатическими СМТ (медиана выживаемости 4 месяца), меланомами (медиана выживаемости 7,5 месяцев).
Мы провели сравнительный анализ кинетических параметров роста пациентов с различными видами вторичных опухолей, получавших и не получавших химиотерапию. В наибольшей степени лечение цитостатиками замедляет рост рецидивного и метастатического рака молочной железы. КЭХТ для этого вида опухолей 1,66. КЭХТ для вторичных очагов КРР составил 1,18. Химиотерапевтическое лечение практически не замедляло рост этого вида опухоли. Это утверждение в целом характерно и для рецидивных и метастатических меланом (КЭХТ 1,02) и СМТ (0,42). Для ПРГШ подобных исследований не проводилось ввиду отсутствия в этой группе пациентов, получавших химиотерапию.
Таким образом, удалось доказать наличие чувствительности к цитостатикам только для рецидивных и метастатических очагов РМЖ.
Влияние структуры опухолевых очагов на прогноз заболевания и чувствительность этих очагов к химиотерапии
Как уже отмечалось выше, по своей структуре опухоли состоят из паренхимы и стромы. Кроме того, в опухоли (как правило, ближе к центру очага) встречаются зоны некрозов.
В зависимости от выраженности стромального компонента мы разделили все опухолевые очаги на три группы (табл. 5):
- с низким содержанием стромы (доля стромы в опухоли менее 20%);
- с умеренным содержанием стромы (доля стромы в опухоли от 20,1 до 40%);
- с высоким содержанием стромы (доля стромы в опухоли выше 41%).
Кинетические свойства вторичных опухолей с различным содержанием стромального компонента
| Доля стромы в опухоли | Низкая (до 20%) | Умеренная (20,1–40%) | Высокая (выше 40%) |
| ВУО, сут | 26,01±4,35 | 25,77±4,62 | 15,77±3,71 |
| МАО, % | 8,54±0,85 | 5,81±0,49 | 3,66±0,35 |
| ФКП, % | 94,17±1,82 | 93,44±1,87 | 93,35±0,96 |
Средняя МАО снижается по мере увеличения стромального компонента в опухолевых очагах. Скорость роста опухоли значительно увеличивается у рецидивных и метастатических опухолей с высоким содержанием стромы (среднее ВУО снижается с 26,01±4,35 до 15,77±3,71 сут). Средние клеточные потери остаются практически неизменными (93–94%) вне зависимости от доли стромы в опухоли.
Наихудший прогноз в отношении продолжительности жизни — у опухолей с высоким содержанием стромы (медиана выживаемости 4 месяца, средняя продолжительность жизни 10,21±2,23 месяца). Медианы выживаемости больных с умеренным и низким содержанием стромы составили соответственно 14,5 и 9,5 месяца.
Максимальная эффективность химиотерапевтического лечения (КЭХТ 2,48) была отмечена для опухолей с высокой долей стромы. Высокая эффективность при лечении цитостатиками отмечалась также в группе опухолей с умеренным содержанием стромального компонента (КЭХТ 2,07). Рецидивные и метастатические опухоли с низкой долей стромы в объеме опухоли к лечению цитостатиками, по нашим данным, практически не чувствительны (КЭХТ 0,82).
Влияние кинетических параметров роста опухоли на прогноз заболевания и эффективность химиотерапии
Нами было проанализировано, какое влияние оказывают кинетические параметры опухоли (митотическая активность, ФКП и ВУО) на прогноз заболевания, а также на эффективность лечения цитостатиками.
В зависимости от доли митотически активных клеток опухоли все клинические случаи были разделены на три группы (табл. 6):
- с низкой митотической активностью — доля митотически активных клеток до 5%;
- с умеренной митотической активностью — доля митотически активных клеток от 5,1 до 10%;
- с высокой митотической активностью — доля митотически активных клеток выше 10%.
Прогноз и эффективность лечения цитостатиками рецидивных и метастатических опухолей с разной митотической активностью
| Показатель | Митотическая активность | ||
| Низкая (0–5%) | Умеренная (5,1–10%) | Высокая (выше 10%) | |
| КЭХТ (ВУОХТ/ВУОбезХТ) | 1,43 | 1,65 | 1,46 |
| Средняя продолжительность дожития (месяцы) | 14,67±1,71 | 13,71±1,84 | 14,23±2,54 |
| Медиана выживаемости (месяцы) | 11 | 10 | 10 |
Различия в эффективности химиотерапии, рассчитанные для каждой группы, не велики. Для опухолей c умеренной митотической активностью выявлены максимальные показатели КЭХТ (1,65). Для группы рецидивных и метастатических ЗНО с низкой митотической активностью опухоли и для группы опухолей с высокой митотической активностью опухоли КЭХТ оказался ниже.
Как видно из таблицы 6, такой показатель, как МАО, практически не влияет на выживаемость пациентов. На рисунке 5 ход кривых выживаемости пациентов с рецидивными и метастатическими ЗНО с различными уровнями митотической активности практически совпадает.
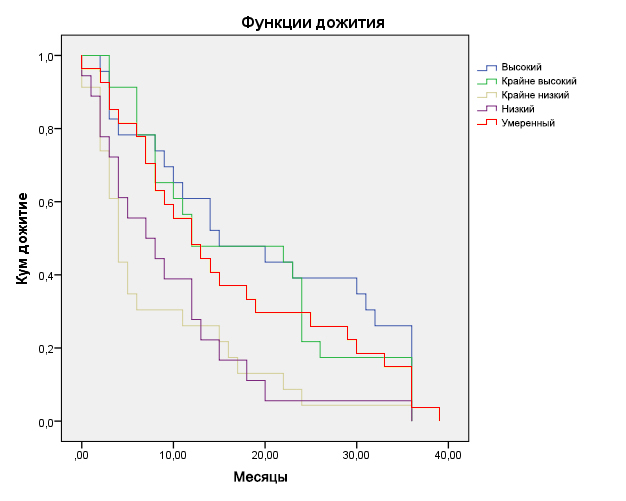
Рис. 5. Кривые выживаемости больных с рецидивными и метастатическими ЗНО с различной МАО
Была исследована также зависимость ВУО и КЭХТ от фактора клеточных потерь (ФКП). С этой целью проведена градация всего диапазона доли клеточных потерь на пять уровней (табл. 7):
- крайне низкие клеточные потери (ФКП до 90%);
- низкие клеточные потери (ФКП 90,1–95%);
- умеренные клеточные потери (ФКП 95,1–98%);
- высокие клеточные потери (ФКП 98,1–99%);
- крайне высокие клеточные потери (ФКП 99,1–99,99%).
