В.Ф. Семиглазов, В.В. Семиглазов, А.Е. Клецель, Е.К. Жильцова,
В.Г. Иванов, А.А. Божок, Р.В. Донских, С.Г. Петровский, Р.М. Палтуев,
Г.А. Дашян, К.Ю. Зернов, А.В. Ефименко, И.А. Кочетова
НИИ онкологии им. проф. Н.Н. Петрова, Санкт-Петербург, Россия
Хотя неоадъювантное системное лечение РМЖ имеет уже 15-летнюю историю, оно пока не вошло в стандарт лечения этих опухолей. Достаточно сказать, что в мире имеется лишь 6 опубликованных рандомизированных испытаний неоадъювантной химиотерапии и четыре рандомизированных испытания неоадъювантной гормонотерапии (два с участием НИИ онкологии им.проф. Н.Н.Петрова). Многие врачи, опираясь на «персональный опыт» полагают, что неоадъювантная химиотерапия эффективнее и безопаснее гормонотерапии, т.к. позволяет в относительно короткие сроки (9-12 недель) добиться заметного регресса опухоли для выполнения хирургического этапа (от мастэктомии до органосохраняющей операции в зависимости от остаточного размера опухоли).
В последние годы — в связи с большим вниманием к сохранным методам хирургического вмешательства, а также из-за накопления дополнительных данных о механизмах эстрогенозависимости РМЖ и гормонального канцерогенеза, все чаще делаются попытки проведения неоадъювантной гормонотерапии рака молочной железы, прежде всего, на основе применения антиэстрогенов и ингибиторов ароматазы. Неоадъювантная терапия рассматривается, прежде всего, как уникальная модель тестирования активности нового терапевтического подхода или как способ определения потенциального значения биологических факторов в оценке дальнейшего клинического течения и исхода заболевания. В этих случаях больные РМЖ получают лечение de novo; результаты оцениваются быстро и вся перечисленная информация получается на относительно небольшом числе пациентов и в кратчайшие сроки, исчисляемыми месяцами, а не годами (как при проведении адъювантной терапии). К преимуществам неоадъювантного лекарственного лечения относят следующие моменты: воздействие на микрометастазы; уменьшение массы опухоли и уменьшение объема выполнения оперативного этапа (до функционально выгодных и органосохранных вариантов); определение индивидуальной чувствитель-ности опухоли к использованным противоопухолевым агентам. Клиническая регрессия опухоли коррелирует со степенью терапевтического патоморфоза в опухолях и является важным прогно-стическим фактором, отражающим чувствительность опухоли к проводимой терапии. Важность данного факта состоит в том, что позволяет в случаях резистентности опухоли определить оптимальный подход в назначении адъювантного лечения. Эффективность предоперационной терапии может служить одним из критериев прогноза при местнораспространенном РМЖ. При выраженном клиническом эффекте рецидивы и метастазы возникают реже и сроки их появления удлиняются.
В НИИ онкологии с 1997 по 2004г. было проведено четыре рандомизированных испытаний неоадъювантной эндокринотерапии РМЖ. Первое из них выполнено в рамках Международного многоцентрового протокола 024 «Неоадъювантная гормонотерапия летрозолом против тамоксифена у женщин с РМЖ ЭР+/ПР+ в постменопаузе» (спонсор компания «Новартис» (Швейцария)).
Результаты исследования 024, включавшего 377 больных ЭР+ доказали что частота клинических ответов значительно выше при лечении летрозолом, в сравнении с тамоксифеном (55% против 36%; Р 2 N 1 М 0 ,T 3 N 0-1 М 0 ,Т 4 N 0 М 0 . До начала лечения у всех пациентов проведена трепан-биопсия опухоли с помощью биопсийного пистолета системы Бард-Магнум (игла 14 калибра).
Дизайн исследования и схема рандомизации представлены на рис.1.
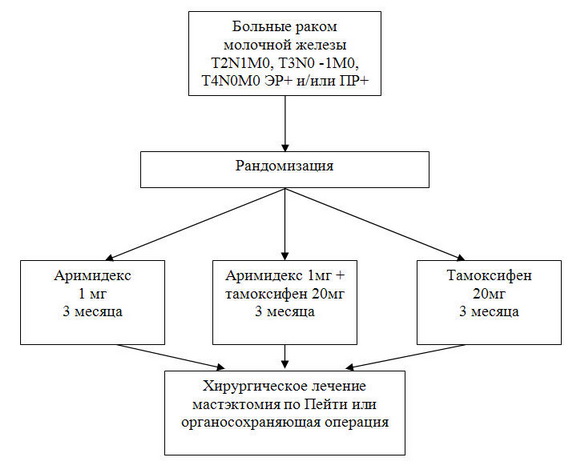
Рис. 1. Дизайн клинических испытаний неоадъювантной эндокринотерапии в НИИ онкологии им.проф. Н.Н.Петрова.
Основной целью исследования было сравнение величины объективных ответов опухоли на лечение (частичный или полный регресс опухоли) определяемый с помощью клинического метода (пальпация), рентгеномаммографии и ультразвукового исследования (до начала и после окончания неоадъювантной эндокринотерапии). Одной из целей исследования было также определение частоты выполнения органосохраняющих операций в различных лечебных группах.
Для оценки величины ответа опухоли на лечение в работе использованы стандартные критерии ВОЗ с двухмерным измерением наибольших диаметров.
Полный ответ (регресс) — 100% исчезновение опухоли
Частичный ответ — уменьшение размера на 50% и более.
Стабилизация — уменьшение размера опухоли менее чем на 50%.
Прогрессирование — увеличение размера опухоли более чем на 25%.
При клинической оценке (пальпация) полный ответ опухоли наблюдался у 13,3% больных 1-й группы (получавших лечение аримидексом), 10,3% больных 3-й группы (получавших тамоксифен) и ни разу во 2-й группе (получавших комбинированное лечение аримидексом и тамоксифеном (табл.1). Частичный ответ достоверно чаще наблюдался в группе больных, получавших один аримидекс по сравнению с леченными тамоксифеном или получавшими комбинированное лечение (тамоксифен + аримидекс) (80% против 48% против 42%, Р=0,048). При оценке лечебного эффекта с помощью маммографии объективный ответ (частичный или полный регресс опухоли) наблюдался у 55,5% больных, получавших аримидекс, 40% больных, получавших комбинированное лечение (А+Т) и 36% больных, получавших тамоксифен (Р=0,058). При изучении лечебного эффекта с помощью динамического ультразвукового исследования молочных желез объективный ответ зарегистрирован у 44% больных, получавших аримидекс, 32% больных, получавших комбинированную эндокринотерапию (А+Т) и 30% больных, получавших один тамоксифен.
При патоморфологическом изучении операционных препаратов полное исчезновение инвазивных опухолевых клеток (РСР) наблюдалось у двух больных после лечения аримидексом, одной больной — после комбинированного лечения и у одной больной — после терапии тамоксифеном.
Органосохраняющие операции (сегментарная резекция + подмышечная диссекция) были выполнены у 42% больных 1-й группы (получавших один аримидекс), у 30% больных, получавших комбинированную эндокринотерапию (А+Т) и 30% больных, получавших один тамоксифен, р=0,056.
Ответ на любой вид неоадъювантной эндокринотерапии оказался наиболее высоким и значимым при высоком уровне экспресс рецепторов эстрогенов. В работе было также показано явное уменьшение уровня рецепторов прогестерона (РП) в группе больных, получавших один аримидекс. У 14 из 30 больных получавших тамоксифен (т.е. в 46,6% случаев) после лечения не определялись рецепторы прогестерона. Средний уровень рецепторов прогестерона до лечения аримидексом достигал 106 fmol/mg, а после окончания лечения — лишь 11,3 fmol/mg. Экспрессия РП эффективно подавлялась аримидексом, но не тамоксифеном.
Любой вариант эндокринотерапии легко переносился пациентами. Наиболее частым побочным эффектом лечения оказались приливы, встретившиеся соответственно по группам в 21%, 24%, 25% случаев (р>0,5). При наблюдении за больными в течение 38 месяцев не отмечалось смертельных исходов из-за осложнений лечения.
В клиническое испытание «Неоадъювантная эндокринотерапия экземестаном (аромазином) против тамоксифена» с 1997 г по 2004 г вошли 127 больных PMЖ T 2 N 1-2 , T 3 N 0-1 , T 4 N 0 M 0 (исключая воспалительные формы РМЖ) с положительными гормональными рецепторами (ЭР+ и /или ПР+). Ежедневная доза тамоксифена 20 мг, доза экземестана — 25 мг, длительность лечения до операции — 3 месяца. Основной целью испытания была оценка величины объективного ответа опухоли (частичный и полный ответ) на проводимое предоперационное лечение, определяемая клиническим методом (пальпацией) и с помощью динамической маммографии (до начала лечения и сразу же после завершения). У всех включенных в исследование больных до начала лечения была выполнена трепан-биопсия первичной опухоли (система Бард-Магнум, трепан-игла 14-го калибра) с определением гистологического типа опухоли, содержания рецепторов эстрогенов и прогестерона иммуногистохимическим методом.
Вторичной целью исследования было определение частоты выполнения органосохраняющих операций в различных лечебных группах.
Как видно из таблицы 3 предоперационная (неоадъювантная) терапия экземестаном (аромазином) оказалась значительно более эффективной, чем лечение тамоксифеном. При клинической оценке величина общего объективного ответа опухоли на терапию аромазином оказалась почти в два раза выше, чем на лечение тамоксифеном (90.5% против 48.4%, Р=0.049). При рентгеномаммографической оценке абсолютные показатели ниже, чем при клинической оценке, но тенденция превосходства аромазина над тамоксифеном сохраняется, особенно по частоте частичного ответа опухоли (58% против 20%).
Число больных с прогрессированием заболевания во время эндокринотерапии оказалось выше в группе «тамоксифен» (10% против 3.4%, P=0.076) [табл. 4]. Важным критерием эффективности неоадъювантного лечения оказалась частота выполнения органосохраняющих операций у больных, которым до неоадъювантной эндокринотерапии планировалась радикальная мастэктомия. После завершения предоперационного лечения органосохраняющие операции (сегментарная резекция, квадрантэктомия + подмышечная диссекция) выполнены у 31,6% больных, получавших лечение экземестаном, и у 13.3% больных, леченных тамоксифеном (Р=0.048).
Таблица 3. Клиническая оценка величины ответа опухоли на неоадъювантную эндокринотерапию экземестаном (аромазином) против тамоксифена у постменопаузальных больных РМЖ с ЭР+/ПР+ опухолями (НИИ онкологии им. проф. Н.Н.Петрова, 1997-2004)

Хирургическая резекция остается ведущим методом лечения пациенток с ранними стадиями рака молочной железы (РМЖ). Последние исследования показали, что системная противоопухолевая терапия, проводящаяся в адъювантном или неоадъювантном режиме, обеспечивает равные преимущества с точки зрения выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) для этой категории пациенток. У неоадъювантной терапии есть свои преимущества и недостатки, поэтому адекватный отбор пациенток имеет решающее значение для оптимизации онкологических и косметических результатов лечения.
Ограничения
Неоадъювантная ХТ обычно не рекомендуется пациенткам с I стадией РМЖ. Результаты патогистологического исследования хирургически удаленной опухоли зачастую имеют первостепенное значение для принятия решений о необходимости ХТ в принципе и определяют выбор цитостатиков.
Фокальность опухоли может влиять на перспективы проведения органосохраняющей операции после неоадъювантной ХТ, снижая шансы с 71,6% при монофокальном росте опухоли до 58,5% при мультифокальном и 30% при мультицентрическом. Уровень достижения пПО также может незначительно отличаться в зависимости от фокальности: 19,4% при монофокальном, 16,5% при мультифокальном и 14,4% при мультицентрическом РМЖ. Пациентки с мультицентрическими опухолями могут уступать больным с монофокальным РМЖ по уровню ВБП (р 05.03.2020 Онкологія та гематологія Терапія та сімейна медицина 8th Ocular Oncology Day: украинская онкоофтальмология в контексте европейской наук
Приуроченная к 60-летию Итальянского онкоцентра конференция, проходившая 6-7 декабря 2019 года в г. Сиена (Италия), была посвящена проблеме злокачественных новообразований глаза.
В настоящее время растет интерес к мультипараметрической магнитно-резонансной томографии (МРТ) как методу диагностики клинически значимого рака предстательной железы (РПЖ), применяемому после получения отрицательных результатов первой биопсии [1]. Как альтернативный подход рассматривается выполнение мультипараметрической МРТ до биопсии у тех пациентов, кому она показана по стандартным критериям [2, 3].
Рак є однією з провідних причин захворюваності та смертності в усьому світі. Популяційні дані вказують, що частота новоутворень продовжує зростати й у 2035 р. сягне 24 млн випадків.
В последнее время в мире ежегодно выявляют более 2,1 млн случаев легочного рака, т.е. за 100 лет заболеваемость возросла более чем в 14 тысяч раз. Сегодня рак легкого как у мужчин, так и у женщин является одной из наиболее распространенных форм злокачественных опухолей с плохим прогнозом и высокой смертностью. Каждый пятый онкологический пациент умирает от рака легкого. Всего регистрируют 1,7 млн смертей в год.
