
Рак яичников – злокачественное заболевание, занимающее пятое место по распространенности среди женщин. Поражает болезнь преимущественно пациенток в возрасте 45-60 лет, хотя среди клиенток онкологических клиник все чаще встречаются молодые пациентки. Смертельных исходов на долю этой болезни приходится больше, чем на другие патологии женской репродуктивной системы.
Начало болезни чаще всего протекает бессимптомно, лишь у 1/3 части больных заболевание диагностируется на начальном этапе. В остальных случаях болезнь обнаруживается, когда появляются первые признаки, что означает переход болезни на более позднюю стадию. Но у онкологических патологий успех лечения зависит от вовремя распознанного заболевания и своевременно начатого лечения. Однако диагностика рака яичника на начальном этапе сопряжена с некоторыми трудностями и требует и от пациента, и от врача максимум внимания.
Лечение при раке яичников
Тактика лечения составляется, учитывая возраст пациентки, стадию болезни, а также пожелания относительно лечения. К основным методам лечения относятся:
Хирургическое вмешательство
Основным и наиболее эффективным способом лечения является операция, радикальность которой зависит от стадии болезни. При опухоли небольшого размера и отсутствия метастазов возможно проведение малоинвазивного органосохраняющего хирургического вмешательства. На поздней стадии показана полостная операция с удалением яичников, матки, сальника и всех очагов метастазирования. Все большее применение находят радиохирургические методы лечения. Современные технологии позволяют проводить такие манипуляции, при которых побочные эффекты сведены к минимуму. Применение высокотехнологичной и сверхточной аппаратуры дает возможность воздействовать на клетки опухоли, не нанося вреда здоровым окружающим тканям. Но преимущества этого способа очевидны: безболезненность во время процедуры, отсутствие анестезии, бескровность метода, минимальный период реабилитации и др.
Химиотерапия
Химиотерапия применяется после радикального удаления злокачественного образования для предотвращения распространения метастазов и возможного рецидива. При частичном удалении органа химиотерапия показана для замедления размножения злокачественных клеток. Использование лекарственной терапии перед хирургическим вмешательством позволяет добиться лучшего результата, а также сократить объем опухоли. При паллиативном лечении химиотерапия рекомендована для облегчения страданий пациентки, а также в целях увеличения продолжительности жизни.
Лучевая терапия
- Лучевая терапия при раке яичников в настоящее время применяется сравнительно редко. Ее назначение рекомендовано при рецидивирующем раке, не отвечающем на хирургическое и химиотерапевтическое лечение. Кроме того, в запущенных случаях назначается проведение паллиативной радиотерапии, цель которой – уменьшение болевых ощущений и улучшение качества жизни.
- При рецидивах лучевая терапия при раке яичников применяется в сочетании с химиотерапией – для увеличения эффективности лечения в течение максимально возможного периода. В отдельных случаях такая тактика оправдывает себя на протяжении нескольких лет.
- В тех случаях, когда рецидивирующая опухоль удалена хирургическим путем, назначение облучения рекомендовано для уничтожения оставшихся после оперативного лечения опухолевых клеток.
- При распространении злокачественного образования на органы брюшной полости, а также при асците, лучевую терапию нужно назначать с огромной осторожностью во избежание повреждения органов.
Несмотря на широкий диапазон применения лучевой терапии, дать четкие рекомендации по применению этого перспективного метода лечения затруднительно, поскольку опухоли яичника отличаются обширным метастазированием с вовлечением в злокачественный процесс всех отделов брюшной полости, разнообразием гистологических типов, в результате чего клиническое течение болезни отличается значительной вариабельностью.
Тактика лечения разрабатывается строго индивидуально. При назначении лучевой терапии, хирургического вмешательства и химиотерапии следует учитывать стадию болезни, гистологический тип опухоли, а также целый ряд других прогностических факторов.
В России традиционно лучевая терапия при распространенном раке яичников применяется как дополнительный метод лечения пациенток с опухолями, не ответившими на химиотерапию. У больных с частичным эффектом от химиотерапии лучевая терапия также дает возможность улучшить результаты лечения. Данный метод может быть полезен и для паллиативного лечения инкурабельных больных с большими тазовыми опухолями или отдаленными метастазами.
Сегодня схема лечения РЯ подбирается индивидуально с учетом основных прогностических факторов. Наиболее важны три независимых показателя. На их основе предлагается распределять больных в группы риска:
стадия заболевания
степень дифференцировки опухоли
объем остаточной опухоли
Основываясь на этих независимых факторах можно выделить 3 прогностические группы:
с низким риском (Low Risk) I стадия и высокодифференцированная опухоль
промежуточным (Intermediate Risk) I и II стадии, дифференцировка опухоли G2 и G3; IIIа стадия и высокодифференцированная опухоль
высоким риском (High Risk) II стадия с низкодифференцированной опухолью и III, IV стадии
После циторедуктивных операций у больных, входящих в группу высокого риска, проводят 6-8 курсов полихимиотерапии. В группах промежуточного и высокого риска нередко применяется мультимодальная тактика лечения. После стандартного числа курсов химиотерапии эффект оценивается повторно, и определяются группы больных для возможного облучения области таза или всей брюшной полости. Кроме того, рассматривается вопрос об интраперитонеальном введении радиоактивных препаратов (золота или фосфора).
В некоторых зарубежных клиниках внутрибрюшное введение радиоактивных изотопов преимущественно применяется после радикальных операций у больных раком яичников I-III стадий, при размерах остаточной опухоли до 2 см. Этот метод позволяет добиться равномерного облучения брюшной полости с хорошими результатами, но действие препарата ограничивается глубиной воздействия на опухоль от 1,5 до 3 мм. Этот метод не пригоден при метастазах в лимфатических узлах. Кроме того, больший процент осложнений (спаечная болезнь, кишечная непроходимость и некрозы стенки кишки) не позволяет применять его широко.
Показания:
локальная остаточная опухоль или метастатически измененные лимфатические узлы у больных РЯ II – IV стадий, дифференцировка опухоли G2- G3 после стандартного комбинированного лечения (операция + 6 и более курсов химиотерапии);
рецидивы РЯ после повторных циторедуктивных операций или химиотерапии.
Противопоказания: тяжелое соматическое состояние больной, связанное с сопутствующими заболеваниями или генерализацией основного заболевания.
Эффективность лучевой терапии при лечении рецидивов РЯ такая же, как при лечении первичной опухоли, и зависит от размеров опухоли и толерантности окружающих тканей. При лучевой терапии первичных и рецидивных образований возможно применять как методики облучения всего живота, так и отдельных областей.
Способы подведения доз при наружном облучении всей брюшной полости
Хорошо исследованы 2 способа:
Техника движущихся полос (Moving Strip Technique). Имеет ряд недостатков:
возможен перенос опухолевых клеток из необлученной области в область, получившую предварительное лечение, т.к. часть объема какое-то время не облучается
возможно суммирование доз в области подвижных органов (тонкий и толстый кишечник), что может увеличить процент поздних осложнений этих органов
Техника открытых полей. Наиболее популярна сегодня, т.к. позволяет лечить весь объем ежедневно, включая всю брюшину, парааортальные лимфатические узлы, мезентериальные, поддиафрагмальную область и таз
Предлагается определять верхнюю границу поля для лучевой терапии на 1-2 см выше купола диафрагмы, нижнюю – основанием запирательных отверстий, латеральные – на 1-2 см cнаружи от боковых границ живота. При дополнительном облучении таза (тазовый буст) используют 4-х польную методику, технику переднезадних полей или ротационные методы.
При планировании облучения всего живота должны соблюдаться общие принципы:
использовать открытые поля, позволяющие адекватно охватывать всю брюшную полость
использовать параллельные встречные поля, позволяющие уменьшать дозу с помощью блоков на области с высоким риском тяжелых осложнений
применять высоко энергетическое фотонное излучение с вариацией доз в объеме не более 5%
суммарная доза на живот должна составлять 22,5-30Гр, разовая 1-1,5Гр. Тазовые поля следует уменьшать, дополнительно подводя на таз дозы до 45-50Гр при 1,8-2Гр за фракцию
рутинное использование парааортального буста не рекомендуется, т.к. процент осложнений увеличивается
блок на печень нужно ставить так, чтобы правая часть диафрагмы получала полную дозу 30Гр
с помощью блоков и экранов ограничивать дозу на почки до 18-20Гр
Есть мнение, что при осуществлении основных методик облучения (открытые поля и методика движущихся полос), при процедуре экранирования почек и печени, используемой во многих центрах, создается неравномерное распределение дозы облучения по брюшной полости.
Для равномерного распределения дозы в объеме живота, предложена техника шестипольного облучения (представлена Эйнхорном и соавторами в 1986 году).
Рисунок 2. Общая схема лечения по Einhorn. Границы полей облучения по шестипольной методике (прямая проекция)
Лечение осуществляется в 3 этапа:
облучение всей брюшной полости проводится с двух противолежащих полей, с ежедневной дозой 1,2 Гр, суммарной – 20Гр (16 фракций)
размеры полей уменьшают: верхняя граница поля – диск L3– L4, нижняя остается на уровне запирательных отверстий. Разовая доза – 1,6Гр, суммарная – 20Гр (12 фракций) подводится с двух встречных переднезадних полей.
применяют то же фракционирование (1,6Гр/20Гр за 12 фракций), но дозу подводят с двух боковых полей на область от верхней границы брюшины до середины L3, соблюдая расстояние приблизительно 1 см от предыдущего нижнего поля. Это расстояние признано адекватным с учетом расхождения пучков. Задняя граница облучаемого объема проходит по телам позвонков, передняя – по передней поверхности живота.
Рисунок 3.
Рисунок 4. Третья фаза лечения а) границы поля облучения верхней части живота [боковая проекция], б) распределение поглощенной дозы в верхней части живота [поперечный срез])
Общее время лечения – 8 недель, 80% верхней части живота и таз облучали СОД 40Гр, а 20% верхней части живота (задние отделы брюшной полости, 2/3 почек, 1/2 печени) – 20Гр.
Возможные осложнения лучевой терапии
повышение температуры
потеря веса
тошнота, рвота
диарея
общая слабость, анемия
лейкопения
тромбоцитопения
базальные пневмониты
Радиоиндуцированный нефрит – известное осложнение при дозах облучения, превышающих 23 Гр на область почек. Биохимические доказательства дисфункции печени – повышение щелочной фосфатазы, сывороточных трансаминаз и лактатдегидрогеназы, наблюдается у 25-50% пациенток, однако клиническое развитие гепатита, как и нефрита, встречается достаточно редко (менее 1%) при соответствующей защите печени и почек. В целом, токсичность брюшно-тазового облучения более тяжелая после химиотерапии, чем при самостоятельном применении метода.
Эффект после ЛТ должен быть оценен через месяц, во время лечения часто повышается уровень СА-125, который снижается только через 2-3 месяца после окончания лечения.
Лучевая терапия при раке яичников
Лучевая терапия – (2-0Й по значимости метод в онкологии) свои позиции при лечении РАК ЯИЧНИКОВ сдала.
Практиковавшееся в 70-80-х годах прошлого века облучение полости таза и живота (Wholе Abdominopelvic Radiation – WAR”) после радикальных операций по поводу ранних раков или циторедуктивных операций при III стадии 90-х годов отставлено, из-за лучшего контроля абдоминальных реЦИД\1ВОВ с помощью химиотерапии. Например, Hreschhshyn et al показали, что рецидивы после адъювантного применения мелфалана (не самого активного препарата), в брюшной полости возникали у 3% женщин, а после WAR- в26%.
Большое исследование, проведенное Северо-Западной Онкологической Группой на больных la-Ib стадиях с G3, а также на больных II стадии показало, что послеоперационная адъювантная химиотерапия (цисплатин+ циклофосфан – 6 циклов – не лучшая по современным меркам схема) привела к безрецидивной пятилетней выживаемости в 74% случаев, а WAR (43,2 Gy на таз и 30 Gy на живот за 24 фракции) обеспечила безрецидивную выживаемость лишь в 50% (Sell, ] 990). Не доказан и консолидационный эффект WAR после успешной химиотерапии и применения этой методики у больных в IY стадии или с рецидивами болезни (Pinover, 2003).
Облучение сохраняет позиции в качестве терапии, облегчающей симптомы рецидивной опухоли.
Метод может также применяться для контроля метастазов, в головном мозге и некоторых других зонах, резистентных к химиотерапии. Симптоматический эффект отмечается у 70% больных (дозы варьируют от 20 до 44 Gy) Corn 1994.
Прекращено также внутрибрюшинное введение рЗ2 при РАК ЯИЧНИКОВ I и II стадии, а также после Secol1d Look лапаротомии из-за неконкурентности с химиотерапией и в связи с высоким процентом желудочно-кишечных осложнений. Pinover, 2003.
Более 95% больных РАК ЯИЧНИКОВ нуждаются в проведении лекарственной терапии.
Она выполняется всем радикально оперированным пациентам, за исключением менструирующих со стадией lа, G-l. Химиотерапия обязательна после циторедуктивных операций, она пока еще главный метод лечения больных, у которых можно выполнить лишь паллиативную операцию, применяется также при рецидивах болезни.
Различают адъювантную химиотерапию, индукционную терапию 1 -ой линии, консолидационную, поддерживающую, неоадъювантную, терапию 2-0Й и 3-ей линий при рецидивах или резистентных опухолях.
Список химиопрепаратов с выявленной противоопухолевой эффективностью в режиме монотерапии при РАК ЯИЧНИКОВ довольно значительный. Он дает возможность врачам широко маневрировать, главным образом, при 2-0Й и последующих линиях терапии, на заключительном этапе жизни заболевших. Рассмотрим эту информацию по группам.
1. Платиновые производные – цисплатин (ООР), карбоплатин (СВОСА), оксалиплатин (Оха) в режиме монотерапии эффективны в диапазоне 2030%. Карбоплатин из этой группы вошел в комбинацию 1 -ой линии при адъювантной и индукционной терапии. Оксалиплатин меньше изучен и, возможно, сохраняет шансы перейти в 1-ую линию. Цисплатин сдал свои позиции в адъювантной терапии и 1-ой линии индукционной терапии, но остается важным препаратом для лечения платиновочувствительных рецидивов (о чем позднее).
2. Прочие алкилирующие препараты мелфалан, циклофосфан, ифосфамид, хлорамбуцил, тиотэф, гексаметилмеламин (алтретамин) эффективны в диапазоне 15-40%. Мелфалан и хлорамбуцил имеют в настоящее время лишь историческое значение в терапии РАК ЯИЧНИКОВ, они использовались в 70-х и начале 80-х годов прошлого века. Циклофосфан при первой линии терапии РАК ЯИЧНИКОВ сдал свои позиции таксанам и антрациклинам, но достаточно высокая его активность в режиме монотерапии (40%) и дешевизна определяют его включение в режимы 1-0Й линии у больных с тяжелым материальным положением. Ифосфамид применяется при рецидивах РАК ЯИЧНИКОВ. Тиотэф назначается редко, пациентам с исчерпанными химиотерапевтическими возможностями. Пероральный препарат алтретамин, удобный для применения, используется во 2-0Й линии в режиме монотерапии или в комбинациях.
3. Антиметаболиты фторурацил, УФТ, гемцитабин обладают эффективностью в режиме монотерапии в пределах 13-20%. Из этой группы лишь Gem активно используется при 2-0Й линии терапии в комбинации с СВОСА, эффект от этой схемы регистрируется в 47,2%, в сравнительной группе от монотерапии карбоплатином – 30,9%, время до прогрессирования соответственно – 8,6 мес и 5,8 мес. Pfisterer, 2004. Перспективы имеет капецитабин, его активность выявлена в 29% при РАК ЯИЧНИКОВ резистентном и чувствительном к платиновым производным.
4. Противоопухолевые антибиотики доксорубицин, липосомальный доксорубицин, эпирубицин, близкий к ним митоксантрон, митомицин эффективны в режиме монотерапии в 23-33%. Доксорубицин в комбинации с платиновыми производными используется в 1-0Й и 2-0Й линиях терапии. Эпирубицин назначается пожилым больным во 2-0Й линии терапии. Митомицин С И митоксантрон могут включаться в режимы последующих линий терапии. Место липосомального доксорубицина в терапии РАК ЯИЧНИКОВ еще не определено, известно, что он обладает меньшей кардиотоксичностью.
5. Антитрубочковые препараты паклитаксел (Тах), доцетаксел (Txt), винорелбин(VгЬ)- важные компоненты лекарственной терапии. Их активность в режиме монотерапии от 20 до 35%. Паклитаксел включен в состав комбинаций в адъювантных и индукционных режимах. Доцетаксел альтернативный компонент в комбинациях скарбоплатином. Винорелбин используется при лечении платиноворезистентных опухолей.
6. Ингибиторы топоизомеразы топотекан, иринотекан, этопозид, эффективны в режиме монотерапии в диапазоне 16-26%. Эти препараты назначаются в комбинациях при ранних возвратах болезни после индукционной химиотерапии с платиновыми производными или у больных с IV стадией в качестве 2-0Й и 3-ей линий терапии. .
• _ Принято консенсусом специалистов, занимающихся проблемой лечения РАК ЯИЧНИКОВ, правило – больным с Ia и Ib стадиями с дифференцировкой G 1 (кроме тех, у кого светлоклеточный рак) не следует проводить после операции адъювантную химиотерапию. Рецидивы болезни в этих подгруппах возникают менее чем в 5% случаев (Ozols, 2005).
Во всех остальных случаях раннего рака lа и lЬ G-2 и G-3, а также при П стадии и светлоклеточном раке Ia и в прочих стадиях, независимо от грейда, выполняется адъювантная терапия, поскольку рецидивы при этих стадиях и грейдах могут возникнуть в 30-40%.
В 90-х годах прошлого века считалось, что адъювантная химиотерапия мелфаланом и некоторые другие режимы, имеющие сейчас лишь историческое значение, способны отсрочить развитие рецидивов болезни, но не в состоянии обеспечить достоверное увеличение медианы выживаемости.
Знаковыми и весьма важными являются сравнительно недавние исследования больших кооперированных групп.
GOG(Гинекологическая Онкологическая Группа) осуществила сравнение эффективности 3 и 6 циклов комбинации паклитаксел (175 мг/м 2 ) + карбоплатин (AUC 7,5) на 457 больных с ранним РАК ЯИЧНИКОВ. Хотя число местных рецидивов в группе получавшей 3 курса терапии было на 8% выше, чем в группе, где пациенты получали 6 циклов терапии, трехлетняя выживаемость в обеих группах составила 88%. Достоверно большая токсичность была зарегистрирована после 6 циклов (нейро-, миелотоксичность, анемия). GOG приняла решение считать стандартом адъювантной терапии 3 цикла Тах + CBDCA, Young, 2000.
Два больших исследования завершены в 2003 году группами ICON (Международное Сотрудничество по Овариальным Новообразованиям) и ACTION (Адъювантная Химиотерапия Овариальных Новообразований). Каждое из исследований проведено на более чем 400 больных. Все больные рандомизировались после радикальных операций по поводу la,B; а-2-3, Ic, Па на группу, получавшую 3 цикла терапии Тах + CBDCA или группу наблюдения. Результаты этих исследований были близкими и потому они суммированы в сообщении Trimbos в 2003 году. Безрецидивная выживаемость при наблюдении> 46 месяцев достигнута в группе с адъювантной терапией в 76%, в группе наблюдения в 65%. Разница в 11 % достоверная (Р=0,008). Общая выживаемость составила соответственно 82% и 74%, разница в 8% достоверна (р=О,ОО 1). Споры возникли лишь о значении оптимальной редукции «0,5 см размер оставшейся опухоли). Высказываются предположения, что для таких больных адъювантная химиотерапия не нужна.
- ·Теперь об индукционной терапии – обязательном компоненте комплексного лечения РАК ЯИЧНИКОВ IП и IV стадий после оптимальной и cубоптимальной циторедукции опухолевых проявлений.
Не было ясности, какому из платиновых производных отдать предпочтение в комбинации с паклитакселом. GOG и европейская группа AGO осуществили сравнение эффективности комбинаций Тах + CBDCA и Тах + DDP. От l-ой комбинации медиана общей выживаемости составила 54 месяца, от второй – 48,7. Относительный риск смерти в группе с CBDCA по сравнению с группой DDP составил 0,84. Кроме того, комбинация Тах +DDP была хуже переносимой. Гастроинтестинальная токсичность IV ст чаще регистрировалась после DDP, нейротоксичность фиксировалась с одинаковой частотой. Ozols, 2002; du Bois, 2003.
Смятения возникли после публикации небольшого исследования группы ICON, в котором сравнивалась эффективность карбоплатина и карбоплатина + таксол. Не было замечено разницы в общей выживаемости. Ozols, 2005. Другими исследованиями ОУ-I0 и GOG 138 эти факты не подтверждены.
В США общепринята установка – 1-0Й линией индукционной терапии
РАК ЯИЧНИКОВ является комбинация Тах (\75 мг/м 2 ) + CBDCA (AUC 7,5). В Европе дозу CBDCA уменьшают (AUC 5-6) Указанный( режим обеспечивает полную ремиссию у больных с оптимальной редукцией опухоли в 95% и с субоптимальной редукцией в 50%. При этом у большинства пациенток рецидив наступает через 38-48 месяцев. Это обстоятельство является причиной продолжающихся поисков альтернативных режимов.
Vasey (2004) обобщил материалы сравнения эффективности индукционной терапии Tax+CBDCA и Txt+CBDCA. При одинаковой выживаемости больных в обеих группах отмечена большая миелотоксичность у получавших Txt и большая нейротоксичность у получавших Тах.
Сравнивался эффект дуплетной комбинации Тах + CBDCA (ТС) и триплетной Tax+EPI+CBDCA (ТЕС). Добавление эпирубицина прибавило токсичности и не улучшило показатели выживаемости. (Kristensen, 2003).
Апробируются новые режимы: TCG (таксол+карбоплатин+гемцитабин); таксол + карбоплатин + липосомальный доксорубицин; карбоплатин + топотекан 4 курса, затем карбоплатин + паклитаксел 4 курса; карбоплатин + гемцитабин 4 курса, затем карбоплатин + паклитаксел 4 курса. Итоги этих исследований ожидаются к концу 2005 года.
В нашей стране продолжается применение в индукционных режимах комбинаций карбоплатин + циклофосфан, цисплатин + циклофосфан, цисплатин + доксорубицин + циклофосфан, карбоплатин + доксорубицин.
- ·У больных с полной ремиссией делались попытки улучшить отдаленную выживаемость с помощью консолидационных методов. Использовал ась высокодозная химиотерапия с трансплантацией стволовых клеток, облучение живота и таза, применение внутриперитонеальной терапии. Пока следует признать, что ни один из упомянутых методов консолидации не улучшил выживаемость больных после циторедукции и индукционной терапии.
В качестве поддерживающей терапии после достижения полной ремиссии применялись итальянскими исследователями паклитаксел 6-12 дополнительных циклов. Изучалось значение топотекана, а также вакцины против Ca-125. При всех этих исследованиях не удалось улучшить ни общую, ни безрецидивную выживаемость.
- ·GOG оценила замену внутривенной индукции комбинированным применением тех же препаратов внутривенно и внутрибрюшинно. Больные делились на 2 группы: l-ую, в которой индукция вызывалась в/в введением DDP (75 мг/м 2 ) и Тах (135 мг/м 2 ) 24-часовая инфузия, и 2-ую, в которой больные получали паклитаксел 135 г/м 2 в/в в 1 день,
60 мг/м 2 внутрибрюшинно В 8-0Й день, DDP 100 мг/м 2 внутрибрюшинно во 2-0Й день. Почти 20% больных с внутрибрюшинным введением препаратов не закончили запланированный режим из-за тяжелой гастро- и миелотоксичности. Хотя риск рецидива сократился до 0,73 в группе с внутри брюшинным введением, выживаемость в обеих группах не различалась. Ozols, 2005.
В совместном исследовании нескольких международных групп SWOGGOG-ECOG по применению для индукционной терапии Ctx 600 мг/м 2 внутривенно и DDP 100 мг/м 2 внутрибрюшинно удалось увеличить общую выживаемость в группе с в/б введением до 44 мес., в то время как в в/в контроле медиана общей выживаемости составила 41 месяц. Результаты этих исследований не были подтверждены. Ozols, 2005 .
- ·Несмотрак яичников не агрессивность хирургии и индукционной терапии, приводящих большинство больных к полной ремиссии, рецидив болезни неотвратим, разнятся лишь сроки его возникновения. Возможны несколько ситуаций:
а) Рефрактерные пациентки к платиновым индукционным комбинациям прогрессируют в течение 1-3 месяцев с момента начала химиотерапии.
б) Резистентные больные к платиновым препаратам прогрессируют в сроки от 3 до 6 месяцев.
в) Умеренночувствительные больные к платиновым комбинациям прогрессируют в сроки от 6 месяцев до года.
г) Высокочувствительные к платиновым комбинациям пациенты прогрессируют спустя год и позже, после индукции.
Больные с рефрактерными и резистентными к платиновым индукционным комбинациям в среднем живут 6-7 месяцев, одна треть выживает менее 4 месяцев, одна четвертая – более года. 40% удается провести 2 линию лекарственной терапии. Больные с рефрактерными опухолями отвечают на химиотерапию лишь в 7%. У пациентов с резистентными опухолями удается добиться объективного эффекта в 10-25%, полные эффекты достигаются крайне редко. Могут при меняться для лечения этих подгрупп больных следующие препараты: доцетаксел (эфф. 35%, ремиссия 5 мес.), алтретамин (эфф. 40%, ремиссия 8 мес.), этопозид внутрь (эфф. 26%), оксалиплатин (эфф. 6%), доксорубицин липосомальный (эфф. 25%, ремиссия 5,7 мес., медиана выживаемости 11 мес.), паклитаксел (в еженедельном режиме эфф. 20%, ремиссия 4,7 мес., медиана выживаемости – 12,4 мес.), винорелбин (эфф. 21%), топотекан (эфф. 14-16%, ремиссия – 8,9 мес., медиана выживаемости – 10 мес.), гемцитабин (эфф. 13%), ифосфамид (эфф. 12%), тамоксифен (эфф. 13%). Тюляндин с.А., 2004.
Обычно комбинации химиопрепаратов этим подгруппам пациентов не назначаются. Довлеет задача не ухудшить качество короткой, оставшейся жизни.
- ·Больные с умеренной и высокой чувствительностью к платиновым индукционным комбинациям отвечают на возобновление терапии в прак яичниковмой зависимости от продолжительности благополучия после окончания начальной терапии. Пациентки, у которых рецидив болезни возник через 2 года, отвечают на терапию карбоплатином или карбоплатином и паклитакселом в 80% случаев.
Нет полной ясности, что предпочтительней – монотерапия карбоплатином или комбинации платиновых производных с паклитакселом, с доцетакселом или гемцитабином. Parmar 2003 г. считает, что комбинация CBDCA + Gem улучшает выживаемость свободную от прогрессирования по сравнению с монотерапией. Возможно применение неплатиновых комбинаций, особенно если ремиссия после индукционной терапии продолжалась от 6 мес. до 1 года.
Следующие комбинации могут применяться при 2-0Й линии терапии у чувствительных к платиновым производным:
Топотекан 1,0 Mг/M 2 1-З дни + карбоплатин АUС-5 д.l
TAX 175 мг/м2 д.1 +DDP 50мг/м2 д.1 + Top 0.6мг/м2 1-5 дни
DDP 50 мг/м 2 д.1 + Top 0.75 мг/м 2 1-5 дни
DDP 50 мг/м 2 Д.1 + Gem 1 1г/M 2 1 и 8 дни
Оха 1ЗОмг/м 2 д.1 +ТХ!75 мг/м 2 д.1
Gem 700 Mг/M 2 1 и 8 дни + липосомальный доксорубицин 30 мг/м 2 д.l, каждые 4 недели.
Особняком выглядит группа больных с персистирующим РАК ЯИЧНИКОВ. ( относят пациентов, ответивших частичной ремиссией на индукционную терапию. у них остаются макроопухоли и повышенный уровень СА-1 таком случае пытаются продлить индукцию (до 12 циклов) или применить консолидационную терапию, о которой выше упоминалось или в крайнем случае перейти на неплатиновые комбинации.
Примыкают к этой категории пациенты запрогрессировавшие через тельные сроки после индукционной терапии. Причем, 1-ым и единственным симптомом у них является повышение Са-125. В этом случае, памятуя важной цели химиотерапии при рецидивах болезни – сохранение качества жизни, возможно отсроченное назначение противоопухолевых лекарств при подъеме уровня маркера до 80-100 Е/мл. Имеет право на существование другая точка зрения – начинать лекарственную терапию при повышении уровня более 30 Е/мл.
Исторически лучевая терапия использовалась как самостоятельный метод лечения рака яичника, совместно с хирургическим методом при рецидивах, и иногда в качестве предоперационного мероприятия. В отдельных случаях лучевая терапия назначалась после операции пациенткам, у которых не наблюдалось распространения опухоли за пределы тазовой области. Применялись две основные схемы лучевой терапии.
По первой схеме (для пациенток в I и II стадии заболевания) проводилось облучение области таза в переднезаднем направлении, или с использованием нескольких полей облучения, обычно в дозе 40-50 Гр на протяжении 4-4,5 недель. По второй схеме проводилось тотальное облучение брюшной полости. Технически эта схема более трудновыполнима, поскольку приходится облучать очень большой объем туловища.
При облучении, включающем поддиафрагменную область, объем облучаемого участка простирается от основания таза до купола диафрагмы. Обычно мощность дозы невелика (порядка 1 Гр в день), поскольку у пациенток не должны наблюдаться такие последствия, как тошнота и подавление миелопоэза. Особенно неблагоприятными оказываются последствия после проведения химиотерапии: часто у пациенток развивается нефрит и гепатит. При облучении в дозе 15-20 Гр экранируется область почек и печени.

Доза радиации, приходящаяся на неэкранированный участок, не должна превышать 25 Гр. При ежедневном облучении обычный курс радиотерапии продолжается в течение 5 недель. При этом доза, приходящаяся на область таза, может достигать 40-50 Гр.
Ретроспективные исследования, проведенные на пациентках с опухолью в I стадии, леченных только хирургическим методом и с последующей радиотерапией, имеют один недостаток: подборка групп не дает возможности корректно сравнить полученные результаты. Во многих подобных исследованиях состояние пациенток в группе, получившей после операции сеанс радиотерапии, было гораздо хуже, чем в группе оперированных без последующей лучевой терапии.
Это позволяет заключить, что пациентки первой группы характеризуются повышенной степенью риска, возможно, из-за разрыва кисты или в силу каких-то других причин. Пятилетняя выживаемость для группы пациенток с опухолью на I стадии развития варьировала от 50% до 65% и не зависела от назначения им после операции курса лучевой терапии.
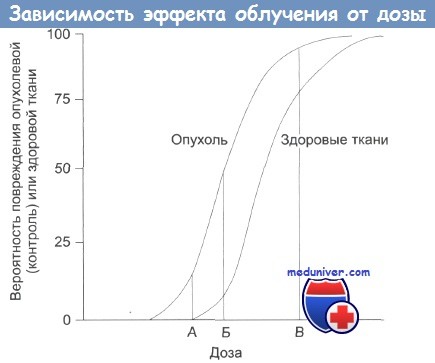
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
Начинают появляться результаты сравнения между группами оперированных пациенток и получавших курс лучевой терапии после операции, однако четких различий выявить пока не удалось.
Постоперативное облучение тазовой области у пациенток с опухолью на II стадии развития оказалось эффективным, хотя в таких случаях сейчас обычно используется химиотерапия. Почти во всех группах отмечалось увеличение 5-летней выживаемости, особенно если операция была проведена адекватным методом. Поскольку эти исследования проводились до того времени, как установление стадии развития опухоли превратилось в обязательный элемент первичного обследования, у многих пациенток фактически могла быть III стадия заболевания.
На более поздних стадиях (III—IV) эффективность назначения лучевой терапии после операции кажется сомнительной. Хотя имеются отдельные сообщения об увеличении 5-летней выживаемости пациенток с 5% до 10% после проведения операции и дополнительного облучения, они относятся ко времени, когда еще не были известны эффективные противоопухолевые препараты. Исследования, проведенные в Торонто в 1970-е годы, возобновили интерес к лучевой терапии рака яичников. Было продемонстрировано увеличение выживаемости пациенток с опухолью в стадии Па-Ш, получивших курс лучевой терапии брюшно-тазовой области.
Лечебный эффект проявлялся даже несмотря на то, что столь большая область была облучена в достаточно низкой дозе. Результаты этих исследований, несомненно, отражают адекватность выбранного хирургического метода, причем больший лечебный эффект отмечался у пациенток, у которых после операции не пальпировались уплотнения в области живота, независимо от дальнейшего назначения хи-мио- или радиотерапии. Не вызывает сомнений, что тактика сокращения размера опухоли при первичной операции и, смотря по показаниям, после курса химиотерапии, снижает значимость облучения таза или брюшной полости как терапевтической процедуры.
Более того, частота случаев развития непроходимости кишечника за счет рецидивов опухоли после облучения брюшной полости увеличивается.
Альтернативной формой радиотерапии является внутриб-рюшинное введение радиоактивного коллоидного золота (Au 198 ) или радиоактивного фосфора (Р 32 ). Первоначально метод применяли в лечении диссеминированного рака, однако сейчас для этой цели используется системная химиотерапия.
