
Что такое гипертермия?
Гипертермия (повышенная температура) – это вспомогательный метод, применяемый при лечении больных с онкологическими и неонкологическими заболеваниями.
В онкологической практике гипертермию проводят при температурах 41-45 °С с целью улучшения результатов лучевой-, химио- и/или гормонотерапии. Механизм её действия заключается в торможении восстановления клеток опухоли от повреждений, полученных после лучевой и лекарственной терапии.
Нагревание осуществляется с помощью специальных аппаратов, генерирующих электромагнитные (ЭМ) излучения различных диапазонов волн.
Когда применяется гипертермия?
В онкологии гипертермия применяется в тех случаях, когда необходимо усилить действие лучевой, химио- и гормонотерапии, особенно если известно, что опухоль является устойчивой к таким видам лечения. Наиболее широко используется при лечении рецидивных опухолей или метастазов, которые, как правило, являются устойчивыми к любым видам противоопухолевой терапии.
В некоторых случаях, при противопоказаниях к лучевой или химиотерапии, гипертермия проводится в самостоятельном виде для повышения качества жизни больных: снятия болевых симптомов и улучшения общего самочувствия.
В неонкологической практике гипертермия применяется при лечении хронических неспецифических воспалительных заболевании (бронхит, пародонтит, простатит и др.), поздних лучевых фиброзов.
Методы гипертермии
Существуют следующие способы гипертермии:
- Наружная локальная гипертермия – нагревание только опухоли.
- Наружная регионарная гипертермия – нагревание органа с опухолью и регионарными лимфоузлами.
- Внутриполостная гипертермия – нагревание опухолей полых органов (прямая кишка, пищевод) с помощью специальных внутриполостных аппликаторов (излучателей).
- Общая гипертермия – нагревание всего тела человека, используется при обширных метастатических процессах.
Оборудование, используемое для гипертермии
Основными установками, которые используются в настоящее время для проведения лечебного нагрева, являются аппараты, генерирующие ЭМ-поле в СВЧ-, УВЧ- или ВЧ-диапазоне. Выбор методики и аппарата зависит от глубины залегания опухоли, её конфигурации и размера. В зависимости от этих параметров подбирается установка с определенной частотой излучения и длиной волны.
Противопоказания к проведению лучевой терапии
- острые соматические (заболевания внутренних органов) и инфекционные заболевания;
- соматические заболевания в стадии декомпенсации;
- тяжелые заболевания центральной нервной системы и психические расстройства (эпилепсия, шизофрения и т.п.);
- прорастание опухолью крупных сосудов или её распад, угроза кровотечения из облучаемой области;
- анемия, лейкопения, тромбоцитопения;
- раковая кахексия (истощение организма);
- выраженный синдром опухолевой интоксикации.
Как проводится лечение в онкологии?
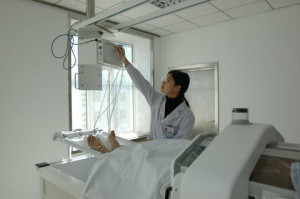
Перед лечением выполняются необходимые исследования (рентгенография, УЗИ, компьютерная томография, магнитно-резонансная томография и др.), с помощью которых определяется точное месторасположение новообразования. На основании имеющихся данных принимается решение о способе лечения больного: выбор аппарата и аппликатора. Врач обязательно рассказывает пациенту о планируемом лечении, риске возникновения побочных эффектов и мерах по их профилактике. Врач выбирает план лечения пациента: методику гипертермии, количество сеансов и сочетание с другими методами лечения (по согласованию с другими специалистами). Процедура гипертермии проводится в течение 60-150 мин и завершается непосредственно перед лучевой терапией В случае комбинации её с химиотерапией нагрев осуществляется во время или сразу после завершения введения химиопрепаратов.
Наружная (локо-регионарная) гипертермия проводится на кушетке в удобном для больного положении. В случае лечения рака прямой кишки внутриполостной аппликатор вводится в просвет опухоли. Температура в опухоли контролируется введенными в нее 1-2 термодатчиками, или она вычисляется расчетным методом по специальной программе. Во время нагревания кожа или слизистая оболочка охлаждается водой (10-30 °С), циркулирующей в аппликаторе. Поэтому больной во время сеанса гипертермии чувствует только тепло разной степени выраженности и может даже читать или слушать музыку.
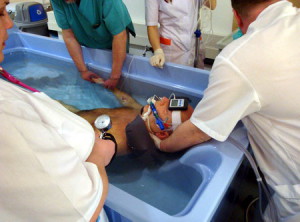
Общая гипертермия проводится на гипертермической установке «Яхта-5» под общим наркозом. Контроль температуры осуществляется в прямой кишке, при необходимости в пищеводе. Голова больного во время процедуры охлаждается с помощью холодного воздуха от специального аппарата. Курс лечения состоит из 2-4 процедур, проводимых 1 раз в 3-6 недель в комбинации с химиотерапией. Технически общая гипертермия осуществляется одинаково при всех локализациях опухолей, различие заключается в интенсивности и продолжительности нагревания, а также в количестве процедур и интервалов времени между сеансами, которое зависит от общего состояния пациента.
Как проводится лечение неонкологических больных?
При лечении неонкологических больных, по сравнению с онкологическими, применяется более низкий температурный режим (39-40 °С) и более короткое воздействие (15-40 мин). С другой стороны, это лечение схоже с физиотерапией, где также используется ЭМ-излучение. Отличие состоит в том, что при физиотерапии уровень нагрева в воспалительном участке весьма слабый, не превышает 37,5-38 °С (в основном греется кожа). Поэтому лечебный эффект при физиотерапии связан со специфическим воздействием ЭМ-поля и меньше всего – тепловым эффектом. При гипертермии лечебный эффект в основном связан с воздействием тепла.
Побочные эффекты гипертермии
Побочные эффекты наблюдаются при лечении только онкологических больных из-за необходимости поддержания высокой температуры в опухоли (41-45 °С) и продолжительностью воздействия.
Тел. Колл-центра +7 495 – 150 – 11 — 22
Позвоните нам сегодня, чтобы мы смогли Вам помочь!
Гипертермия теперь включена в Руководство по клинической практике NCCN для лечения рецидивов рака молочной железы. Доктор Аркадий Бессантин (Израиль, Тель-Авив) успешно использует эту современную методику при лечении пациентов с раком груди.
Цель этого обзора — представить проведенные в последние десятилетия клинические испытания применения гипертермии в сочетании с лучевой терапией и / или химиотерапией для лечения рака молочной железы. Данная статья подробно освещает основные принципы NCCN, которые теперь включают применение гипертермии для клинического лечения рецидивирующих поражений кожи при раке молочной железы, поддерживая потенциальную положительную роль гипертермии в локальном контроле за рецидивами опухоли.
Гипертермия — перегревание, накопление избыточного тепла в организме человека и животных с повышением температуры тела, вызванное внешними факторами, затрудняющими теплоотдачу во внешнюю среду или увеличивающими поступление тепла извне. (Википедия)
Введение

Рак молочной железы является одним из наиболее распространенных видов рака и представляет собой серьезную проблему, поскольку каждый год число случаев заболевания этим недугом увеличивается. Хотя в настоящее время возможно раннее выявление рака молочной железы, у 30% пациентов на ранней стадии заболевания вероятней всего последуют дальнейшие рецидивы. Лечение пациентов с локально распространенным раком молочной железы состоит из химиотерапии, сопровождаемой радикальной мастэктомией (это операция, связанная с полной или частичной ампутацией груди) и лучевой терапией, а в некоторых случаях и гормональной терапией. Несмотря на то, что эта комбинированная терапия — пока оптимальный выбор с точки зрения местного контроля над опухолью, для лучшего клинического результата все еще необходимо подбирать новые методы лечения.
В соответствии с принципами Национальной антиоксидантной сети 2013 года (NCCN) гипертермия включена в клиническую практику для лечения рецидивов рака молочной железы. Целью гипертермии является повышение температуры опухоли до 42-45 ° C. Существуют различные методы применения гипертермии в зависимости от расположения опухоли. Для опухолей с глубиной менее 5 см при раке молочной железы, в основном используется поверхностная гипертермия. Поверхностная гипертермия в сочетании с лучевой терапией и / или химиотерапией оказалась эффективней, чем отдельно лучевая терапия или химиотерапия, так как механизмы действия лучевой терапии и гипертермии дополняют друг друга. Кроме того, правильное клиническое применение гипертермии имеет большое значение, поскольку термические параметры, такие как минимальная или максимальная температура опухоли во время термотерапии, влияют на клинический результат лечения.
Все испытания, включенные в этот обзор, были получены из Medline (сокращение от MEDlars onLINE MEDLARS (MEDical Literature Analysis and Retrieval System) — самая крупная база данных опубликованной медицинской информации в мире, которая охватывает около 75 процентов всех мировых изданий.) и были опубликованы с 1987 года по настоящее время.
Данные испытания демонстрируют, как гипертермия в сочетании с лучевой терапией и / или химиотерапией влияет на пациентов, страдающих раком молочной железы, и изучают преимущества этого комбинированного лечения. Данные, полученные в каждом исследовании, показывают количество пациентов с первичным заболеванием или с рецидивом рака молочной железы и терапевтические методы, используемые для их лечения. Основными оцениваемыми параметрами являются скорость ответа на терапию, полные и частичные коэффициенты ответа, местный контроль за опухолью и показатели выживаемости. Наконец, рассматривается токсичность, вызванная гипертермией.
Результаты и обсуждение

Первые клинические результаты сравнительных исследований терморадиотерапии (RTHT) по сравнению с лучевой терапией при поверхностных опухолях были опубликованы до 1990 года. В 1987 году были опубликованы результаты исследования, в котором пациенты с поверхностными рецидивирующими злокачественными опухолями получали низкую дозу лучевой терапии с локальной гипертермией или без нее (915 или 2450 МГц). Большинство опухолей (53%) являлись аденокарциномой молочной железы. Полная, а также частичная частота ответа на лечение была выше в группе комбинированной терапии, что свидетельствует о том, что гипертермия в сочетании с низкой дозой излучения может быть полезна при лечении поверхностных рецидивов опухоли, особенно в случаях, когда более высокие дозы лучевой терапии применялись ранее. При лечении токсичность воздействия 3-го класса (десквамация (т.е. слущивание клеток с поверхности) с пузырьками / влажная десквамация) была соответственно 21,2 и 4,2%, токсичность 4-го класса (малый некроз (отмирание) или изъязвление / массивное изъязвление) 24,2 и 8,3% соответственно. Некроз подкожной жировой ткани (4 степень) был зарегистрирован у 3 пациентов и 1 пациента соответственно.
Было проведено исследование, которое также доказало эффективность комбинированного лечения: 35 пациентов с рецидивами карциномы молочной железы получали гипертермию в дополнение к лучевой терапии, которая проводилась в течение 30 мин после облучения. Сравнение между 9 пациентами, которые получили только лучевую терапию и 9 пациентами, которые получали РТТ, показало, что частота ответа на лечение составила 33,3% (3/9) и 77,7% (7/9) соответственно. Гипертермия переносилась организмом без серьезных осложнений.
Группой по радиационной онко-терапии (RTOG), для оценки гипертермии лечения поверхностных опухолей ( включая рак молочной железы), в рандомизированном исследовании была установлена корреляция (взаимозависимость) между диаметром опухоли и частотой ответа: результаты исследования показали улучшение ответа, особенно при поражениях диаметром менее 3 см, получивших более 2 гипертермических процедур (42,5 ° C). Частота поддержания стойкого ответа в течение 12 месяцев была выше у пациентов, получавших РТНТ, чем у тех, кто получал только лучевую терапию. Эти данные показывают, что добавление гипертермии дает более длительный и полный ответ на лечение.
Гипертермия в сочетании с лучевой терапией для прогрессирующей или локально рецидивирующей карциномы молочной железы: исследования были проведены у 40 пациентов (10 первичных случаев заболевания и 30 рецидивов). Было решено, что пациенты с меньшими поражениями получат только лучевую терапию, а пациенты с большими поражениями получат РТТ. Опухоли, в отношении которых применялась гипертермия, лучше ответили на терапию, чем новообразования, которые получали лишь лучевую терапию.Также сообщалось, что пациенты с первичными опухолями, которые получали облучение, имели низкий уровень полного и частичного ответа и местного контроля над опухолью, тогда как эти показатели увеличивались с добавлением гипертермии. При рецидивирующих опухолях после операции, частота локального ответа на лечение после лучевой терапии также увеличивалась с добавлением гипертермии. Был сделан вывод о том, что комбинированное лечение дает улучшенный клинический результат у пациентов, страдающих локальным первичным и рецидивирующим раком молочной железы.В исследованиях также отмечено, что имеет значение и размер опухоли. Гипертермия в поверхностных опухолях более эффективна, когда диаметр поражения составляет менее 3 см.
Одно из крупнейших исследований для оценки эффективности гипертермии было опубликовано в 1996 году: всего в этот анализ было включено 306 поражений. Результаты были получены в результате 5 разных рандомизированных исследований в области лечения рака молочной железы с RTHT (фаза III).Исследования доказали, что гипертермия дает преимущество при добавлении к лучевой терапии в основном при рецидивирующем раке молочной железы, где из-за предыдущей лучевой терапии рекомендовано использовать более низкие дозы облучения. Общий полный коэффициент ответа на лечение составлял 59% для RTHT и 41% для лучевой терапии.
Исследование для определения взаимосвязи между тепловыми параметрами гипертермии и результатом лечения у пациентов, страдающих рецидивирующим раком груди: было проведено сравнение ответа на лечение у пациентов, которые получали РТТТ и у пациентов, которые получали только лучевую терапию. Общий коэффициент ответа составил 61 и 41% соответственно. В рандомизированном исследовании оценивали роль тепловой дозы при лечении поверхностных поражений, включая рак молочной железы. Исследователей интересовал ответ на лечение и продолжительность местного контроля. Пациенты были разделены на 2 группы. Первую группу лечили только лучевой терапией, а вторую группу — РТТ. Полный коэффициент ответа на терапию и местный контрольный показатель улучшились с добавлением гипертермии. Наибольшее улучшение местного контроля наблюдалось у пациентов, которые уже получали лучевую терапию при предыдущем лечении.
Исследование 2008 года: это исследование включало пациентов из 8 различных медицинских учреждений. У всех них была рецидивирующая карцинома молочной железы и все они получали повторное облучение молочной железы после локального рецидива. Часть пациентов получала гипотермию в дополнение к лучевой терапии. Полная частота ответа на лечение составила 67% — с применением гипотермии и 39% — без нее.
Проверка эффективности гипертермии, как паллиативного лечения локально рекуррентной карциномы молочной железы:30 пациентов с раком молочной железы после лечения другими традиционными методами, получили низкую дозу облучения + 1 час гипертермии. Результаты подтвердили влияние гипертермии на уменьшение рецидивов рака молочной железы. Кроме того, поражения с диаметром менее 5 см лучше отвечали на комбинированное лечение.
Доказано, что RTHT обеспечивает улучшение местного контроля за опухолью при лечении рецидивирующего рака молочной железы:34 пациента получили РТТ, у 4 пациентов была химиотерапия в комплексе с гипертермией, а у 4 пациентов была только гипертермия. Было отмечено, что только те пациенты, которые получили РТТТ, полностью ответили на терапию и показали улучшение местного контроля над заболеваниями.44 пациента, страдающие локально рекуррентной аденокарциномой молочной железы, получали RTHT. Частоту ответов на лечение анализировали через 1 месяц после завершения терапии. Через 12 месяцев 67% пациентов, которые достигли полного ответа, все еще сохраняли положительную динамику. Было обнаружено, что размер опухоли значительно влияет на клинический результат.
Применение гипертермии в сочетании с лучевой терапией для лечения рецидивов карциномы молочной железы с метастазами: Чтобы оценить результативность лечения, провели исследование с участием 20 пациентов. Большинство пациентов (95%) полностью ответили на комбинированное лечение, которое было эффективным в случае обширных диффузных повреждений при раке молочной железы. Однако средняя выживаемость этих пациентов была неудовлетворительной из-за наличия метастаз вне обработанных областей.
Применение поверхностного RTHT у пациентов с рецидивирующей карциномой груди: Во время максимальной регрессии полная частота ответа составляла 63%. Выживаемость через 2,5 года составила 21%, а через 5 лет — 8%. В Нидерландах RTHT является стандартным методом лечения ранее облученных пациентов, у которых случился рецидив рака молочной железы. Исследования показали, что одновременное применение гипертермии и облучения дает лучший клинический результат, чем последовательное применение. Этот метод применили у пациентов с поверхностными опухолями. Рассматривались преимущественно случаи онкологических заболеваний головы и шеи, а также аденокарцинома груди. Реакция на терапию при аденокарциноме груди была такова: полный ответ — 79%, частичный ответ — 14% и отсутствие ответа на лечение — 7%.
Исследование эффективности комбинирования химиотерапии с RTHT у пациентов с неоперабельным рецидивирующим раком молочной железы: Химиотерапию и гипертермию пациенты получали один раз в неделю, через 30 мин после облучения. Кожная реакция была приемлемой, но тройная модальность вызвала значительную системную токсичность. Хотя частота ответа на терапию была высокой, местный контроль поддерживался лишь в течение нескольких месяцев.
Исследования для локально рекуррентного рака молочной железы: В этом случае локальный контроль достигается в зависимости от многих параметров комбинированного лечения, включая опухолевый ответ на RTHT. 39 женщин с рецидивами рака груди получили РТНТ, при этом гипертермия проводилась перед лучевой терапией. 1-летняя выживаемость составила 71%, а выживаемость через 2 года составила 54%. В 2001 году был опубликован опыт Медицинской школы Афинского Университета, в котором применялась комбинированная терапия RTHT для лечения поверхностных опухолей. В это исследование были включены 88 пациентов с раком молочной железы с рецидивами после мастэктомии, и 27 пациентов с рецидивирующими надключичными лимфатическими узлами. Полная частота ответов на лечение составила 85,2 и 70,4% соответственно. Одна и та же команда ученых спустя 1 год опубликовала первое исследование об эффективности липосомального доксорубицина в сочетании с RTHT. Было зарегистрировано 15 женщин-пациентов, которые страдали от локально распространенного рецидивирующего рака молочной железы. Все пациенты ответили на терапии. Полная частота ответа составляла 20%, а доля частичного ответа — 80%. Бен-Йосеф и другие ученые признали преимущества гипертермии при добавлении к лучевой терапии и описали свой опыт применения RTHT для лечения локально рецидивирующего рака молочной железы. 15 женщин получили лучевую терапию в сочетании с 45 минутами гипертермии (при 45 0C). 6 из 15 пациентов полностью ответили на терапию, 4 пациента ответили частично, а 3 пациента не ответили на терапию.
Применение RTHT у пациентов с локально-рецидивирующим карциномой молочной железы: 41 поражение из 75 было подвержено облучению ранее. Было доказано, что гипертермия в сочетании с лучевой терапией имеет более выраженный клинический эффект. Изъязвление кожи отмечалось у 14% пациентов.
Применении к локально развитому или рецидивирующему раку молочной железы с маргинальной резекцией (краевое иссечение): В этом исследовании 15 пациентов были разделены на 2 группы. Первая группа получала RTHT после резекции в качестве первичной терапии, а вторая группа состояла из пациентов с рецидивирующими опухолями, которые также подвергались такой же процедуре лечения — гипертермии в сочетании с лучевой терапией.Общая выживаемость составила 90% для первой группы и 89% для второй группы, местные контрольные показатели были соответственно 75 и 81%, в то время как безрецидивная выживаемость составила 64 и 69% соответственно. Что касается всех пациентов, то показатели выживаемости, местного контроля и безрецидивной выживаемости составили 89, 80 и 68% соответственно.
Опыт применения гипертермии в сочетании с лучевой терапией для поверхностных рецидивов опухоли: В этом исследовании эффективность RTHT оценивалась у пациентов с рецидивом заболевания, ранее получавших облучение. После 18-месячного наблюдения местный контрольный показатель составил 72,7%, стабилизирование заболевания 20,5%, а не контрольная — 6,8%.
Эффективность повторного облучения в сочетании с гипертермией – исследование 2010 года: 78 пациентов с рецидивами рака молочной железы ответили на комбинированную терапию. 3-летний контрольный показатель составил 78%, а 5-летний контрольный показатель — 65%. 3-и 5-летняя выживаемость пациентов составила 66 и 49% соответственно.Был рассмотрен случай 66-летней женщины с рецидивирующим раком молочной железы, которая получила лучевую терапию и химиотерапию, но не ответила на лечение. Однако, когда к терапии была добавлена гипертермия, пациентка полностью ответила на лечение.Наконец, комбинированное лечение RTHT может дать хороший результат без серьезной токсичности. RTHT применялся у 198 пациентов, страдающих рецидивами рака молочной железы. 3-летний контрольный показатель составил 83%, а 5-летний контрольный показатель составил 78%.
Результаты и вывод

Результаты показывают, что использование гипертермии в комплексе с лучевой терапии и / или химиотерапией для лечения рака молочной железы увеличивает эффективность лечения.
Применение гипертермии в лечении рака груди

Рак груди является одним из наиболее распространенных видов рака и представляет собой серьезную проблему, поскольку каждый год число случаев заболевания этим недугом увеличивается. Хотя в настоящее время возможно раннее выявление рака молочной железы, у 30% пациентов на ранней стадии заболевания вероятней всего следуют дальнейшие рецидивы и рак груди возвращается. Лечение пациентов с локально распространенным раком молочной железы состоит из химиотерапии, сопровождаемой радикальной мастэктомией (это операция, связанная с полной или частичной ампутацией груди) и лучевой терапией, а в некоторых случаях и гормональной терапией. Несмотря на то, что эта комбинированная терапия — пока оптимальный выбор с точки зрения местного контроля над опухолью, для лучшего клинического результата все еще необходимо подбирать новые методы лечения.
В соответствии с принципами Национальной антиоксидантной сети 2013 года (NCCN) гипертермия включена в клиническую практику для лечения рецидивов рака молочной железы.
Гипертермия — это перегревание, накопление избыточного тепла в организме человека с повышением температуры тела, вызванное внешними факторами, затрудняющими теплоотдачу во внешнюю среду или увеличивающими поступление тепла извне. (текст из Википедии).
Доктор Аркадий Бессантин (Израиль, Тель-Авив) успешно использует современную методику RTHT при лечении пациентов, которым поставлен диагноз — рак груди.
Целью гипертермии является повышение температуры опухоли до 42-45 ° C. Существуют различные методы применения гипертермии в зависимости от расположения опухоли.
Для опухолей с глубиной менее 5 см при раке молочной железы, в основном используется поверхностная гипертермия. Поверхностная гипертермия в сочетании с лучевой терапией и / или химиотерапией оказалась эффективней, чем отдельно лучевая терапия или химиотерапия, так как механизмы действия лучевой терапии и гипертермии дополняют друг друга. Кроме того, правильное клиническое применение гипертермии имеет большое значение, поскольку термические параметры, такие как минимальная или максимальная температура опухоли во время термотерапии, влияют на клинический результат лечения.
Результаты многочисленных исследований показывают, что использование гипертермии в комплексе с лучевой терапии и / или химиотерапией для лечения рака молочной железы значительно увеличивает эффективность лечения. Применение гипертермии в сочетании с другими терапевтическими методами является перспективным направлением в лечении рецидивирующего рака молочной железы.
Помимо включения гипертермии в недавние рекомендации NCCN для лечения рецидивов рака молочной железы, мы предлагаем использовать RTHT для лечения других кожных новообразований и первичных поражений при раке молочной железы.
Терапевтическая гипертермия является типом лечения, при котором живые ткани подвергаются воздействию повышенной температуры. И это оказывает губительный эффект на раковые клетки, вызывающий их уничтожение, или снижает устойчивость этих клеток к воздействию радиоактивного лечения или препаратов химиотерапии. Стоит отметить, что температурное воздействие на атипичные ткани не относится к группе радиочастотной абляции, это совершенно иная методика. В сочетании с лучевой терапией метод теплового воздействия носит называние терморадиотерапия.
Гипертермия в онкологии: что это такое?
Международная онкология не выработала до сих пор общего мнения относительно того, какие показатели температуры являются самыми безопасными и одновременно самыми эффективными. Во время лечения температура тела, как правило, достигает уровня между 39,5 и 40,5 ° C. Тем не менее, другие исследователи определяют границы гипертермии между 41.8-42 ° C, что присуще для стран Европы и США. Япония и Россия принимают самые высокие показатели — 43-44 ° С.
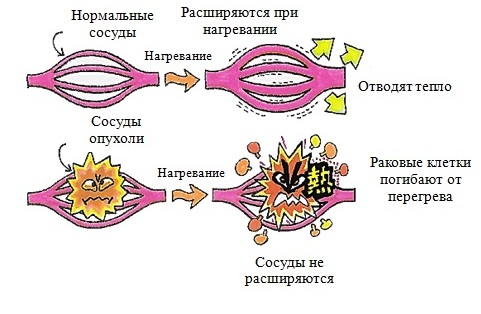
Температура и время воздействия взаимосвязаны. Более длительная продолжительность и высокие температуры очень эффективны для уничтожения раковых клеток, но они также достаточно серьезно повышают риск токсичности. Опухолевые клетки с дезорганизованной и компактной сосудистой структурой очень тяжело отводят тепло, что способствует стимуляции апоптоза (вид физиологически запрограммированной гибели клеток) в их отношении или обычной гибели. Тогда как здоровые ткани обладают лучшей теплопроводностью, в связи с чем лучше противостоят высоким температурам.
Даже если раковые клетки не гибнут сразу, они могут стать более восприимчивы к ионизирующему излучению в противораковой терапии или химиотерапии. Тепло при локальной гипертермии расширяет кровеносные сосуды опухоли, способствуя повышению оксигенации (насыщению кислородом) новообразования, тем самым делая лучевую противораковую терапию более эффективной. Кислород является мощным радиосенсибилизатором, что значительно повышает эффективность заданной дозы излучения путем формирования ДНК-повреждений. Опухолевые клетки при недостатке кислорода могут быть в 2-3 раза более устойчивы к радиационному повреждению, чем в нормальной кислородной среде.
Гипертермия, как было доказано, весьма эффективна в сочетании с химиотерапией. Опубликованные исследования показали улучшение 10-летней выживаемости без рецидивов и метастазов у пациентов, страдавших раком мочевого пузыря, которые получали комбинированное лечение гипертермией и химиотерапией. 53 % пациентов прожили 10 последующих лет, в то время как химиотерапия в единственном варианте обеспечила выживаемость только у 15 % заболевших.
Интенсивный нагрев вызывает денатурацию и коагуляцию клеточных белков, что быстро уничтожает клетки опухоли. Более длительный умеренный нагрев до температуры всего в несколько градусов выше нормы может вызвать более тонкие структурные изменения в клетках. Мягкая термообработка в сочетании с другими способами может привести к гибели клеток по причине стимуляции биологического разрушения.
Из минусов специалисты отмечают многие биохимические последствия теплового шока в нормальных клетках, в том числе замедление роста и повышенной чувствительности к последующей ионизирующей радиоактивной терапии.
Гипертермия увеличивает приток крови к нагретой области, что может провоцировать удвоение кровотока в опухолях. Такой феномен повышает положительное воздействие химиотерапевтических средств в патологических областях.
Мягкая гипертермия, которая обеспечивает температуру, равную естественно высокой при многих инфекционных заболеваниях, может стимулировать естественные иммунологические атаки на опухоли. Однако это также индуцирует естественный физиологический ответ под названием термотолерантность, который имеет тенденцию защищать атипичные клетки.
Очень высокие температуры, выше 50 ° C, используются для абляции — прямого уничтожения некоторых опухолей. Методика использует вставки в виде металлической трубки непосредственно в опухоль, наконечник которой нагревается, это и вызывает гибель клеток по его периметру.
Стоит подчеркнуть, что методика гипертермической абляции в России пока что в стадии изучения, и в практической медицине применяется редко. Однако эффективность испытаний прогнозирует весьма неплохие перспективы этого метода, в том числе и в нашей стране.
Отличия и особенности методов локальной, регионарной и общей гипертермии
Методы терапевтической гипертермии применяются, как правило, в трех вариантах, в зависимости от показаний и лечебных возможностей.
- Локальная гипертермия
Нагревается очень маленькая площадь, как правило, в рамках самой опухоли. В некоторых случаях цель метода заключается в гибели атипичных клеток путем нагревания, не повреждая окружающие ткани. Тепло может быть стимулировано с помощью:
- ультракоротких волн;
- высоких радиочастот;
- ультразвуковой энергии;
- с использованием магнитной гипертермии.
В зависимости от локализации опухоли, тепло может быть применено к поверхности тела, внутри тканей или глубжележащих областей за счет использования игл или зондов. Одним из относительно распространенных типов является радиочастотная абляция небольших опухолей. Терапевтической цели легче всего достичь, когда опухоль находится на поверхности тела (поверхностная гипертермия), или если существует возможность ввода игл или зондов непосредственно в опухоль (интерстициальная гипертермия).
- Регионарная гипертермия
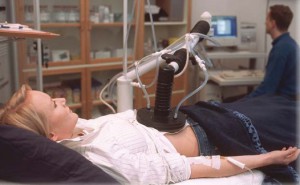
Нагревается большая площадь тела, например, целый орган или конечность. Как правило, цель метода состоит в ослаблении раковых клеток таким образом, чтобы достичь их гибели последующим радиоактивным излучением или действием химиотерапевтических препаратов. Как и в предыдущем методе, регионарная гипертермия может использовать те же поверхностные или интерстициальные методы или опираться на перфузию крови. Во время процесса перфузии кровь пациента удаляется из организма, нагревается и возвращается в кровеносные сосуды, которые ведут непосредственно в нужную часть тела. Как правило, химиотерапевтические препараты применяются одновременно.
Одним из специализированных типов такого подхода является непрерывная перитонеальная перфузия, которая используется для лечения сложных новообразований внутри брюшной полости, в том числе первичной мезотелиомы брюшной полости и рака желудка. Горячие химиотерапевтические препараты закачивают непосредственно в брюшную полость, чтобы убить раковые клетки.
- Общая гипертермия
Нагревается весь организм до температуры от 39 до 43 °С и выше. Метод, как правило, используется для лечения метастатического рака. Включает в себя использование инфракрасных гипертермических куполов, под которые помещается все тело пациента, за исключением головы. К другим способам можно отнести помещение пациента в очень горячую камеру или укутывание в нагретые влажные одеяла. Из редких методов используют специальные гидрокостюмы с постоянным подогревом или погружение в горячий воск.
Для каких видов рака может применяться гипертермия?
В одиночку гипертермия продемонстрировала уникальную способность терапии злокачественных новообразований. Также известно, что методика значительно увеличивает эффективность других методов лечения.
В сочетании с радиоактивным излучением гипертермия особенно эффективна в присутствии большого количества кислорода при условии одновременного воздействия не менее, чем в течение часа.
В последние десять лет гипертермия в сочетании с облучением была использована с лечебной целью у больных со следующими диагнозами:
- ранняя стадия рака молочной железы;
- при локализации рака на голове и шее;
- рак простаты.
Известные научные издания свидетельствуют об улучшении у 38 % пациентов при раке мочевого пузыря в сочетании с химиотерапией, по сравнению с применением только химиотерапии. У больных раком молочной железы результат показал улучшенную реакцию у 18 % пациентов.
Какие существуют еще типы рака, которые показывают значительное улучшение при лечении гипертермией?
- Меланома и рак кожи.
- Саркома мягких тканей.
- Рак мочевого пузыря.
- Рак шейки матки.
- Рак прямой кишки.
- Злокачественные опухоли подмышечной области и грудной стенки.
- Метастазы в лимфоузлах.
Исследования в России показали интересные результаты с высокой гипертермией в 43,5-44°C, когда метод применяли в отношении:
- рака пищевода;
- рака гортани;
- рака печени;
- при ВИЧ-инфекции и расстройствах иммунной системы.
Абляция опухолей — одна из разновидностей гипертермии
Радиочастотная абляция (РЧА), вероятно, наиболее часто используемая разновидность локальной гипертермии. Для повышения температуры применяются радиоволны высокой частоты.

- Тонкий игольчатый зонд вводится в опухоль на короткое время, как правило, от 10 до 30 минут.
- Размещение зонда регулируется с помощью ультразвука, МРТ или КТ.
- Наконечник зонда выдает высокочастотный ток, который способен создать тепло между 40 и 60°С, что вызывает гибель клеток в пределах определенной области.
- Мертвые клетки не удаляются, становятся рубцовой тканью и рассасываются с течением времени.
РЧА наиболее часто используется для лечения опухолей, которые не могут быть удалены хирургическим способом, или у пациентов, которые по разным причинам не операбельны. Процедура может быть выполнена амбулаторно. Повторения абляции возможно для опухолей, способных к рецидивам. Также РЧА может быть добавлена к другим лечебным мероприятиям, в том числе оперативному удалению новообразования, лучевой терапии, химиотерапии, инфузионной терапии, алкогольной абляции или химиоэмболизации.
РЧА может быть использована для лечения опухолей, достигших в диаметре вплоть до 5 см. Методика наиболее эффективна для лечения образований в печени, почках и легких. В настоящее время изучается ее применение в других областях тела. Долгосрочная эффективность после лечения гипертермической абляцией пока не известна, но первые результаты обнадеживают.
Возможные осложнения и побочные эффекты гипертермии
Применение высоких температур может привести к ожогам тканей, повреждению органа-мишени, особенно в случаях регионарного лечения. Степень поражений будет варьироваться в зависимости от времени воздействия, температуры и вида тканей. Самыми чувствительными к этому методу являются ткани головного мозга и легких.
- Отек.
- Образование тромбов.
- Внутренние кровотечения.
- Сердечно-сосудистые нарушения.
Сочетаемость с радиоактивным облучением или химиотерапией обладает достаточно сильной токсичностью, что выражается, как правило, через несколько часов после процедуры и может вызывать порой довольно тяжелые расстройства.
