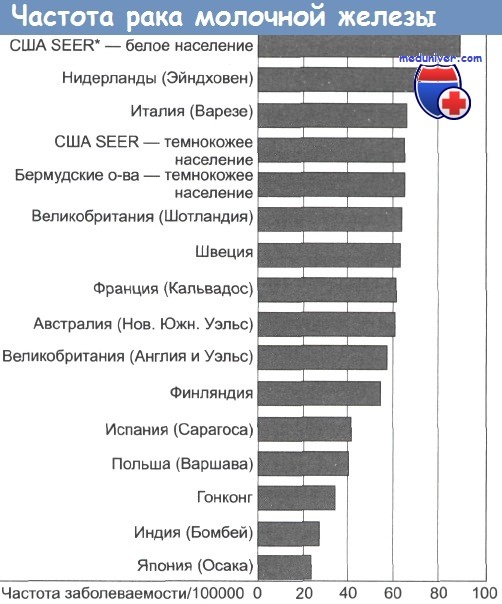
Рак молочной железы является наиболее распространенным женским онкозаболеванием. Ежегодно в Великобритании диагносцируется почти 40 000 новых случаев заболевания этим раком, а в США — 143 000 случаев. За последние 50 лет частота заболеваемости раком молочной железы постепенно увеличилась, причем отмечаются существенные различия в географическом распространении. В развитых странах Запада этот рак распространен в гораздо большей степени, чем в развивающихся странах.
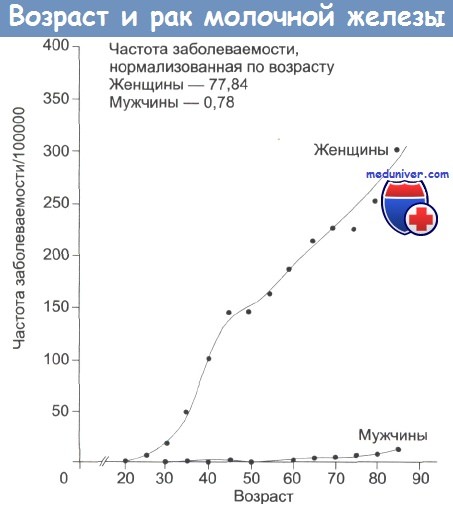
На рисунке ниже представлена заболеваемость раком молочной железы в зависимости от возраста. В среднем, у одной из десяти женщин в течение жизни развивается рак молочной железы, что делает эту болезнь основной причиной смерти от онкозаболеваний среди женщин Запада. Этот вид рака настолько распространен в Великобритании, что примерно половина всех раковых пациенток больны раком молочной железы.
Известен ряд этиологических факторов, предрасполагающих к развитию рака молочной железы. Так, риск заболевания оказывается в три раза выше у женщин, ближайшие родственники которых болели этим раком. Особенно высокая степень риска отмечена для дочерей тех женщин, у которых в период пременопаузы был диагносцирован рак молочной железы. Для них вероятность заболевания увеличивается в 3-11 раз. Женщины, впервые родившие ребенка в возрасте свыше 30 лет, почти в три раза чаще заболевают раком молочной железы, чем женщины, родившие в возрасте до 20 лет.
Степень риска возрастает также для тех женщин, у которых в анамнезе отмечены доброкачественные заболевания молочной железы, особенно такие как эпителиоз и клеточная атипия. Опухоли развиваются чаще при раннем наступлении менструаций и поздней менопаузе, причем удаление яичников, проведенное в раннем периоде жизни, оказывает некоторое защитное действие. Известно, что профилактическое удаление яичников, проведенное у женщин с мутациями по генам BRCA1 и BRCA2, существенно снижает риск развития рака молочной железы. В настоящее время проводят генетический анализ мутаций у женщин, составляющих группу повышенного риска, т. е. из семей с наследственным раком молочной железы или яичников.
В случае положительных результатов для снижения риска заболевания, в качестве профилактической меры предусматривается возможность проведения у них двухсторонней мастэктомии и/или сальпингоэктомии. Для этой категории женщин особенно трудно сделать выбор между такими профилактическими мерами и возможностью ранней диагностики заболевания. Это связано с сомнительной эффективностью скрининговых процедур и с довольно сложной системой аргументов в пользу проведения профилактической операции.
Недавно The National Institute for Clinical Excellence (NICE) в Великобритании выпустил руководство, в котором приводятся основные критерии отбора женщин, входящих в группу повышенного риска развития семейного рака, и излагаются принципы дальнейшего клинического наблюдения за ними. В зависимости от степени риска, для этих женщин предусматривается несколько категорий клинических обследований: первая, вторая и третья. Данные о влиянии применения пероральных противозачаточных средств на развитие рака молочной железы носят противоречивый характер. Тем не менее среди женщин, пользующихся противозачаточными средствами, рак развивается не чаще, чем у тех, кто к ним не прибегает.
В масштабных исследованиях, проведенных в США (Women s Health Initiative, WHI), было показано, что после 5,2 лет применения эстрогенов/прогестина у женщин возникает дополнительный риск заболевания раком молочной железы, который составляет 26%. Наряду с этим увеличивается риск развития инсульта и кардиологических заболеваний. В наблюдениях за жертвами атомной бомбардировки Хиросимы было показано увеличение среди них случаев заболевания раком молочной железы. Демографические различия в заболеваемости, скорее, больше связаны с рационом питания, культурными и географическими различиями, чем с антропологическими характеристиками. Так, у дочерей и внучек женщин, переехавших в США из Японии и Гавайских о-ов, рак молочной железы развивается с такой же частотой, как и у американок. По результатам исследований международной группы эпидемиологов, потребление большого количества жиров вряд ли влияет на развитие заболевания.
Однако выявлена взаимосвязь между заболеваемостью раком молочной железы и неумеренным потреблением алкоголя. К числу факторов, содержащихся в продуктах питания и способных предотвращать развитие рака молочной железы, относятся серусодержащие органические соединения (S-аллилцистеин, присутствующий в чесноке и в растениях из семейства крестоцветных, например в брюссельской капусте), индол-3-карбинол (также присутствующий в крестоцветных), каротиноиды (бета-каротин в зеленых и желтых овощах), витамин Е, селен и полифеноловые антиоксиданты чая, а также флавоноиды.
Как можно предполагать на основании последних исследований, у женщин, ведущих активный образ жизни и регулярно выполняющих оздоровительные физические упражнения, риск заболевания раком молочной железы снижается. Тем не менее риск заболевания среди женщин, которые пользуются гормональной заместительной терапией, или эстрогенами, или их комбинацией с прогестинами, остается несколько более высоким. Небольшой добавочный риск, по крайней мере частично, может компенсироваться такими более благоприятными последствиями гормональной терапии, как, например, снижение риска развития остеопороза.
Обычно через 5 лет после прекращения приема гормонов этот эффект не проявляется. В недавно выполненном большом исследовании продемонстрирована важная роль грудного вскармливания в предотвращении заболевания раком молочной железы. Прослежена четкая взаимосвязь между продолжительностью периода кормления грудью и риском развития заболевания. Относительное снижение заболеваемости достигает 4,3% на каждый год грудного кормления, и с рождением каждого нового ребенка заболеваемость снижается еще на 12%. Эти выводы остаются справедливыми для женщин, живущих как в развитых, так и в развивающихся странах, не зависят от их возраста и возраста установления менопаузы, от принадлжености женщин к той или иной этнической группе, возраста первой беременности, и от общего количества рожденных детей.
Как показали авторы исследования, кумулятивная частота заболеваемости раком молочной железы в развитых странах могла бы снизиться более чем в два раза (с 6,3 до 2,7 на 100 женщин 70-летнего возраста), если бы женщина имела не менее 2-3 детей, и на протяжении всего детородного периода вскармливала их грудью. До недавних пор это было распространено среди женщин в развивающихся странах. По мнению авторов, грудное вскармливание обеспечивает почти две трети общего снижения заболеваемости раком молочной железы.
Вообще в настоящее время наблюдается снижение смертности от рака молочной железы. Это, вероятно, связано с совершенствованием методов ранней диагностики и лечения, а также с внедрением Национальной программы скрининговых исследований в Великобритании. Как показали последние исследования, прием аспирина снижает риск возникновения рака молочной железы. Так при ежедневном приеме этого препарата риск снижается на 28% — с вероятностью успешного исхода 0,72, причем эффект более выражен у женщин в периоде постменопаузы.
Идентификация и клонирование генов BRCA1 и BRCA2 позволили понять молекулярные основы происхождения семейного рака молочной железы. Присутствие мутаций в этих генах обуславливает на протяжении жизни 50-85%-ю вероятность заболевания раком молочной железы, обычно в периоде постменопаузы. При этом риск развития рака яичника составляет 15-45%. Однако большое число случаев спорадического рака не связано с генами BRCA1 и BRCA2, и известны другие гены, которые также определяют предрасположенность к этому заболеванию, например ген, кодирующий белок р53. К группе повышенного риска также относятся женщины, у которых выявляется мутантный ген атаксии те-лангиэктазии. Ген BRCA1 состоит из 5711 пар оснований и занимает около 100 кбаз.
Аннотация научной статьи по клинической медицине, автор научной работы — Кит О. И., Шатова Юлиана Сергеевна, Тодоров С. С., Гудцкова Т. Н.
The correlation between different biomolecular breast cancer subtypes frequency and the menstrual state
Кит О.И., ШатоваЮ.С., Тодоров С.С., Гудцкова Т.Н.
частота встречаемости различных молекулярно-биологических
подтипов рака молочной железы в зависимости от репродуктивного статуса
ТНР (4-я группа) 138 (16,2)** Репродуктивный период 26 (17,9)
Перименопауза 32 (23,1)
Постменопауза 80 (59)
Всего 850 (100). Репродуктивный период 203 (23,9)*
Перименопауза 202 (23,6)*
Постменопауза 445 (52,5)*
Примечание. * — различия достоверны по отношению к больным в постменопаузе (р 0,1). Частота люминального А-подтипа у пост-менопаузальных женщин также достоверно не отличалась от других групп. А Нег2пеи+-подтип встречался реже — 7% против 9% у перименопаузальных женщин (p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Согласно полученным данным, развитие того или иного молекулярно-биологического подтипа напрямую зависит от менструального статуса женщины. В репродуктивном периоде гормонзависимость опухоли выражена в большей степени, чем в других периодах. Однако при рассмотрении частоты встречаемости подтипов в отдельности выявлена интересная закономерность. С изменением статуса от репродуктивного до постменопаузы только ТНР неуклонно растет в процентном отношении. Тогда как кривые, отражающие динамику частоты встречаемости других подтипов, принципиально отличаются. Полученные нами данные свидетельствуют, что период пе-рименопаузы является в этом плане особым периодом. И пики всех трех кривых приходятся именно на перименопаузу с последующей разнонаправленной тенденцией к исходному уровню.
Менструирующие Перименопауза Постменопауза
——Люминальный А —-Люминальный В
Динамика частоты встречаемости молекулярно-биологических подтипов от репродуктивного статуса.
Полученные нами данные соответствуют имеющимся в литературе лишь частично. Во многом это объясняется изменением подходов к распределению подтипов РМЖ с течением времени. Как было указано выше, нами были использованы последние рекомендации St. Gallena (2013) и Russco (2013), которые отличаются от предыдущих (St. Gallena 2011) по ряду принципиальных позиций. Это в свою очередь привело к тому, что данные далеко не всех исследований сопоставимы друг с другом. Также критерием распределения больных по группам в нашем исследовании являлся репродуктивный статус пациенток, а не возраст, что, на наш взгляд, является более целесообразным. Это является принципиальным подходом к проведенному исследованию, отличающим его от других. Таким образом, результат формирования групп согласно репродуктивному статусу не может быть полностью сопоставим с результатом формирования по критерию возраста. Несмотря на это, очевидно, что необходимо проводить дальнейшее изучение особенностей развития различных молекулярно-биологических подтипов РМЖ, в том числе у женщин с разным гормональным фоном, что подтверждается полученными нами данными.
1. Семиглазов В.Ф. Новые подходы к лечению рака молочной железы. Вопросы онкологии. 2013; 59 (3): 288-91.
2. Семиглазов В.Ф. Стратегические и практические подходы к решению проблемы рака молочной железы. Вопросы онкологии. 2012; 58 (2): 148-52.
3. Parker J.S., Mullins M., Cheang M.C.U., Leung S., Voduc D., Vickery T. et al. Supervised risk predictor of breast cancer based on intrinsic subtypes. J. Clin. Oncol. 2009; 27: 1160-7.
4. Perou C.M., Sorlie T., Eisen M.B., Rijn M., Jeffrey S.S., Rees C.A. et al. Molecular portraits of human breast tumors. Nature. 2000; 406: 747-52.
5. Blows F.M., Driver K.E., Schmidt M.K., Broeks A., Leeuwen F.E., Wesselling J. et al. Subtyping of breast cancer by immno-
histochemistry to investigate a relationship between subtype and short and long term survival: a collaborative analysis of data for 10,159 cases from 12 studies. PLosMed. 2010; 7: 279.
6. Cheang M.C.U., Chia S.K., Voduc D., Gao D., Leung S., Snider J. et al. Ki 67 index, HER-2 status, and prognosis of patients with luminal B breast cancer. J. Nat. Cancer Inst. 2009; 101: 736-50.
7. Hugb J., Hanson J., Cheang MC., Nielsen TO., Perou CM., Du-montet C. et al. Breast cancer subtypes and response to doxetaxel in node-positive breast cancer: use in immunohistochemical definition in the BCIRG 001tTrial. J. Clin. Oncol. 2009; 27: 1168-76.
8. Kwan M.L., Kushi L.H., Weltzien E., Maring B., Kutner S.E., Fulton R.S. et al. Epidemiology of breast cancer subtypes in two prospective cohort studies of breast cancer survivors. Breast Cancer Res. 2009; 11:R31 (doi:10.1186/bcr2261); 11 (3).
9. Carey L.A., Perou C.M., Livasy C.A., Dressler L.G., Cowan D, Conway K. et al. Race, breast cancer subtypes, and survival in the Carolina Breast Cancer Study. J. A. M. A. 2006; 295: 2492-502.
10. Sorlie T., Perou C.M, Tibshirani R., Aas T., Geisler S, Johnsen H. et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc. Natl Acad. Sci. USA. 2001; 98: 10869-74.
11. Berry D.A., Cirrincione C., Henderson I.C., Citron M.L., Bud-man D.R., Goldstein L.J. et al. Estrogen-receptor status and outcomes of modern chemotherapy for patients with node-positive breast cancer. J. A. M. A. 2006; 295(14):1658-67.
12. Harris L.N., Broadwater G., Lin N.U., Miron A., Schnitt S.J., Cowan D. et al. Molecular subtypes of breast cancer in relation to paclitaxel response and outcomes in women with metastatic disease: results from CALGB 9342. Breast Cancer Res. 2006; 8: 66.
13. Nguyen P.L., Taghian A.G., Katz M.S., Niemierko A., Abi Raad R.F., Boon W.L. et al. Breast cancer subtype approximated by eatrogen receptor, progesterone receptor, and HER- 2 is associated with local and distant recurrence after breast-conserving therapy. J. Clin. Oncol. 2008; 26: 2373-8.
14. Rouzier R., Perou C.M., Symmans W.F., Ibrahim N., Cristofallini M., Anderson K. et al. Breast cancer molecular subtypes respond differently to preoperative chemotherapy. Clin. Cancer Res. 2005; 11 (16): 5678-85.
15. Wo J.Y., Taghian A.G., Nguyen P.L, Raad R.A., Sreedhara M., Bellon J.R. et al. The association between biological subtype and isolated regional nodal failure after breast-conserving therapy. Int. J. Radiat. Oncol. Biol. Phys. 2010; 77: 188-96.
16. Vladimirova L.Y., Kit O.I. Long-term results of capicitabine application in metastatic breast cancer patients. J. Clin. Oncol. 2012; 30 (15S, part I of II): 800S, E11558.
18. Kurian A.W., Fish K., Shema S.J., Clarke C.A. Lifetime risks of specific breast cancer subtypes among women in four racial/ ethnic groups. Breast Cancer Res. 2010; 12: 99.
19. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. СПб: Сотис; 1995.
20. Romero Q., Bendahl P.-O., Klintman M., Loman N., Ingvar Ch., Ryden L. et al. Ki67 proliferation in core biopsies versus surgical samples — a model for neo-adjuvant breast cancer studies. BMC Cancer. 2011; 11: 341.
1. Semiglazov V.F. New approaches to the treatment of breast cancer. Voprosy onkologii. 2013; 59 (3): 288-91. (in Russian)
2. Semiglazov V.F. Strategic and practical approaches to solving the problem of breast cancer. Voprosy onkologii. 2012; 58 (2): 148-52. (in Russian)
3. Parker J.S., Mullins M., Cheang M.C.U., Leung S., Voduc D., Vickery T. et al. Supervised risk predictor of breast cancer based
on intrinsic subtypes. J. Clin. Oncol. 2009; 27: 1160-7.
4. Perou C.M., Sorlie T., Eisen M.B., Rijn M., Jeffrey S.S., Rees C.A. et al. Molecular portraits of human breast tumors. Nature. 2000; 406: 747-52.
5. Blows F.M., Driver K.E., Schmidt M.K., Broeks A., Leeuwen F.E., Wesselling J. et al. Subtyping of breast cancer by immno-histochemistry to investigate a relationship between subtype and short and long term survival: a collaborative analysis of data for 10,159 cases from 12 studies. PLos Med. 2010; 7: 279.
6. Cheang M.C.U., Chia S.K., Voduc D., Gao D., Leung S., Snider J. et al. Ki 67 index, HER-2 status, and prognosis of patients with luminal B breast cancer. J. Nat. Cancer Inst. 2009; 101: 736-50.
7. Hugb J., Hanson J., Cheang MC., Nielsen TO., Perou CM., Du-montet C. et al. Breast cancer subtypes and response to doxetaxel in node-positive breast cancer: use in immunohistochemical definition in the BCIRG 001tTrial. J. Clin. Oncol. 2009; 27: 1168-76.
8. Kwan M.L., Kushi L.H., Weltzien E., Maring B., Kutner S.E., Fulton R.S. et al. Epidemiology of breast cancer subtypes in two prospective cohort studies of breast cancer survivors. Breast Cancer Res. 2009; 11:R31 (doi:10.1186/bcr2261); 11 (3).
9. Carey L.A., Perou C.M., Livasy C.A., Dressler L.G., Cowan D, Conway K. et al. Race, breast cancer subtypes, and survival in the Carolina Breast Cancer Study. J. A. M. A. 2006; 295: 2492-502.
10. Sorlie T., Perou C.M, Tibshirani R., Aas T., Geisler S, Johnsen H. et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc. Natl Acad. Sci. USA. 2001; 98: 10869-74.
11. Berry D.A., Cirrincione C., Henderson I.C., Citron M.L., Bud-man D.R., Goldstein L.J. et al. Estrogen-receptor status and outcomes of modern chemotherapy for patients with node-positive breast cancer. J. A. M. A. 2006; 295(14):1658-67.
12. Harris L.N., Broadwater G., Lin N.U., Miron A., Schnitt S.J., Cowan D. et al. Molecular subtypes of breast cancer in relation to paclitaxel response and outcomes in women with metastatic disease: results from CALGB 9342. Breast Cancer Res. 2006; 8: 66.
13. Nguyen P.L., Taghian A.G., Katz M.S., Niemierko A., Abi Raad R.F., Boon W.L. et al. Breast cancer subtype approximated by eatrogen receptor, progesterone receptor, and HER- 2 is associated with local and distant recurrence after breast-conserving therapy. J. Clin. Oncol. 2008; 26: 2373-8.
14. Rouzier R., Perou C.M., Symmans W.F., Ibrahim N., Cristofallini M., Anderson K. et al. Breast cancer molecular subtypes respond differently to preoperative chemotherapy. Clin. Cancer Res. 2005; 11 (16): 5678-85.
15. Wo J.Y., Taghian A.G., Nguyen P.L, Raad R.A., Sreedhara M., Bellon J.R. et al. The association between biological subtype and isolated regional nodal failure after breast-conserving therapy. Int. J. Radiat. Oncol. Biol. Phys. 2010; 77: 188-96.
16. Vladimirova L.Y., Kit O.I. Long-term results of capicitabine application in metastatic breast cancer patients. J. Clin. Oncol. 2012; 30 (15S, part I of II): 800S, E11558.
18. Kurian A.W., Fish K., Shema S.J., Clarke C.A. Lifetime risks of specific breast cancer subtypes among women in four racial/ ethnic groups. Breast Cancer Res. 2010; 12: 99.
19. Smetnik V.P., Tumilovich L.G. Non-operative gynecology. [Neoperativnaya ginekologiya]. St. Peterburg: Sotis; 1995. (in Russian)
20. Romero Q., Bendahl P.-O., Klintman M., Loman N., Ingvar Ch., Rydén L. et al. Ki67 proliferation in core biopsies versus surgical samples — a model for neo-adjuvant breast cancer studies. BMC Cancer. 2011; 11: 341.
