Характеристика послеродовых функциональных и воспалительных заболеваний, которые представляют важную ветеринарную проблему. Анализ состава культур микроорганизмов, выделенных из маточного содержимого больных коров при осложнениях послеродового периода.
| Рубрика | Сельское, лесное хозяйство и землепользование |
| Вид | статья |
| Язык | русский |
| Дата добавления | 28.11.2017 |
| Размер файла | 166,7 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Дифференциальная диагностика послеродового эндометрита и субинволюции матки (сходство и различие)
Авдеенко Владимир Семенович — доктор ветеринарных наук, профессор кафедры болезней животных и ВСЭ Тел.: 8 927 116 09 66; E_mail: avdeenko8686@mail.ru
Молчанов Алексей Вячеславович — доктор сельскохозяйственных наук, профессор, завкафедрой технологии производства и переработки продукции животноводства Тел.: 8 927 134 58 02
Музартаев Ренат Эксангалиевич — аспирант кафедры болезней животных и ВСЭ
Рыхлов Андрей Сергеевич — доктор ветеринарных наук, профессор кафедры болезней животных и ВСЭ
Differential diagnosis of pospartum endometritis and subinvolution of uterus (similarity and difference)
tel.: 8 927 116 09 66; E-mail: avdeenko8686@mail.ru
Molchanov Alexej Vyacheslavovich — Doctor of Agrarian Sciences, Professor, the head of the department Technology of production and processing production of cattle-breeding tel.: 8 927 134 58 02
Murtazaev Renat Eksangalievich — post-graduate, Department Animal diseases and VSE
Rykhlov Andrej Sergeevich — Doctor of Vet sciences, Professor Department Animal diseases and VSE
Классическая форма послеродового эндометрита характеризуется обязательным наличием всех симптомов общего (повышение температуры тела, угнетение общего состояния, потеря аппетита) и локального (мягковатость и болезненность матки при ректальной пальпации) характера течения патологического процесса. При субинволюции матки данных симптомов не наблюдается. При морфологических исследованиях аспирата из полости матки у родильниц с субинволюцией матки выявляются фрагменты эндометрия с началом инволюции, в то время, как у животных с послеродовым эндометритом выявлялись фрагменты некротизированной децидуальной ткани эндо- и миометрия, в которых присутствовала диффузная или обильная лимфо- и лейкоцитарная инфильтрация. Клиника стертой формы послеродового эндометрита характеризуется невыраженной температурной реакцией, длительной инволюцией матки, незначительным изменением характера лохий, поэтому субинволюцию матки в отдельных случаях можно рассматривать как симптом стертой формы послеродового эндометрита.
Ключевые слова: субинволюция матки, эндометрит, послеродовый период.
The classical form of puerperal endometritis is characterized by the obligatory presence of symptoms a general character (fever, depression of general condition, loss of appetite) and local character (softish and painful uterus by rectal palpation) the nature of the pathological process. If there is subinvolution of uterus, these symptoms are not observed. Morphological study of the aspirate from the cavity of the uterus, puerperal with subinvolution of uterus revealed uterine endometrial fragments from beginning of involution, while animals with postpartum endometritis revealed fragments of necrotic decidual tissue, endo- and myometrium in which diffuse or lymph abundant — and leucocytic infiltration was present. Clinic of erased form of postpartum endometritis is characterized by unexpressed fever response, prolonged involution of uterus, trifling alterations of lochia, so subinvolution of uterus in some cases can be seen as a symptom of the erased form of postpartum endometritis.
Key words: subinvolution of uterus, endometritis, postpartum period.
Послеродовые функциональные и воспалительные заболевания представляют важную ветеринарную проблему, так как в настоящее время являются одной из основных причин снижения репродуктивного здоровья маточного поголовья молочного скота [1, 2, 3]. Частота послеродовых воспалительных и функциональных осложнений послеродового периода остается достаточно высокой и не имеет тенденции к снижению, несмотря на достигнутые успехи в диагностике, профилактике и лечении [4]. Так, их частота находится в пределах 35-56%, при этом на долю потери репродуктивной способности от осложнений приходится от 24,5-35% [6, 7].
Наиболее распространенным проявлением послеродовой инфекции является послеродовый эндометрит, частота которого в общей популяции родивших составляет 33-48%, а среди больных с послеродовыми функциональными осложнениями — более 40% [8]. Клиническая картина послеродового эндометрита в настоящее время характеризуется поздним появлением симптомов, наличием стертых, атипичных форм, для которых нередко свойственно несоответствие общей реакции организма и тяжести местного патологического процесса.
В течение всего периода беременности, первых 5-6 дней послеродового периода и 10 дней после задержания последа имеется системный и локальный иммунодефицит, что обусловливает повышенную чувствительность беременных и родильниц к бактериальной инфекции и в то же время создает объективные предпосылки для активации резидентной микрофлоры [4, 6]. Поэтому эффективность проводимого лечения зависит не только от правильного подбора антибактериальных препаратов, но и от иммунологической реактивности организма.
Не менее актуальной является проблема патологии сократительной деятельности матки в пуэрперии. Послеродовая субинволюция матки до настоящего времени не имеет однозначного определения. В отечественных классификациях послеродовая субинволюция матки, как правило, не выделена в качестве самостоятельного послеродового осложнения, однако на практике часто используется в диагнозах как обозначение самостоятельного клинического синдрома, возможно, в ряде случаев заменяя собой диагноз эндометрита [5]. Вместе с тем практикующие врачи, выставляя такой диагноз, часто недооценивают тяжесть состояния родильниц, назначая при этом неадекватную терапию.
Таким образом, не снижающаяся тенденция уровня функциональных и воспалительных послеродовых заболеваний, в значительной степени зависящая от состояния иммунной системы родильниц и исходного состояния репродуктивного здоровья, определила актуальность исследования. В то же время, по данным литературы, конкретные диагностические критерии, позволяющие дифференцировать субинволюцию матки от послеродового эндометрита, отсутствуют.
Целью настоящего исследования явилось изучение сходств и различий субинволюции матки и послеродового эндометрита для оптимизации ведения родильниц с осложненным послеродовым периодом.
Сроки наступления родов в исследуемых группах были одинаковыми. Существенными были различия в продолжительности родов. Так, роды с продолжительностью более 3 часов в 1-й группе были у 29,4% родильниц, во 2-й — у 18,6%, в контрольной — ни у одной. При анализе ведения родов было выявлено, что почти у каждой 3-й роженицы (29,4%) с субинволюцией матки и более чем у каждой 2_й (61%) с эндометритом после родов через естественные родовые пути проводилось более 3 влагалищных исследований, тогда как в контрольной группе лишь у каждой 6-й (16,7%). Значительными были осложнения в родах: аномалии родовой деятельности (35,3 и 42,9% против 16,7%), амниотомия (58,8 и 57,1% против 16,7%). Диагностику заболеваний осуществляли общепринятыми клиническими и микробиологическими исследованиями методами в ветеринарии.
Цифровой материал подвергали статистической обработке на ПК Pentium с использованием прикладных программ пакета Microsoft Office.
Результаты исследований. Объединяющими клиническими симптомами у родильниц с субинволюцией матки и эндометритом после естественных родов были повышение температуры тела (41,0 и 64,4% соответственно), субинволюция матки (100,0 и 81,4%) и ее мягкая консистенция при пальпации (35,3 и 33,9%). У больных животных эндометритом после задержания последа, перечисленные симптомы встречались в 2,0-2,5 раза чаще, чем у животных больных эндометритом после родов через естественные родовые пути.
Таблица 1 — Показатели ИФН — статуса (вЕД/мл) у родильниц с субинволюцией матки и эндометритом
СМОТРЕТЬ ДРУГИЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Год утверждения 2016
Профессиональные ассоциации:
- Российское Общество акушеров — гинекологов
Оглавление
1. Краткая информация
Послеродовой эндометрит (ПЭ) – возникшее после родов или кесарева сечения воспаление эндометрия с возможным вовлечением миометрия.
ПЭ – полимикробное заболевание.
Основные ассоциации возбудителей:
- Escherichia coli,
- штаммы Enterobacter spp.,
- Enterococcus spp.,
- Proteus spp.,
- Klebsiella spp.,
- Bacteroides spp.,
- Peptostreptococcus spp.,
- Streptococcus agalactiae,
- Staphylococcus spp.
- 70-90% неспорообразующие анаэробы;
- 20-40% Escherichia coli;
- 7-10% другие энтеробактерии,
- 3-7% золотистый стафилококк.
Тяжёлое течение стрептококковой инфекции.
Микоплазмы и хламидии чаще вызывают вялотекущие формы, часто присоединяясь к первичным возбудителям инфекции.
Возбудителей ПЭ дифференцируют от микробов-контаминантов по степени обсемененности полости матки:
- низкая (менее 5х10 2 КОЕ/мл) у здоровых родильниц;
- умеренная (5х10 2 -10 3 КОЕ/мл) у здоровых и при легкой степени эндометрита;
- высокая (более 10 3 КОЕ/мл) у больных средней тяжести и тяжелых.
При эндометрите, вызванном монокультурой бактерий, они высеваются в высоком титре, обсемененность монокультурой выше, чем при ассоциации микроорганизмов.
Высокая степень обсемененности монокультурой – чаще эндометрит в легкой форме, чем при аэробно-анаэробных ассоциациях.
Нет единой точки зрения о патогенезе.
Пути распространения инфекции:
- восходящий (условно-патогенная микрофлора влагалища);
- гематогенный;
- лимфогенный;
- интраамниальный.
Предпосылка для развития эндометрита — замедление инволюции матки и нарушение процессов регенерации эндометрия.
Частота развития после родов:
- самопроизвольных физиологических– 1-3%;
- патологически протекающих – 2-5%;
- кесарева сечения – от 5 до 20%.
У каждой 5 роженицы хориоамнионит переходит в послеродовой эндометрит.
Другие послеродовые инфекции (O86):
O86.8 – Другие уточненные послеродовые инфекции.
По характеру родоразрешения: после самопроизвольных родов; после кесарева сечения.
По клиническому течению: легкая форма; средней тяжести; тяжелая форма.
По особенностям клинических проявлений: классическая форма; стертая форма.
2. Диагностика
Возникает на 2-5 день послеродового периода.
При неэффективной терапии (2%) возможна генерализация с развитием:
- перитонита,
- тазовых абсцессов,
- тромбофлебита,
- сепсиса.
Легкая форма: возникает на 2-5 сутки, на фоне 2-3 дней лечения нормализуется температура и лохии, пальпаторная болезненность матки исчезает через 1-2 дня.
Средней тяжести: возникает на 2-7 сутки, на фоне лечения симптомы исчезают медленнее, чем при легкой форме.
Тяжелая форма: возникает на 2-3 сутки, выраженная интоксикация, температура до 39 о С, ухудшение состояния в течение первых 24 часов, существенные изменения гематологических, биохимических показателей крови и системы гемостаза.
Стертая форма: симптомы появляются на 1-7 суток, матка безболезненна и не увеличена в размерах.
Факторы риска развития послеродовой инфекции:
- юный возраст;
- низкий социально-экономический статус;
- ожирение;
- сахарный диабет;
- воспалительные заболевания в анамнезе;
- бактериальная и вирусная инфекция во время беременности;
- осложненное течение беременности: анемия, истмико-цервикальная недостаточность, инвазивное обследование/лечение;
- осложненное течение родов;
- экстренное кесарево сечении при родах более 15 час и/или безводном промежутке более 12 час, осложнения вмешательства и патологическая кровопотеря.
На этапе диагностики:
- общее физикальное обследование
- термометрия
- измерение пульса
- АД
- влагалищное исследование: зияние цервикального канала, мутные лохии, болезненность при пальпации дна и боковых стенок матки.
На этапе диагностики:
- общий анализ крови с лейкоцитарной формулой
- гемостазиограмма
- БАК: общий белок, альбумин, мочевина, креатинин, натрий, калий, хлор, СРБ, прокальцитонин
- общий анализ мочи.
Морфологическое исследование биоптатов эндометрия.
Бактериологическое исследование лохий в 85-90% случаев позволяет поставить диагноз.
Микрофлора шеечного канала в 25% случаев полностью совпадает с микрофлорой полости матки, поэтому обязательно исследуют содержимое матки.
Цитологическое исследование лохий.
На этапе диагностики:
УЗИ органов малого таза всем родильницам через 3 суток.
Варианты послеродового эндометрита:
Гистероскопия: фибриноидный налёт на стенках, нередко с примесью газа; множество инъецированных и легко кровоточащих сосудов, очаги кровоизлияний в слизистой оболочке; возможен дефект ткани в виде ниши или хода – признак частичного расхождения швов. Достоверность более 90%.
МРТ органов малого таза.
- Инфекция мочевыводящих путей.
- Сальпингоофорит – первые признаки на 8-10 день после родов.
- Послеродовой параметрит – на 10-12 сутки послеродового периода.
- Послеродовой пельвиоперитонит.
- Метротромбофлебит.
- Тромбофлебит вен таза – в конце 2-й недели послеродового периода.
3. Лечение
Комплексная терапия включает общее воздействие и местное лечение.
Главный компонент общего лечения — антибактериальная терапия, местного – вакуум-аспирация и/или выскабливание послеродовой матки.
Цели лечения:
- нормализация клинико-лабораторных показателей;
- элиминация этиологически значимых микроорганизмов;
- купирование инфекционно-воспалительного процесса;
- предотвращение развития осложнений;
- клиническое выздоровление;
- сохранение репродуктивной функции.
Абсолютные показания к неотложной госпитализации.
Основной компонент – антибактериальная терапия.
До получения результатов бактериологического исследования проводят эмпирическую терапию.
При тяжелых формах используют парентеральное введение.
Ингибиторозащищенные пенициллины каждые 8 часов в/в 7 дней:
- амоксициллин/клавулановая кислота 1.2 г;
- ампициллин/сульбактам, амоксициллин/сульбактам 1.5-3 г;
- пиперациллин/тазобактам 2.5-4.5 г;
- тикарциллин/клавуланат 3.1 г.
Цефалоспорины II-III поколения в/в 7 дней:
- цефокситин 2г каждые 6 час;
- цефоперазон 2 г каждые 12 час;
- цефтазидим 1-2 г каждые 8 час;
- цефтриаксон 2 г каждые 12 час.
При тяжелой форме эндометрита в/в:
- цефоперазон/сульбактам 2-4 г каждые 12 час 7 дней;
- моксифлоксацин 400мг 7 дней;
- имипенем/циластатин 1 г каждые 6-8 час 5-7 дней;
- меропенем 1 г каждые 8 час 5-7 дней.
Цефалоспорины мало эффективны против энтерококков, используют пенициллины (ампициллин/сульбактам).
Карбапенемы (имипенем, меропенем) наиболее эффективны для монотерапии — препараты резерва при тяжелой форме и альтернатива комбинированной терапии.
Для монотерапии тяжелых форм используют цефалоспорины III-IV поколения (цефтазидим, цефтриаксон, цефоперазон, цефепим).
Возможны различные сочетания внутривенных препаратов:
- клиндамицин 0,6-0,9 г каждые 8 час + гентамицин 1,5 мг/кг/сут через 8-12 час 5-7 дней;
- линкомицин 0,6 г каждые 8 час + гентамицин 1,5 мг/кг/сут через 8-12 час в/в + цефалоспорины II-III 1-2 г через 8-12 час 5-7 дней;
- метронидазол 500 мг каждые 6-8 час + гентамицин 1,5 мг/кг/сут через 8-12 час 5-7 дней;
- метронидазол 500 мг каждые 6-8 час + гентамицин 1,5 мг/кг/сут через 8-12 час + цефалоспорины II-III 1-2 г через 8-12 час 5-7 дней;
- левофлоксацин 500 мг 1-2 раза/сут + метронидазол 500 мг 3 раза/сут 5-7 дней.
Выбор комбинации обусловлен тяжестью течения и спектром возбудителей.
Отсутствие эффекта от клиндамицина + гентамицина связано с наличием:
- энтерококков – добавляетсяамоксициллин;
- некоторых анаэробных грамотрицательных — заменить клиндамицин наметронидазол.
При выделении микоплазм или хламидий — лечение тетрациклинами (доксициклин), макролидами (азитромицин, джозамицин, рокситромицин).
Временно прекращается грудное вскармливание.
- клиническая неэффективность — отсутствие улучшения после 48-72 часов терапии;
- развитие побочных реакций;
- высокая потенциальная токсичность (гентамицин).
Антибактериальную терапию проводят до исчезновения клинических признаков и нормализации лабораторных показателей.
При адекватной антибиотикотерапии у 90% больных температура нормализуется за 48-72 часов.
Длительность лечения определяется тяжестью течения и продолжается до стойкого закрепления эффекта.
Рекомендуется проведение хирургической санации матки: вакуум-аспирация и/или выскабливание послеродовой матки.
Рекомендуется включение в комплекс противовирусных препаратов: ацикловир, валацикловир.
Для профилактики кандидоза и дисбактериоза — флуконазол 150 мг в/в каждые 7 дней АБ-терапии.
Для предупреждения аллергических реакций на фоне АБ-терапии — антигистаминные препараты.
Инфузионная терапия около 1250 мл/сут, соотношение коллоидных и кристаллоидных растворов 1:1.
Рекомендуется низкомолекулярные гепарины (надропарин кальция, эноксапарин натрия).
Для улучшения сократительной активности матки назначают утеротонические средства (окситоцин).
При тяжелых формах ПЭ для детоксикации, реологической коррекции и иммунокоррекция рекомендуются эфферентные методы:
- гемосорбция,
- плазмаферез,
- лазерное облучение крови,
- озонотерапия.
4. Реабилитация
Рекомендуется включить физиотерапевтические методы воздействия, санаторно-курортное лечение.
5. Профилактика и диспансерное наблюдение
Динамическое наблюдение акушера-гинеколога в течение года.
Профилактика проводится в женской консультации и в родильном доме.
- определение факторов риска гнойно-воспалительных заболеваний;
- санация очагов генитальной и экстрагенитальной инфекции под клинико-лабораторным контролем;
- рациональное ведение родов (профилактика слабости родовой деятельности, патологической кровопотери и родового травматизма).
При кесаревом сечении:
- за 30-40 мин. до разреза кожи однократно в стандартной дозе цефалоспорин I-II (цефазолин, цефуроксим) или ингибиторозащищенных пенициллинов (амоксициллин/клавуланат, амоксициллин/сульбактам, ампициллин/сульбактам), при истинной аллергии на пенициллины – клиндамицин +аминогликозид;
- профилактическое применение утеротонических средств;
- в 1-2 сутки после операции коррекция волемических, водно-электролитных нарушений, ликвидация анемии и гипопротеинемии;
- предупреждение нарушений перистальтики кишечника в послеоперационном периоде;
- применение ингибиторозащищенных пенициллинов и цефалоспоринов I-II перед ручным обследованием послеродовой матки, при безводном промежутке 12 ч и более.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Цель исследования: изучение микрофлоры родовых путей при послеродовом эндометрите и определение ассоциативного риска развития инфекционно-воспалительной патологии пуэрперия.
Материал и методы: в основную группу включили 27 родильниц с признаками воспалительного процесса в полости матки, которые были выписаны из учреждения родовспоможения на 4–6-е сут после родов, но обратились за медицинской помощью с жалобами на боли в области малого таза и повышение температуры тела на 7–9-е сут после родов. Группу контроля составили 30 женщин после естественных срочных родов с физиологическим течением пуэрперия. Обе группы были сопоставимы по возрасту пациенток. Всем пациенткам провели бимануальное исследование и осмотр родовых путей; ультразвуковое исследование; комплексное исследование микрофлоры родовых путей и полости матки методом полимеразной цепной реакции, бактериологическое исследование микрофлоры родовых путей.
Результаты исследования: послеродовой эндометрит может манифестировать на 6–9-е сут после родов. При послеродовом эндометрите в родовых путях и в полости матки в 100% случаев обнаруживаются Staphylococcus spp.; Streptococcus spp. встречались в родовых путях в группе с послеродовым эндометритом в 11,2 раза чаще, чем при физиологическом течении пуэрперия, микробная ассоциация Sneathia spp. + Leptotrichia spp. + Fusobacterium spp. — в 4 раза чаще. При послеродовом эндометрите лактофлора выявлялась только у 44,4% пациенток. Наиболее высокие показатели предсказательной ценности оказались для Staphylococcus spp., Streptococcus spp. Наиболее высок риск развития послеродового эндометрита при обсемененности родовых путей стафилококковой флорой (100%), энтерококками (85,2%), стрептококками (74,1%) и Ureaplasma urealiticum (70,4%) в концентрациях до 107–1010 геном-эквивалент/образец.
Заключение: в группу риска развития послеродового эндометрита попадают женщины с ранней выпиской из роддома, наличием в родовых путях микрофлоры, не только вызывающей инфекционно-воспалительный процесс в полости матки, но и ассоциированной с дисбиотическими состояниями влагалища.
Ключевые слова: послеродовой эндометрит, Enterobacterium, Streptococcus, Staphylococcus, Ureaplasma urealiticum, пуэрперий, ультразвуковые критерии диагностики послеродового эндометрита.
Для цитирования: Самойлова Т.Е., Кохно Н.И., Докудаева Ш.А. Микробные ассоциации при послеродовом эндометрите. РМЖ. Медицинское обозрение. 2018;10:6-13
Microbial associations in postpartum endometritis
T.E. Samoilova 1 , N.I. Kokhno 1 , Sh.A. Dokudaeva 2
1 Department of Gynecopathy and Reproductive Health of Continuing Medical Education Institute, Pirogov National Medical and Surgical Center, Moscow
2 LLC “Znakomii Doctor”, Moscow
Aim: to study the microflora of the birth canal with postpartum endometritis and to determine the associative risk of developing infectious-inflammatory pathology of puerperium.
Patients and Methods: the main group included 27 puerperas with signs of inflammation in the uterine cavity, who were discharged from the obstetric institution 4–6 days after delivery, but sought medical help with complaints of pain in the pelvic area and an increase in body temperature at 7th–9th day after birth. The control group consisted of 30 women after natural term birth with physiological puerperium period. Both groups were age-matched. All patients underwent bimanual examination and examination of the birth canal, ultrasound procedure, comprehensive study of the microflora of the birth canal and uterine cavity by the method of polymerase chain reaction, bacteriological study of the microflora of the birth canal.
Results: postpartum endometritis can manifest at 6th–9th day after birth. In postpartum endometritis, Staphylococcus spp. was found in 100% of cases in the birth canal and uterine cavity; Streptococcus spp. was manifested in the birth canal in the group with postpartum endometritis 11.2 times more often than in the physiological puerperium period, the microbial association of Sneathia spp. + Leptotrichia spp. + Fusobacterium spp.– 4 times more often. In postpartum endometritis, lactoflora was detected only in 44.4% of patients. The highest score of predictive validity were found for Staphylococcus spp., Streptococcus spp. The risk of postpartum endometritis is high when the genital tract is contaminated by staphylococcal flora (100%), enterococci (85.2%), streptococci (74.1%) and Ureaplasma urealiticum (70.4%) in concentrations up to 107–1010 genome-equivalent/sample.
Conclusion: women with early discharge from the hospital, with the presence of microflora in the birth canal, causing not only the infectious-inflammatory process in the uterine cavity but also associated with dysbiotic conditions of the vagina, are at risk of developing postpartum endometritis.
Key words: postpartum endometritis, Enterobacterium, Streptococcus, Staphylococcus, Ureaplasma urealiticum, puerperium, ultrasound criteria for the diagnosis of postpartum endometritis.
For citation: Samoilova T.E., Kokhno N.I., Dokudaeva Sh.A. Microbial associations in postpartum endometritis // RMJ. Medical Review. 2018. № 10. P. 6–13.
В статье представлены результаты оригинального исследования, посвященного изучению микрофлоры родовых путей при послеродовом эндометрите и определению ассоциативного риска развития инфекционно-воспалительной патологии пуэрперия.
Были использованы следующие ультразвуковые критерии физиологического пуэрперия: матка занимает срединное положение и представляет собой образование овоидной формы; миометрий средней эхогенности и однородной структуры; дно матки отклоняется в физиологическое положение anteflexio-versio после 7 сут; биометрические показатели матки на 7-е сут после родов: длина —
105,2±2,0 мм, переднезадний размер — 77,0±1,2 мм, ширина матки — 96,5±1,6 мм; полость матки после 7 сут закрыта, приобретает форму, характерную для небеременных женщин [11].
Использовались следующие ультразвуковые признаки послеродового эндометрита: низкий тонус матки + отклонение дна матки кзади, отсутствие формирования физиологического положения anteflexi-versio после 7 сут; субинволюция матки — отставание темпов сокращения матки. Объем матки у родильниц с эндометритом в течение 3–5 сут уменьшается лишь на 11,7% (в норме — на 19,2%), к 7 сут — на 22,9% (в норме — на 33,4%), к 9 сут — на 35,5%
(в норме — на 46,2%) [12]; расширение полости матки в средней трети свыше 15 мм на 5-е сут после родов; скопление в полости матки разнородных гиперэхогенных структур без четких контуров в сочетании и без эхосвободных участков, а также пристеночных сигналов с высокой акустической плотностью (некротизированные фрагменты децидуальной оболочки и сгустки крови); наличие в полости матки мигрирующих мелких эхопозитивных структур с акустическим феноменом, характерным для пузырьков газа; повышенная эхогенность стенок полости матки, преимущественно в субэндометриальном слое, что соответствует отеку прилегающих к базальной мембране слоев эндометрия [11].
Совместно с врачами смежных специальностей проводили дифференциальную диагностику послеродового эндометрита с такими патологическими состояниями, сопровождающимися лихорадкой, как пельвиоперитонит, острый аппендицит, холецистит, прободная язва желудка, цистит, пиелонефрит, мастит, ателектаз легких, пневмония, ОРВИ, а также с осложнениями применения эпидуральной анестезии.
Статистическая обработка полученных данных проводилась с использованием статистической программы MedCalc. С целью определения наиболее значимых этиологических факторов развития послеродового эндометрита мы оценили частоту обнаружения определенной патогенной флоры. Для определения эффективности диагностического теста по выявлению определенного вида микроорганизма во влагалищном содержимом мы определяли статистические показатели — чувствительность и специфичность. Для определения влияния фактора на развитие патологического процесса использовали критерии — относительный риск (ОР) и отношение шансов, а также оценивали значения границ 95% доверительного интервала. Также определяли прогностическую ценность теста (predictive value) — вероятность наличия (отсутствия) заболевания при известном результате исследования. Для этого вычисляли вероятность наличия заболевания при положительном (патологическом) результате теста — прогностическую ценность положительного результата (ПЦПР, positive predictive value) и вероятность отсутствия заболевания при отрицательном (нормальном) результате теста — прогностическую ценность отрицательного результата (ПЦОР, negative predictive value).
При физиологическом послеродовом периоде у всех пациенток выявлялась нормальная микрофлора —
лактобациллы, в то время как при послеродовом эндометрите только у 12 (44,4%) пациенток обнаружили лактофлору (табл. 1). 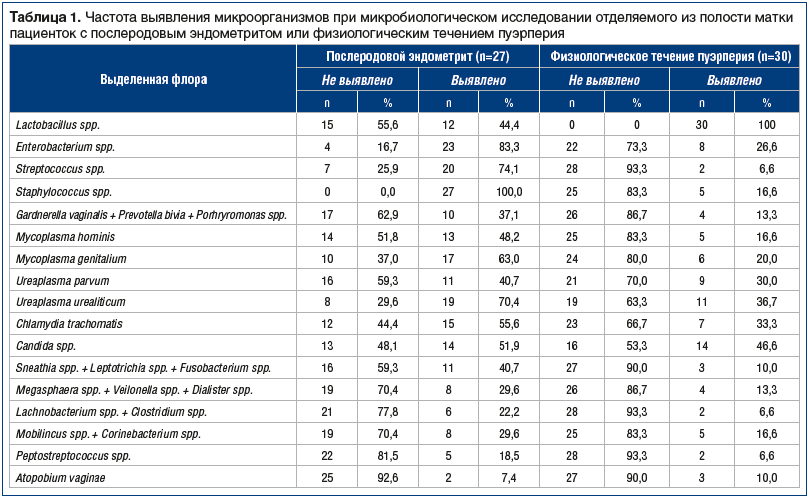
При микробиологическом исследовании влагалищного содержимого стафилококки обнаружили у всех родильниц с послеродовым эндометритом и у 5 (16,6%) родильниц с физиологическим течением пуэрперия. При исследовании микрофлоры влагалища и полости матки у родильниц с эндометритом стрептококки выявляли в 11,2 раза чаще, чем у родильниц с нормальным течением послеродового периода (74,1% против 6,6% соответственно), Mycoplasma hominis — в 2,9 раза, Mycoplasma genitalium — в 3,15 раза, Ureaplasma urealiticum — в 1,9 раза, Chlamydia trachomatis — в 1,7 раза.
Энтеробактерии выявляли при воспалительном процессе в послеродовой матке в 83,3% случаев (23 пациентки), при физиологическом течении послеродового периода — в 26,6% (8 пациенток). Микробные ассоциации Gardnerella vaginalis + Prevotella bivia + Porhryromonas spp. у пациенток с эндометритом обнаруживали в 2,8 раза чаще, чем у женщин с физиологическим течением пуэрперия. При послеродовом эндометрите микробную ассоциацию Sneathia spp. + Leptotrichia spp. + Fusobacterium spp. выявляли в 4 раза чаще, чем при нормальном течении послеродового периода; Megasphaera spp. + Veilonella spp. + Dialister spp. — в 2,2 раза; Lachnobacterium spp. + Clostridium spp. — в 3,4 раза; Mobilincus spp. + Corinebacterium spp. — в 1,8 раза; Peptostreptococcus spp. — в 2,8 раза. Atopobium vaginae не встречалась при физиологическом течении послеродового периода.
При обработке статистических данных мы обнаружили, что наибольшую чувствительность в отношении диагностики послеродового эндометрита имеет выявление в родовых путях патогенной стафилококковой флоры (100%), чуть меньшую чувствительность — выявление энтерококков (85,2%) (табл. 2). Также достаточно высокую чувствительность в отношении выявления послеродового эндометрита имело выделение стрептококков (74,1%) и Ureaplasma urealiticum (70,4%). Средними значениями чувствительности оказались для таких микроорганизмов, как Mycoplasma genitalium (62,96%), Chlamydia trachomatis (55,56%), Candida spp. (51,85%), Mycoplasma hominis (48,15%), Ureaplasma parvum (40,74%), для микробной ассоциации Sneathia spp. + Leptotrichia spp. + Fusobacterium spp. (40,74%). Низкая чувствительность метода для прогнозирования риска послеродового эндометрита оказалась для следующих микробных ассоциаций: Megasphaera spp. + Veilonella spp. + Dialister spp. (29,63%), Mobilincus spp. + Corinebacterium spp. (29,63%), Lachnobacterium spp. + Clostridium spp. (22,22%), Peptostreptococcus spp. (18,52%), самой низкой чувствительностью характеризовалось выделение Atopobium vaginae (7,41%). 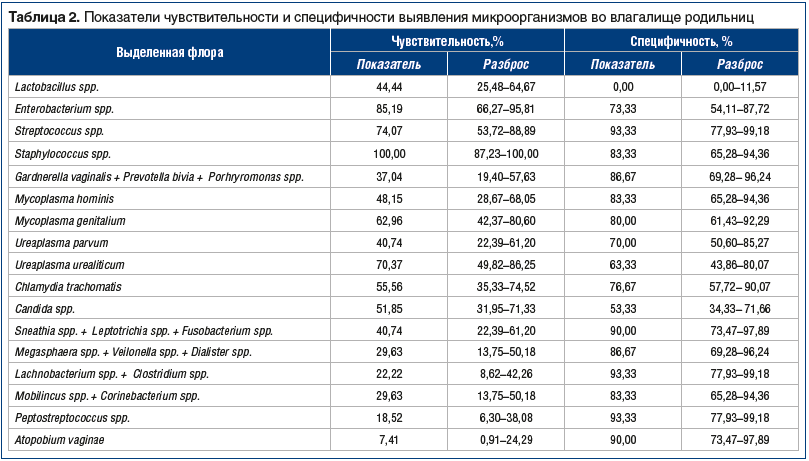
Для всех видов выявленной флоры мы получили высокие показатели специфичности (см. табл. 2). Наиболее высокие (от 90 до 100%) — для Streptococcus spp. (93,33%), Lachnobacterium spp. + Clostridium spp. (93,33%), Peptostreptococcus spp. (93,33%), Atopobium vaginae (90,00%), Sneathia spp. + Leptotrichia spp. + Fusobacterium spp. (90,00%). Показатели специфичности от 80 до 89,9% были установлены для микробных ассоциаций Gardnerella vaginalis + Prevotella bivia + Porhryromonas spp. (86,67%), Megasphaera spp. + Veilonella spp. + Dialister spp. (86,67%), Mobilincus spp. + Corinebacterium spp., Staphylococcus spp. и Mycoplasma hominis — по 83,33%, Mycoplasma genitalium — 80,00%. Специфичность в диапазоне 70–79,9% была характерна для Chlamydia trachomatis (76,67%), Enterobacterium spp. (73,33%), Ureaplasma parvum (70,00%). Невысокая специфичность выявления во влагалищном содержимом оказалась для Ureaplasma urealiticum (63,33%), еще более низкая — для Candida spp. (53,33%) (см. табл. 2).
Анализ статистических показателей ОР показал, что существует прямая связь послеродового эндометрита и всех вышеперечисленных микроорганизмов, кроме Ureaplasma parvum, Candida spp., Megasphaera spp. + Veilonella spp. + Dialister spp., Mobilincus spp. + Corinebacterium spp., Peptostreptococcus spp. и Atopobium vaginae (табл. 3). Наиболее сильная коррелятивная связь отмечалась при наличии во влагалище Staphylococcus spp. (ОР=43,3 при p=0,0072). ОР для Enterobacterium spp. составил 4,8 при p=0,0009 и для Streptococcus spp. 4,5 при p 0,05) для Ureaplasma parvum, Chlamydia trachomatis, Candida spp., Megasphaera spp. + Veilonella spp. + Dialister spp., Lachnobacterium spp. + Clostridium spp., Mobilincus spp. + Corinebacterium spp., Peptostreptococcus spp., Atopobium vaginae (см. табл. 3). В то же время показатели отношений шансов дают основание считать, что присутствие в родовых путях всех представленных в таблице 3 микроорганизмов имеет прямую ассоциативную связь с развитием послеродового эндометрита, кроме Atopobium vaginae.
Наиболее высокие показатели предсказательной ценности оказались для Staphylococcus spp. (ПЦПР=84,38%; ПЦОР=100,00%), Streptococcus spp. (ПЦПР=90,91%; ПЦОР=80,00%), Enterobacterium spp. (ПЦПР=74,19%; ПЦОР=84,62%). Таким образом, можно сделать вывод о высоком риске развития послеродового эндометрита при наличии в родовых путях именно этих микроорганизмов. Остальные микроорганизмы могут присутствовать в родовых путях при воспалении, однако не являются абсолютно значимыми этиологическими факторами риска развития послеродового эндометрита, т. к. были выявлены и у пациенток с неосложненным течением послеродового периода (табл. 4).
Содержание Staphylococcus spp. и Streptococcus spp. при эндометрите достигало 10 9 –10 10 геном-эквивалент (ГЭ) /образец или 80–100% к общей бактериальной массе. Enterobacterium spp. наиболее часто присутствовали в количестве 10 3 –10 5 ГЭ/образец, в единичном случае — 10 6 ГЭ/образец. Микробную ассоциацию Gardnerella vaginalis + Prevotella bivia + Porhryromonas spp. и Candida spp. в основном выявляли в концентрациях 10 5 –10 6 ГЭ/образец, в единичных случаях — до 107 ГЭ/образец. Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealiticum и Chlamydia trachomatis обнаруживали в количествах до 10 3 –10 5 ГЭ/образец, в то время как содержание Ureaplasma parvum и остальных облигатно-анаэробных микроорганизмов редко превышало 10 2 –10 4 ГЭ/образец. 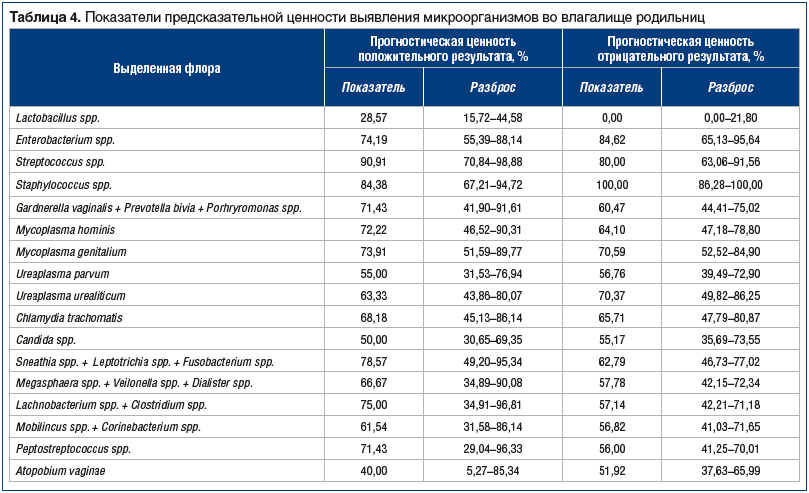
Только для зарегистрированных пользователей
