Похожие темы научных работ по клинической медицине , автор научной работы — Басиашвили Г.Т., Ульянин М.Ю., Гатауллин И.Г., Бариев А.Э., Хайруллина Г.Р.
• Современные технологии профилактики лимфореи после радикальной простатэктомии
Ключевые слова: рак простаты, лимфорея, радикальная простатэктомия
Keywords: prostate cancer, lymphocele, radical prostatectomy
Басиашвили Г.Т.1, Ульянин М.Ю.1, Гатауллин И.Г.2, Бариев А.Э.1, Хайруллина Г.Р.3, Иливанов С.Ю.2
1 Республиканский клинический онкологический диспансер Министерства здравоохранения Республики Татарстан
420029, Россия, Казань, ул. Сибирский тракт д. 29
2 Казанская государственная медицинская академия — филиал ФГБОУ ДПО РМАНПО Минздрава России 420012, Россия, Казань, ул. Бутлерова, д. 36
Modern technologies for the prevention of lymphorrhea after radical prostatectomy
Basiashvili G.T.1, Ulyanin M.U.1, Gataullin I.G.2, Bariev A.E.1, Khairullina G.R.3, Ilivanov S.U.2
1 Republican Clinical Oncological Dispensary of the Ministry Health of the Republic Tatarstan 29, Sibirskii trakt, Kazan’, 420029, Russia
2 Kazan State Medical Academy — Branch of the State Pedagogical University of the Russian Federation, Ministry of Health of the Russian Federation
36, Butlerova Str., Kazan’, 420012, Russia
3 Kazan State Medical University of the Ministry of Health of Russia 49, Butlerova Str., Kazan’, 420012, Russia
Цель. Лимфомфоцеле является частым осложнением после радикальной простатэктомии. Нами предложен метод профилактики. Критерием эффективности проводимой профилактики с проведением аппликации фибри-нового клея интра- и послеоперационных осложнений после радикальной простатэктомии явилось: отсутствие у 87% оперированных больных лимфореи, лимфоцеле, тромбозов ниж.конечностей.
Методы. В настоящее время тазовая лимфаденэк-томия является обязательным компонентом радикальной простатэктомии которая имеет не только лечебное но и диагностическое значение, и несет важную информацию о стадии онкологического процесса. Однако тазовая лимфаденэктомия (стандартная или расширенная) сопровождается удалением значительной массы тканей с пересечением и ранением большого количества мелких лимфотических и кровеносных сосудов, зачастую которые не перевязываются, так как не визуализируется во время операции. Эти обстоятельства приводят к скоплению серозной и геморрагической жидкости, и способствуют формированию лимфоцеле (серомы). Образование лимфоцеле (кист в забрюшинном пространстве, заполненных лимфой) в раннем послеоперационном периоде после тазовой лимфаденэктомии и радикальной простатэктомии составляет 25-50%. Механизм их развития связан с рассечением при тазовой лимфаденэктомии эфферентных лимфатических сосудов с последующей аккумуляцией лимфы в забрюшинном пространстве. Клинически тазовые лимфоцеле протекают бессимптомно или проявляются симптомами сдавления подвздошных вен, артерий. Наиболее часто — это симптомы сдавления мочеточников, раздражения мочевого пузыря, задержка
стула, отек половых органов, боли в нижней половине живота, отеки нижних конечностей. Диагноз устанавливается на основании лучевых методов диагностики. Для профилактики лимфоцеле при лимфаденэктомии необходимо тщательно лигировать края резецированных лимфатических сосудов. Лечение лимфоцеле заключается в аспирации содержимого кисты с ее последующим дренированием. В некоторых случаях приходится прибегать к иссечению кисты с пришиванием краев ее стенки к брюшной стенке для выполнения полости лимфоцеле грануляциями. Длительное и большое скопление лимфоцеле в образованном замкнутом пространстве могут провоцировать сдавление близлежащих органов и структур малого таза (стеноз мочеточника, сдавление подвздошных сосудов, развитие кишечной непроходимости). Кроме того длительная лимфорея приводит к потерю свободных аминокислот и обуславливает гипоальбуминемию, тромбоз нижних конечностей.
Результаты. Технический результат заявляемого решения заключается в предупреждении образования лимфоцеле в забрюшинном пространстве после радикальной простатэктомии с сокращением сроков лечения. Способ осуществляется следующим образом: соблюдая правила асептики, на гемостатическую губку наносят фи-бриновый клей, затем производят аппликацию на сухую раневую поверхность по границам лимфоаденэктомии, после 2-3-минутной экспозиции гемостатическую губку удаляют.
При таком способе нанесения фибринового клея на раневой поверхности образуется белая тонкая эластическая масса, плотно прилипающую к тканям, имитируя основной этап свертывания крови. Таким образом, за счет
облитерации мелких кровеносных и лимфотических сосудов уменьшается образования лимфоцелле (серомы) и достигается надежный гемостаз. После нанесения фи-бринового клея предпузырное пространство дренируется двумя 2х — просветными дренажными трубками. Рана послойно ушивается.
Критерием эффективности проводимой профилактики с проведением аппликации фибринового клея интра-и послеоперационных осложнений после радикальной простатэктомии явилось: отсутствие у 87% (27) оперированных больных лимфореи, лимфоцеле, отсутствие у этих больных стеноза мочеточника, сдавление подвздошных сосудов, что приводит к отечности нижних конечностей, мягких тканей лона, мошонки. У 30 (96,8%) пациентов отсутствие интра- ранних послеоперационных кровотечений и тромбоэмболических осложнений, т к. с использованием современных методов лигирования и коагуляции кровеносных и лимфатических сосудов позволяют более
детально визуализировать операционное поле, что приводит к значительному сокращению продолжительности операции и величины интраоперационной кровопотери.
У 27 (87%) больных послеоперационный период сократился на 3-5 дней, что приводит к быстрой реабилитации, активации больного и сокращению койко-дня в реанимационном отделении и уменьшает экономические затраты.
Заключение. Таким образом, предлагаемый способ профилактики лимфареи после радикальной простат-эктомии позволяет уменьшить количество послеоперационных осложнений, способ уменьшает образования лимфоцеле (серомы) и сокращает сроки лимфореи от 1 до 3 суток, сокращаются сроки послеоперационной реабилитации, и способствует к ранней активации пациента. Преимущество данного метода: простота исполнения, доступность препарата хороший медицинский результат, экономическая составляющая.
Изобретение относится к медицине, а именно к онкологии, в частности к раку предстательной железы (далее — РПЖ).
РПЖ является одной из наиболее актуальных проблем в онкологии на сегодняшний день в связи с высокими показателями заболеваемости и смертности во всем мире и в России в частности. В 2006 г. в России от РПЖ умерло 8516 мужчин, а в 2016 г. — 12523 мужчины. Средний возраст больных, умерших по причине прогрессии РПЖ, в 2006 г. составлял 71,5 лет, а в 2016 г. несколько увеличился до 73,1 лет. Прирост смертности от РПЖ в России с 2006 по 2016 г. составил 18,97% при среднегодовом темпе прироста 1,72%. Показатель одногодичной смертности, т.е. наступления смерти по причине прогрессирования злокачественного новообразования предстательной железы в течение одного года с момента установления диагноза РПЖ, также заметно снизился в течение последнего десятилетия (Состояние онкологической помощи населению России в 2016 году. Под редакцией А.Д. Каприна, В.В. Старинского, Г.В. Петровой. Москва, 2017). В 2006 г. в течение одного года после диагностирования РПЖ умерло 17,2% больных, а в 2016 г. — 7,9%, что, вероятнее всего, связано с увеличением числа локализованных опухолей на момент установления диагноза, а также с появлением и применением новых и более эффективных лекарственных препаратов для лечения больных РПЖ с отдаленными метастазами и повышением качества проводимой терапии и наблюдения за больными данной категории. Таким образом, РПЖ является одной из наиболее важных и актуальных проблем в онкологи по причине продолжающегося роста заболеваемости и смертности от данной патологии.
Радикальная простатэктомия (далее — РПЭ) является основным методом лечения больных РПЖ наряду с лучевой и гормонолучевой терапией. Основными преимуществами РПЭ являются удаление предстательной железы, семенных пузырьков и окружающих тканей, а также возможность выполнения тазовой лимфаденэктомии (далее — ТЛАЭ), сохранения функции удержания мочи и эрекции, когда это возможно с онкологических позиций. Плановое патоморфологическое исследование операционного материала дает возможность точного стадирования опухолевого процесса (pTNM), что позволяет выработать наиболее рациональную тактику лечения у конкретного больного. К потенциальным недостаткам хирургического лечения относятся наличие анестезиологических рисков, необходимость госпитализации и восстановительный период, возможность развития различных послеоперационных осложнений, вероятность выявления положительного хирургического края при неправильной технике выполнения операции, а также развитие функциональных нарушений после операции (недержание мочи, эректильная дисфункция). Частота осложнений и выявления позитивного хирургического края в большей степени зависит от опыта хирурга, выполняющего операцию. При выборе хирургического метода лечения также важно помнить, что наличие выраженной сопутствующей патологии увеличивает анестезиологические риски и повышает смертность от неонкологических причин. В данной ситуации крайне важной является оценка и расчет предполагаемой продолжительности жизни для выбора хирургической или лучевой стратегии лечения. Рандомизированные многоцентровые клинические исследования подтвердили, что РПЭ улучшает общую выживаемость и увеличивает время до развития отдаленных осложнений по сравнению с динамическим наблюдением, а у ряда больных позволяет достичь излечения. В любом случае, решение об окончательном варианте лечения у каждого больного должно приниматься на консилиуме с участием врачей радиотерапевтов, хирургов онкологов и химиотерапевтов (мультидисциплинарный подход). Больной в обязательном порядке должен быть информирован обо всех преимуществах и потенциальных рисках каждого из методов лечения.
Выполнение тазовой лимфаденэктомии (далее — ТЛАЭ) необходимо у всех больных РПЖ промежуточного или высокого риска, которым предстоит хирургическое лечение, с учетом наличия риска лимфогенного метастазирования более 5%. Расширенная ТЛАЭ обладает достоверно большей диагностической эффективностью при оценке состояния тазовых ЛУ по сравнению со стандартной ТЛАЭ. Кроме того, расширенная ТЛАЭ, по данным ряда авторов, играет терапевтическую роль у больных с микрометастазамив регионарных лимфоузлах. Однако, выполнение расширенной ТЛАЭ может сопровождаться увеличением риска развития интра- и послеоперационных осложнений. Одним из самых распространенных осложнений ТЛАЭ является образование лимфокист и длительная лимфорея (MuschM, KleveckaV, RoggenbuckU, KroepflD. Complications of pelvic lymphadenectomy in 1,380 patients undergoing radical retropubic prostatectomy between 1993 and 2006. JUrol 2008; 179:923-80). Существует ряд исследований, посвященных разработке и оценке эффективности методик, позволяющих уменьшить вероятность или предотвратить развитие лимфокист и длительной лимфореи.
Pietro Grande с коллегами из Урологической клиники в Люцерне (Швейцария) провели рандомизированное проспективное исследование, сравнивающее эффективность использования титановых клипс при пересечении лимфатических протоков во время расширенной ТЛАЭ и пересечение лимфопротоков с помощью биполярной коагуляции во время робот-ассистированной РПЭ (GrandeP, DiPierroGB, MordasiniLetal. Prospective Randomized Trial Comparing Titanium Clips to Bipolar Coagulation in Sealing Lymphatic Vessels During Pelvic Lymph Node Dissection at the Time of Robot-assisted Radical Prostatectomy. Eur Urol. 2017 Feb; 71(2):155-158. doi: 10.1016/j.eururo. 2016.08.006. Epub 2016 Aug 17). В исследование включили 220 больных РПЖ, которым выполнили робот-ассистированную простатэктомию с лимфаденэктомией с 2012 по 2015 годы. В зависимости от метода обработки и пересечения лимфатических протоков во время ТЛАЭ больных рандомизировали в две подгруппы. В первой группе лимфатические протоки клипировали титановыми клипсами и пересекали (n=110), а во второй — коагулировали и пересекали при помощи биполярного электроинструмента. Всем больным выполняли УЗИ малого таза на 10 и 90 день послеоперационного периода. Подавляющее число лимфокист диагностированы на 10 сутки послеоперационного периода: 95% в первой группе и 98% во второй (р=0,5). Не было достоверных различий в подгруппах по количеству выявляемых лимфокист: 47% и 48% соответственно, р=0,9. Также не получено достоверных различий в частоте возникновения клинически значимых симптомных лимфокист: 5% и 4% соответственно, р=0,7. Таким образом, авторы отмечают отсутствие влияния методики обработки лимфатических протоков во время выполнения ТЛАЭ на частоту возникновения лимфокист.
Karsch с коллегами провели исследование влияния обработки зоны лимфодиссекции гемостатическим препаратом на образование лимфокист и длительность лимфорреи в послеоперационном периоде после позадилонной РПЭ. Суммарно в исследование включили 104 больных РПЖ, которых рандомизировали в группы в зависимости от метода профилактики лимфореи: в первой группе выполняли рутинную ТЛАЭ (51 больной), во второй группе после выполнения ТЛАЭ подвздошные сосуды обрабатывали гемостатическим материалом (53 пациента). Лимфоцеле диагностировано у 26 больных в группе рутинной ТЛАЭ и у 19 больных из группы обработки гемостатическим материалом. Симптомные лимфокисты, требующие дренирования, реже выявлялись в группе с гемостатиком (2 против 4 в группе только ТЛАЭ). Длительность лимфореи после вторичного дренирования лимфокисты также значимо различалась в подгруппах. Так, в группе рутинной ТЛАЭ длительность лимфореи после дренирования лимфокисты составила 45 дней, а в группе больных, которым зону лимфаденэктомии обрабатывали гемостатическим материалом, данный показатель составил 12 дней. Авторы сделали заключение, что обработка зоны лимфодиссекции гемостатическим материалом позволяет значительно уменишить длительность лимфореи, а также снизить частоту образования клинически значимых лимфокист после РПЭ с ТЛАЭ. Ограничением данной методики является необходимость приобретения дорогостоящего гемостатического материала, т.е. увеличение финансовых затрат на операцию (Karsch JJ, Berthold М, BreulJ. Evaluation of Lymphorrhea and Incidence of Lymphoceles: 4DryField® PH in Radical Retropubic Prostatectomy. Adv Urol. 2016; 2016:2367432. doi: 10.1155/2016/2367432. Epub 2016 Jun 23).
Известен способ профилактики лимфореи после РПЭ. В конце операции осуществляют обработку раневой поверхности фибриновым клеем, который наносят на гемостатическую губку. Производят аппликацию губки на сухую раневую поверхность по границам лимфаденэктомии. Через 2-3 минуты губку удаляют и послойно ушивают рану (RU 2647620 С1).
Однако данный способ является дорогостоящим, а также повышается риск образования спаек в зоне нанесения фибриновых гемостатических материалов и формирования стриктур дистальных отделов мочеточников.
Однако, недостатком данной методики является риск перекрута петли кишки и развитие кишечной непроходимости.
Задачей данного изобретения является снижение длительности лимфореи и вероятность образования клинически значимых лимфокист.
Указанная технические и лечебные результаты при осуществлении изобретения достигаются за счет того, что также как и в известном способе выполняют радикальную позадилонную простатэктомию с расширенной ТЛАЭ.
Особенность заявленного способа заключается в том, что после удаления предстательной железы с семенными пузырьками, тазовой клетчатки с лимфатическими узлами и формирования везикоуретрального анастомоза, париетальную брюшину вытягивают и рассекают париетальный листок при помощи монополярного коагулятора по переходной складке и дистальным частям латеральных каналов, после чего лимфа из полости малого таза перераспределяется в брюшную полость и реабсорбируется брюшиной, далее полость малого таза справа и слева дренируют, рану послойно ушивают
Фиг. 1 — Вид операционного поля после формирования везикоуретрального анастомоза.
Фиг. 2 — Вид операционного поля после формирования везикоуретрального анастомоза; натянута париетальная брюшина.
Фиг. 3 — Вид операционного поля после формирования везикоуретрального анастомоза. При помощи монополярного коагулятора рассекают натянутую париетальную брюшину.
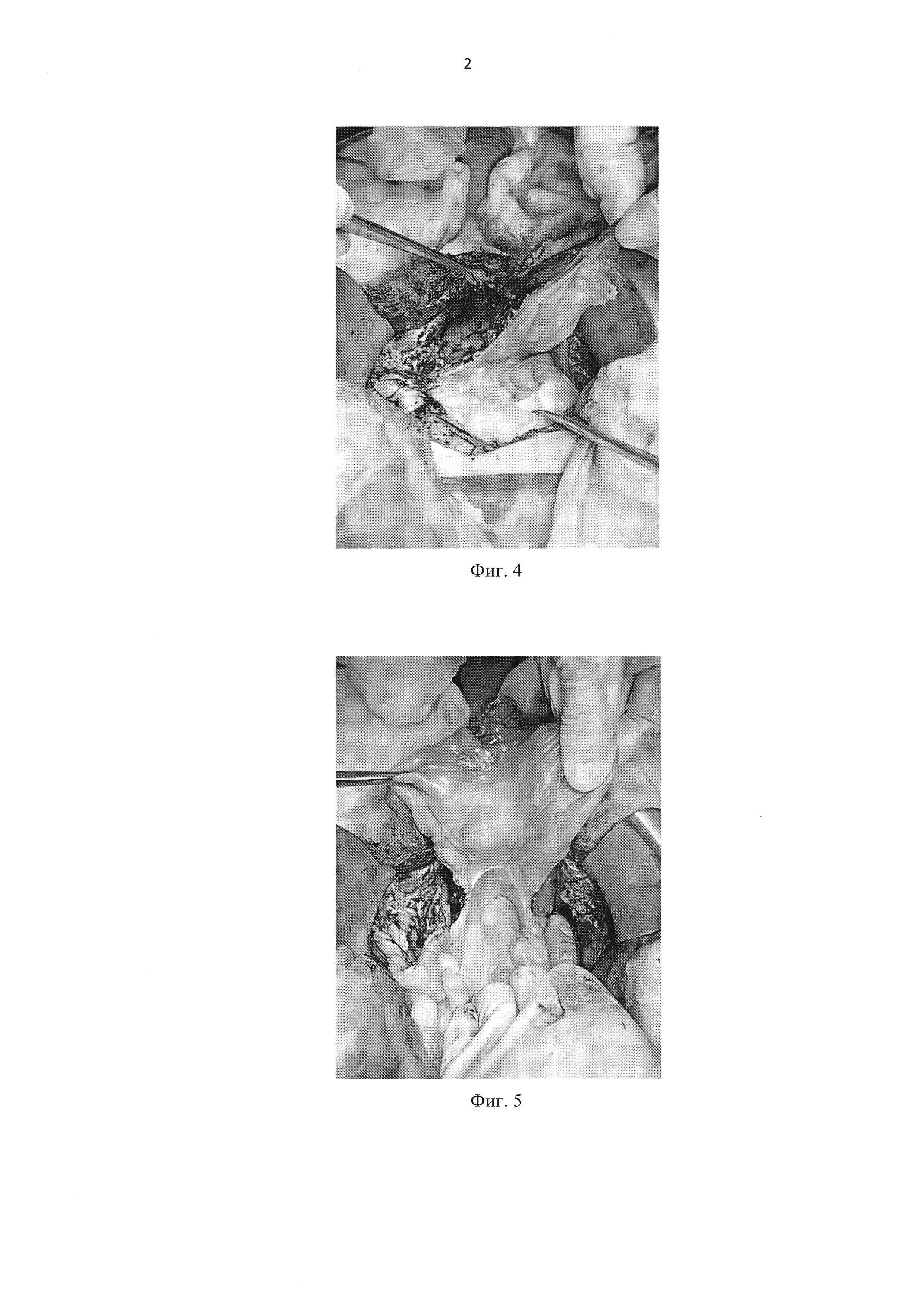
Фиг. 4 — Рассечение брюшины по левому латеральному каналу.
Фиг. 5 — Окончательный вид после широкого рассечения париетальной брюшины.
Способ осуществляют следующим образом.
Выполняют радикальную позадилонную простатэктомию с расширенной ТЛАЭ по стандартной методике (Фиг. 1).
После формирования везикоуретрального анастомоза и проверки последнего на герметичность, париетальную брюшину вытягивают (Фиг. 2) и при помощи монополярного коагулятора выполняют рассечение париетального листка брюшины (Фиг. 3) по переходной складке и дистальным частям латеральных каналов (Фиг. 4) таким образом, чтобы полость малого таза могла свободно сообщаться с брюшной полостью (Фиг. 5). После чего лимфа из полости малого таза перераспределяется в брюшную полость и реабсорбируется с брюшиной. Затем в полость малого таза справа и слева устанавливают дренажи, рану послойно ушивают.
Данный способ позволит снизить длительность лимфореи и вероятность образования лимфокист.

В группе больных, которым выполняли ТЛАЭ без лапаротомии в послеоперационном периоде по данным УЗИ у 8 (21,6%) были выявлены лимфокисты, в 5 случаях выполнили дренирование лимфокист под контролем УЗИ, в 2 случаях выполняли пункцию лимфокисты и эвакуацию содержимого, один пациент оставался под наблюдением, при контрольном обследовании отмечено уменьшение объема и организация лимфокисты. В группе ТЛАЭ с лапаротомией только у одного больного (4,5%) в послеоперационном периоде диагностирована лимфокиста, по поводу чего выполнили дренирование под контролем УЗИ. Таким образом, частота выявления клинически значимых лимфокист в раннем послеоперационном периоде была достоверно ниже в группе больных, которым после ТЛАЭ выполняли лапаротомию (р=0,0026). В группе больных без лапаротомии средняя длительность лимфореи составила 9,1±6 дней (3 — 60 дней, медиана 6 дней); медиана удаления первого дренажа из полости малого таза составила 4 дня (5,4±9,1), медиана удаления второго дренажа — 6 дней (9,7±10,7 дней). В группе ТЛАЭ с лапаротомией средняя длительность лимфореи составила 4,3 6±1,4 дней (2-7 дней, медиана 4,0 дня). При этом первый дренаж из малого таза в среднем удаляли на 2 сутки (2,5±1 день), второй дренаж на 4 сутки (4,4±1,4 дня). При статистическом анализе различия оказались достоверными (р=0,027).
Клинический пример выполнения предлагаемого способа.
Больной К. 62 лет, клинический диагноз — рак предстательной железы III ст. cT3aNoMo. Сопутствующая патология: артериальная гипертензия IIcт., 2 ст., остеохондроз поясничного отдела позвоночника. По данным комплексного обследования, уровень ПСА составил 14,7 нг/мл, объем предстательной железы 53 см 3 , в обеих долях визуализируются гипоэхогенные зоны с признаками инвазии за капсулу железы по данным трансректального ультразвукового исследования. Другой очаговой патологии не выявлено. При комплексном обследовании данных за наличие регионарных или отдаленных лимфогенных метастазов не получено. При гистологическом исследовании биопсийного материала верифицирована ацинарнаяа денокарцинома предстательной железы 7(3+4) баллов по Глисону в 5 фрагментах из 6 в правой доле и 4 фрагментах из 6 в левой доле, опухоль занимает до 50% площади биоптатов. На консилиуме с участием хирурга онкоуролога, радиотерапевта и химиотерапевта больному предложены варианты лечения (лучевая терапия или хирургическое лечение), пациент отдал предпочтение хирургическому методу. В отделении онкоурологии МНИОИ им. П.А. Герцена выполнена позадилонная РПЭ с расширенной ТЛАЭ по стандартной методике, дополненная профилактической лапаротомией по предложенной методике. После удаления препарата и формирования везикоуретрального анастомоза (Фиг. 1), париетальную брюшину вытянули (Фиг. 2) и при помощи монополярного коагулятора выполнили рассечение париетального листка брюшины (Фиг. 3) по переходной складке и дистальным частям латеральных каналов (Фиг. 4) таким образом, чтобы полость малого таза свободно сообщалась с брюшной полостью (Фиг. 5). Полость малого таза справа и слева дренировали. Рану ушивали послойно.
Послеоперационный период протекал без осложнений. Проводилась антибактериальная, инфузионная, симптоматическая терапия, профилактика тромбоза и тромбоэмболических осложнений. Страховые дренажи из полости малого таза удалены на 2 и 3 сутки. На 7 сутки после операции выполняли цистографию с целью оценки герметичности везикоуретрального анастомоза путем введения в мочевой пузырь 20 мл. водорастворимого контрастного вещества и 100 мл. стерильного физиологического раствора, при данном исследовании выхода контраста за пределы анастомоза не выявлено. При контрольном УЗИ малого таза на 8 сутки послеоперационного периода свободной жидкости и отграниченных жидкостных скоплений в полости малого таза не выявлено. Уретральный катетер удален на 7 сутки после операции, восстановлено самостоятельное мочеиспускание. В первые сутки после удаления уретрального катетера пациент отмечал непроизвольное подтекание мочи, по поводу чего требовалось применение 2 прокладок в сутки. Пациент выписан на 8 сутки после операции. По данным планового гистологического исследования в обеих долях предстательной железы выявлена ацинарная аденокарцинома 7(3+4) баллов по Глисону с инвазией за капсулу железы, семенные пузырьки интактны, в 29 исследованных тазовых лимфоузлах метастазов не выявлено, хирургический край резекции, а также дистальный и проксимальный края — без опухолевого роста. С учетом данных планового гистологического исследования, объема и радикального характера проведенного хирургического лечения, больной оставлен под динамическое наблюдение. В течение двух недель после удаления уретрального катетера пациенту требовалось применение 2-3 прокладок в сутки.
По прошествии 6 недель после операции пациент отмечал полное удержание мочи. Срок наблюдения за данным пациентом составил 8 месяцев, за этот период пациент не предъявлял жалобы на затрудненное мочеиспускание, а также не нуждался в применении прокладок. Уровень ПСА составлял 0,0-0,009 нг/мл, по данным ТРУЗИ — без признаков рецидива заболевания.
Разработанный способ прост в исполнении и позволяет существенно снизить риск развития длительной лимфореи и образования лимфокист, уменьшает длительность госпитализации и затраты на лечебные манипуляции, в том числе пункции и дренирование лимфокист.
Способ профилактики лимфореи и лимфокист у больных раком предстательной железы после хирургического лечения, включающий выполнение радикальной позадилонной простатэктомии с расширенной тазовой лимфаденэктомией, отличающийся тем, что после удаления предстательной железы с семенными пузырьками, тазовой клетчатки с лимфатическими узлами и формирования везикоуретрального анастомоза париетальную брюшину вытягивают и рассекают париетальный листок при помощи монополярного коагулятора по переходной складке и дистальным частям латеральных каналов, после чего лимфа из полости малого таза перераспределяется в брюшную полость и реабсорбируется брюшиной, далее полость малого таза справа и слева дренируют, рану послойно ушивают.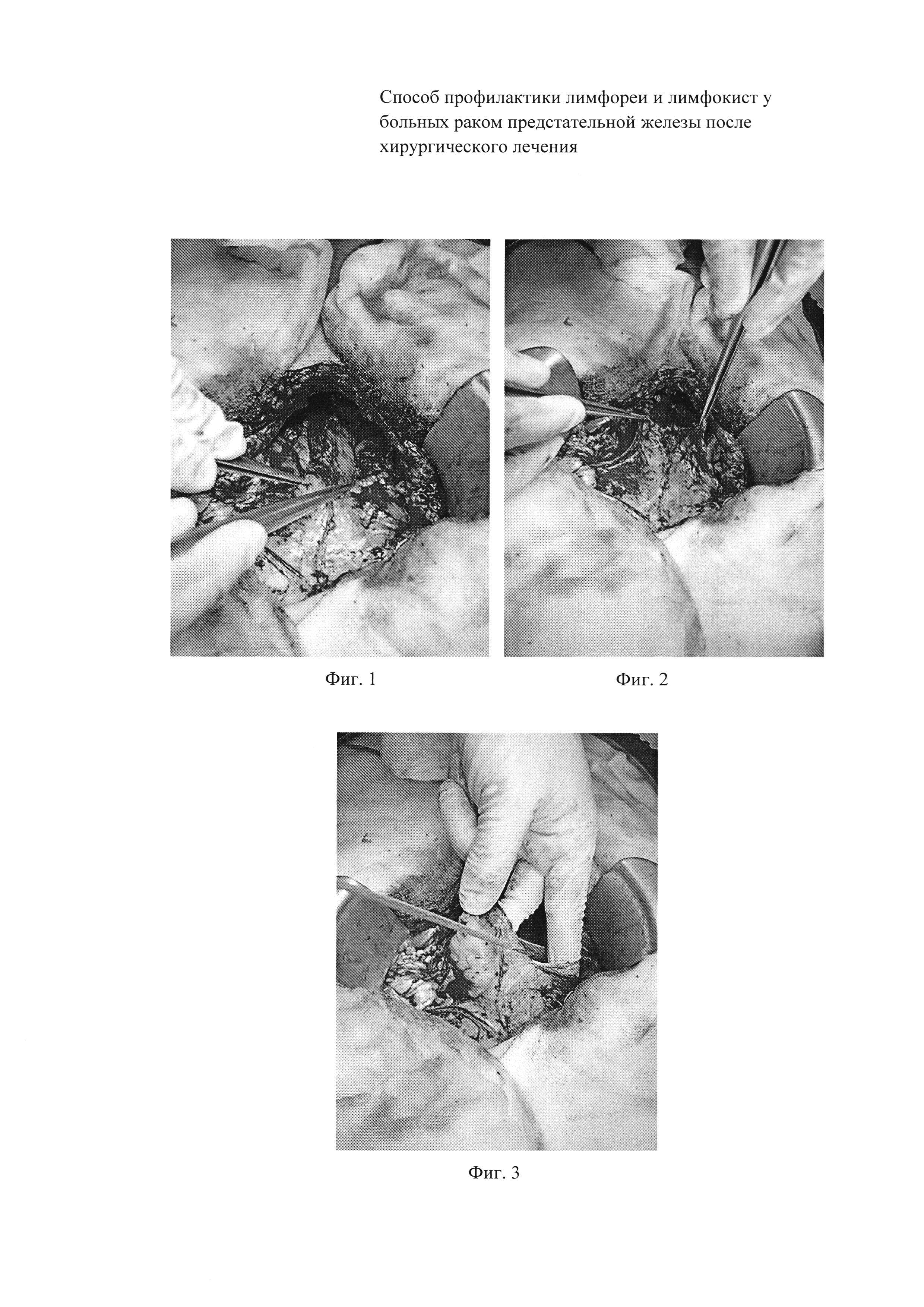
Противопоказания к проведению
Локализованные формы злокачественных новообразований, метастазы которых не распространились на соседние органы — основное показание для хирургического удаления железы. Операция может значительно повысить качество жизни, а в некоторых случаях излечить заболевание полностью.

На начальных стадиях онкология протекает практически без симптомов. Зачастую расстройства мочеиспускания и другие симптомы относят к простатиту или аденоме, поэтому мужчина откладывает визит к врачу. В итоге, патологию диагностируют на поздней стадии, когда опухоль уже распространилось на соседние органы и образовались метастазы. К сожалению, в этом случае полное выздоровление невозможно. Хирургическое удаление позволяет лишь устранить затруднения оттока мочи.
Оперативное вмешательство выполняют под общей анестезией.
- Заболевания, связанные со свертываемостью крови.
- Возраст мужчины старше 70 лет.
- Обострение воспаления любой природы.
- Последняя стадия рака.
- Применение препаратов, разжижающих кровь.
Прекратить прием таких препаратов необходимо как минимум за неделю до операции. Врач может отказаться от проведения операции, если риск для жизни пациента выше ожидаемого результата.
Выполнения радикальной простатэктомии
Метод операции выбирают с учетом возраста пациента, противопоказаний и возможных осложнений. Простатэктомию выполняют несколькими способами, отличающихся методом введения инструментов и применяемом медицинском оборудовании.
На сегодняшний день применяют три метода проведения операции:
Позадилонная простатэктомия. В нижней части живота выполняют разрез и удаляют простату позади лобковой кости. Уретру хирург вшивает непосредственно в мочевой пузырь. В ходе операции возможно удаление лимфоузлов. Нервный пучок, отвечающий за удержание мочи и эрекцию, стараются сохранить. Период реабилитации после операции таким методом обычно занимает несколько дней.
Промежностная простатэктомия. Современная хирургия редко прибегает к этой операции. Во время операции хирург выполняет разрез в промежности длиной около 4 см и удаляет простату сзади. При таком методе сохранить нервный пучок гораздо сложнее. Доступа к лимфоузлам, которые часто удаляют вместе с простатой, практически нет. Для их удаления хирург делает отдельный разрез. Период восстановления после операции таким методом может быть короче, чем при позадилобковой простатэктомией.

Послеоперационный период

Период реабилитации зависит от выбранного метода удаления. Пациент находиться в стационаре от недели до месяца. После хирургического вмешательства из мочевого пузыря выводят катетер, который не снимают три недели. В первые дни после операции назначают анальгетики. Наложенные после операции швы, снимают на протяжении недели, а дренажи на 5 сутки.

В период реабилитации пациент должен внимательно следить за своим здоровьем и строго следовать указаниям специалиста.
Предстательная железа вырабатывает простат специфический антиген. После полного удаления органа, уровень ПСА должен приближаться к нулю. Значение полностью стабилизируется через месяц.После оперативного вмешательства уровень ПСА наблюдают в динамике. Повышение объема всего на 2 нг/мл, указывает на возвращение онкологической патологии.Основные критерии диагностики:
- Динамика ПСА. Перианальные и периуретральные железы продуцируют небольшой процент ПСА. Незначительное увеличение объема антигена допускается сразу после хирургического вмешательства.
- Современная оценка ПСА. В расчет берут показатели только через месяц после операции. Стабильное нарастание уровня антигена спустя месяц или полгода указывает на рецидив рака простаты.
- Причина роста ПСА. Не удаленные при операции метастазы, проникшие в лимфатические узлы и близлежащие ткани. Чтобы вероятность возращения онкологии свести к нулю, операцию проводят совместно с другими методами терапии: гормонами и химией.
Ошибки, допущенные в ходе операции, могут стать причинами развития осложнений. Восстановления пациента зависит от квалификации специалиста.
Перед операцией лечащий врач должен оповестить пациента о возможных последствиях операции.
Наиболее частые осложнения:
Болевые ощущения в области малого таза, промежности и хирургического шва. В первые дни назначают сильные обезболивающие. После стабилизации состояния переходят на анальгетики.
Недержание мочи. Распространенное осложнение, которое связанно с изменениями структуры тканей в мышцах. Функция восстанавливается постепенно. Пациенту в первые дни устанавливают катетер. Специальные физические упражнения позволяют вернуть функции в полном объеме. Позывы к мочеиспусканию постепенно снижаются. Дренаж удаляют после нормализации мочеиспускания.
Воспалительный процесс. Может развиться вследствие попадания в рану бактерий, либо оставленных частичек железы. Для предотвращения сепсиса, назначают прием антибактериальных препаратов.
Кровь в моче. Симптом временный и проходит самостоятельно уже через двое суток после госпитализации.
Лимфостаз и лимфорея. Отечность ног, вследствие скапливания жидкости. Без адекватного лечения все может закончиться летальным исходом.
Сексуальная жизнь. Развивается временная импотенция. Устраняют эректильную дисфункцию с помощью медикаментозных средств, приемов гормонов и выполнения специальных упражнений. В 70-80% случаев восстановить потенцию удается.
Мочевой свищ. Является результатом грубой ошибки хирурга во время выполнения операции. Для определения локализации нарушения проводят диагностику и выполняют операцию с целью закрытия свищей мочевого пузыря.
Одно из серьезных побочных явлений после проведения операции – эректильная дисфункция. Возле предстательной железы находятся нервы, которые контролируют эту функцию. Во время операции они часто повреждаются, либо удаляются вовсе. Чтобы сохранить эрекцию, во время операции эти нервы изолируют.
Эректильная функция со временем восстанавливается примерно у половины мужчин.
- Имел ли мужчина проблемы с эрекцией до операции.
- Не повреждены ли нервы, отвечающие за эрекцию.
- Преклонный возраст пациента.
Восстановить сексуальную функцию мужчинам помогут лекарственные средства и механические приспособления. Ситуацию необходимо обсудить с лечащим врачом.

Сфинктер. Стабилизируют функции мышечной ткани и стимулируют приток крови. Упражнения для сфинктера оказывают положительное влияние на функционирование прямой кишки и облегчают проявления геморроя, который зачастую сопутствует опухоли простаты.
Мочевой пузырь. Упражнения укрепляют мышцы тазового дна. Мочеиспускание стабилизируется, пациент может контролировать процесс, учась управлять мышцами пузыря.
Удержание мочи. Комплекс движений гимнастики по Кегелю помогают выполнять основные функции мочевого пузыря. Самопроизвольное мочеиспускание постепенно прекращается.
Рацион питания после операции практически не отличается от диеты при любой онкологии любого другого органа. Чтобы вывести из организма остатки тканей, и предотвратить сепсис, в первые сутки пациенту рекомендуют обильное питье.Пищи принимают небольшими порциями 5-6 раз в день. Рацион пациента должен быть сбалансированным и полноценным. В период реабилитации оптимально подойдет лечебный стол №5. Во время восстановления рекомендуют японскую или средиземноморскую диеты.
