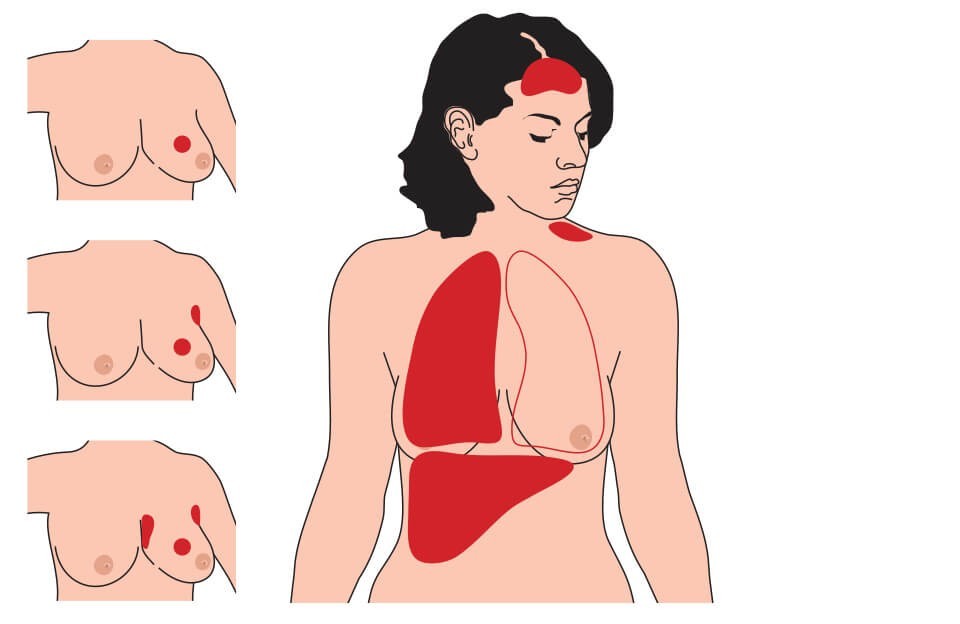
Причина метастазирования рака
Пути метастазирования рака
Существует три пути распространения опухоли:
Преимущественный путь метастазирования рака зависит от типа опухоли и ее локализации. Многие новообразования распространяются по телу несколькими способами.
Лимфатические сосуды, реже — кровеносное русло; метастазы обнаруживают преимущественно в печени, иногда — в легких, надпочечниках, костях. Возможен также рост новообразования на брюшине, если неоплазия с ней физически соприкасается.
Как правило, лимфогенный путь. Чаще всего клетки новообразований попадают в регионарные лимфоузлы и начинают там расти. Отдаленное метастазирование встречается реже, в основном в кости и легкие. Гематогенный путь характерен для значительного поражения органа и поздних стадий заболевания.
Типичны все пути метастазирования: лимфогенный (лимфатические узлы, печень), гематогенный (печень, кости, надпочечники), имплантационный (опухоли плевры).
Особенности метастазирования рака отдельных органов
Диагностируют нечасто. В основном обнаружение метастазов рака печени связано с запущенной формой болезни. Излюбленные места локализации метастазов – легкие и кости.
Чаще всего метастазирует в брюшину (оболочку, которая выстилает брюшную полость), сальник (жировая складка, которая как фартук прикрывает органы брюшной полости), органы брюшной и тазовой полостей.
Часто прорастает во влагалище, матку, прямую кишку, мочевой пузырь, реже затрагиваются кости, нервы, печень, легкие, кости.
В основном дает метастазы в почечную вену, обеспечивающую отток крови от почки. Затем возможно дальнейшее распространение в надпочечники или полую вену. Самые вероятные отдаленные локализации – легкие и кости.
Клетки опухолей тонкого кишечника распространяются преимущественно лимфогенным путем. Поэтому чаще всего вторичные новообразования обнаруживают на брюшине, в регионарных лимфатических узлах, сальнике, легких, печени.
Характерные зоны вторичных новообразований – легкие и печень. В отдельных случаях метастазы обнаруживают в костях и головном мозге.
Те же особенности, что и для толстой. Главное различие – способность опухоли прорастать в прилегающие ткани (нервы, кости).
Преимущественно вблизи мочевого пузыря, к примеру, на поверхности тазовой полости.
Чаще всего метастазирует в кости, гораздо реже – в печень и легкие.
Немеланомные разновидности рака кожи метастазируют очень редко и поражают регионарные лимфатические узлы. А вот для меланомы это – типичное явление. Метастазы находят в печени, легких, костях, головном мозге.
Характерно поражение близлежащих органов и тканей брюшной полости, а также легких.
Симптомы и признаки
При метастатическом раке у пациентов далеко не всегда возникают жалобы. Если же они есть, то их характер зависит от типа опухоли, ее локализации, размера. Некоторые наиболее распространенные симптомы метастатического рака включают:
- боль;
- переломы (при поражении костей);
- головную боль, припадки, головокружение (если затронут головной мозг);
- одышку (при вовлечении легких);
- желтушность слизистых, увеличение печени (при поражении этого органа).
Диагностика
Все диагностические подходы можно разделить на две большие группы:
а) у человека установлено первичное онкологическое заболевание. Основываясь на истории болезни и типе опухоли, врач оценивает вероятность метастазов и их возможную локализацию. По результатам заключения для пациента составляют план обследований, чтобы контролировать наиболее проблемные зоны.
б) метастатический рак диагностировали раньше, чем основное заболевание. Некоторые опухоли способны долго расти, не проявляя себя. Поэтому обращаются к врачам с проблемами, которые вызваны уже метастазами. Тогда начинают поиск первичной опухоли.
Во обоих случаях набор диагностических тестов зависит от локализации и вида новообразований.
Лечение
Лечение метастатического рака зависит от:
- характеристик первичной онкологической проблемы;
- степени распространения в организме и тканях;
- возраста и общего состояния пациента.
План ведения пациента включает один или несколько типов лечения:
- хирургическое вмешательство;
- химиотерапию;
- радиотерапию;
- таргентную терапию.
Дополнительно пациенту назначают процедуры и препараты, помогающие справиться с симптомами заболевания или смягчить побочные действия противоопухолевого лечения.
Сколько живут при метастазировании рака: прогноз
Прогноз может быть очень разным. В одних случаях врачи способны вылечить или приостановить прогрессирование болезни, в других – прогноз очень осторожный.
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Шкурников М.Ю., Макарова Ю.А., Князев Е.Н., Зотиков А.А., Нюшко К.М.
Введение. Метастазы в лимфатические узлы при раке предстательной железы (РПЖ) являются неблагоприятным прогностическим фактором. Разработка неинвазивных методов диагностики метастазов имеет важное клиническое значение. Цель исследования – поиск циркулирующих микроРНК-маркеров метастазов в лимфатические узлы и изучение взаимосвязи профилей экспрессии дифференциально экспрессированных микроРНК плазмы и их генов-мишеней в первичных опухолях.Материалы и методы. Собрана коллекция из 10 образцов плазмы крови больных РПЖ стадии pN0M0 и 10 образцов стадии pN1M0. Профили экспрессии микроРНК плазмы проанализированы на чипах GeneChip miRNA 4.0 (Affymetrix, США). Для микроРНК с различием уровня экспрессии между двумя группами не менее чем в 2 раза (p микроРНК в плазме крови. Анализ профилей экспрессии образцов первичных опухолей показал, что из 88 генов, уровень экспрессии которых изменился в 1,5 раза и более, 11 служат мишенями 17 обнаруженных нами микроРНК . Интересно, что в большинстве (8 из 11) случаев экспрессия генов-мишеней в первичной опухоли возрастает.Заключение. Обнаружено снижение уровня экспрессии 17 микроРНК плазмы крови у больных РПЖ с метастазами в лимфатические узлы (pN1M0) по сравнению с больными без метастазов (pN0M0). Анализ транскриптомов первичных опухолей позволяет предполагать, что обнаруженные в плазме изменения отражают происходящие в процессе лимфогенного метастазирования изменения профилей экспрессии микроРНК и их генов-мишеней в первичных опухолях. Обнаруженные микроРНК могут служить потенциальными маркерами лимфогенного метастазирования при РПЖ.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Шкурников М.Ю., Макарова Ю.А., Князев Е.Н., Зотиков А.А., Нюшко К.М.
Circulating microRNA expression in connection with prostate cancer lymphogenous metastasis
Экспрессия циркулирующих микроРНК в связи с лимфогенным метастазированием рака предстательной железы
М.Ю. Шкурников, Ю.А. Макарова, Е.Н. Князев, А.А. Зотиков, К.М. Нюшко, Б.Я. Алексеев, А.Д. Каприн
Контакты: Максим Юрьевич Шкурников mshkurnikov@imscs.msu.ru
Введение. Метастазы в лимфатические узлы при раке предстательной железы (РПЖ) являются неблагоприятным прогностическим фактором. Разработка неинвазивных методов диагностики метастазов имеет важное клиническое значение. Цель исследования — поиск циркулирующих микроРНК-маркеров метастазов в лимфатические узлы и изучение взаимосвязи профилей экспрессии дифференциально экспрессированных микроРНК плазмы и их генов-мишеней в первичных опухолях. Материалы и методы. Собрана коллекция из 10 образцов плазмы крови больных РПЖ стадии pN0M0 и 10 образцов стадии pN1M0. Профили экспрессии микроРНК плазмы проанализированы на чипах GeneChip miRNA 4.0 (Asymetrix, США). Для микроРНК с различием уровня экспрессии между двумя группами не менее чем в 2 раза (p 2; p 1,5; p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Выделение плазмы осуществляли согласно разработанному ранее протоколу, минимизирующему гемолиз и выход микроРНК из форменных элементов крови [5]. Уровень гемолиза оценивали спектрофотометрически [6]. Выделение тотальной РНК производили из 200 мкл плазмы крови путем гуанидин-тиоцианат-фенол-хло-роформной экстракции с последующей сорбцией на кремниевой мембране с помощью набора реагентов miRNeasy Serum/Plasma Kit (Qiagen, Германия) согласно протоколу производителя.
Образцы РНК анализировали с помощью микрочипов GeneChip miRNA 4.0 (Affymetrix, США), детектирующих все некодирующие и малые РНК, входящие в базу данных miRBase v. 20, включая зрелые и незрелые микроРНК. Совместную предобработку CEL-файлов и оценку экспрессий индивидуальных наборов проб осуществляли с помощью пакета программного обеспечения Transcriptome Analysis Console (сборка 4.0.0.25) в режиме ANOVA eBayes. Из анализа были исключены микроРНК с кодами MIMAT более 2000, поскольку большинство из них являются слабо верифицированными. МикроРНК с разницей представленности между группами miR-pN0M0 и miR-pN1M0 не менее чем в 2 раза и уровнем достоверности p 20 2 2 22 4
Уровень простатического специфического
антигена (среднее значение ± стандартное
отклонение), нг/мл 11,4 ± 9,7 8,2 ± 8,9 32,9 ± 189,7 23,8 ± 122,2
Prostate-specific antigen level (mean ± standard
Примечание. Все эксперименты проводились в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации.
Note. All experiments were conducted in accordance with the World Medical Association Declaration of Helsinki.
u Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
2 hsa-miR-92a-3p MIMAT0000092 -11,22 0,0031
3 hsa-miR-320a MIMAT0000510 -7,34 0,0031
4 hsa-miR-451a MIMAT0 001 631 -6,94 0,0328
5 hsa-miR-17-5p MIMAT0000070 -6,35 0,0011
6 hsa-let-7c-5p MIMAT0000064 -6,18 0,0013
7 hsa-miR-93-5p MIMAT0000093 -4,62 0,0035
8 hsa-let-7b-5p MIMAT0000063 -4,6 0,0031
9 hsa-miR-191-5p MIMAT0000440 -4,49 0,0044
10 hsa-miR-185-5p MIMAT0000455 -4,24 0,0318
11 hsa-miR-23a-3p MIMAT0000078 -3,87 0,0031
12 hsa-miR-106a-5p MIMAT0000103 -3,52 0,0062
13 hsa-miR-26a-5p MIMAT0000082 -3,14 0,0035
14 hsa-miR-126-3p MIMAT0000445 -2,91 0,0044
15 hsa-miR-24-3p MIMAT0000080 -2,67 0,0373
16 hsa-miR-25-3p MIMAT0000081 -2,33 0,0034
17 hsa-miR-20a-5p MIMAT0000075 -2,06 0,014
Примечание. Жирным шрифтом выделены названия микроРНК, которые входят в число 10 наиболее высокопредставленных в плазме.
Note. MicroRNAs among the ten most abundant in plasma are shown in bold.
Среди потенциальных мишеней этих микроРНК, определенных с помощью miRTarBase, оказалось 2828 генов, каждый из которых является мишенью по меньшей мере для 2 из них.
Были проанализированы данные секвенирования РНК образцов первичных опухолей предстательной железы, содержащиеся в базе данных TCGA. Сравнительный анализ 2 групп (seq-pN0M0 и seq-pN1M0) показал, что 88 генов имеют значимую (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
6 RRM2 8 1,69 0,0159
7 BIRC5 3 1,66 0,0343
8 MELK 4 1,65 0,0358
9 SMOC1 4 —2,00 0,0402
10 ACPP 2 —2,01 0,0012
11 ANPEP 2 —3,95 0,0014
u 8) по сравнению с высоко-дифференцированными формами (сумма баллов по шкале Глисона 6) [22]. Таким образом, наши данные для плазмы крови согласуются с полученными ранее для тканей предстательной железы и могут свидетельствовать о том, что, помимо клеток крови, изменения экспрессии микроРНК предстательной железы также вносят вклад в изменения уровней микроРНК hsa-miR-16 и hsa-miR-92 плазмы.
Только 5 из 17 микроРНК, детектированных нами (см. табл. 2), входят в десятку наиболее высокопред-ставленных микроРНК плазмы. Это позволяет предполагать, что изменения уровней циркулирующих микроРНК связаны не только с клетками крови. В пользу этого предположения свидетельствует и то, что из 9 микроРНК, высвобождающихся в плазму при гемолизе эритроцитов (они же присутствуют в нормальной плазме вследствие секреции эритроцитами) [5], экспрессия 3 (hsa-miR-20b, hsa-miR-107 и hsa-miR-486) не меняется у групп miR-pN0M0 и miR-pN1M0.
С другой стороны, по данным крупномасштабного секвенирования все 17 микроРНК (см. табл. 2) обнаружены в ткани предстательной железы. Более того, они входят в 18 % наиболее высокопредставленных микроРНК предстательной железы [23]. Сравнение профилей экспрессии микроРНК первичных
опухолей у больных с метастазами в лимфатические узлы и без них (рТ2 /Т3Ш и рТ2 /T3N0) показало, что из 17 детектированных нами микроРНК в группе рТ2/Т3Ш снижается экспрессия 13 (hsa-miR-16-5p, hsa-miR-92a-3p, hsa-miR-320a, hsa-miR-451a, hsa-miR-17-5р, hsa-let-7c-5p, hsa-miR-93-5p, hsa-let-7b-5p, Ьва-miR-191-5p, hsa-miR-106a-5p, hsa-miR-26a-5p, hsa-miR-25-3p, hsa-miR-20a-5p) [23]. Это позволяет предполагать, что наблюдаемые нами изменения профиля микроРНК плазмы в большой степени обусловлены изменением экспрессии микроРНК в ткани опухоли.
При анализе базы данных TCGA нами обнаружено, что из 88 генов, экспрессия которых отличается в первичных опухолях групп seq-pN0M0 и seq-pN1M0, 11 генов служат мишенями 2 и более детектированных нами микроРНК (см. табл. 3). Экспрессия 8 из этих генов повышена в группе seq-pN1M0, причем все они являются онкогенами. Это соответствует предположению о том, что наблюдаемые изменения профиля микроРНК плазмы обусловлены снижением уровня микроРНК в первичной опухоли. Результат этого снижения — повышение экспрессии генов-мишеней. Альтернативным является предположение о том, что изменение уровня микроРНК в плазме вызвано изменениями метаболизма клеток микроокружения
опухоли или других клеток организма в результате усиливающегося влияния растущей опухоли на организм. В этом случае микроРНК плазмы могли быть абсорбированы опухолью и оказали влияние на экспрессию опухолевых генов. Вопрос о возможной коммуникации между клетками организма с помощью циркулирующих микроРНК в настоящее время широко обсуждается. Получены убедительные доказательства ее существования, в том числе между нормальными и опухолевыми клетками [2, 4]. Дальнейшие исследования могут прояснить, какой из этих 2 сценариев реализован в данном случае.
В ходе настоящего исследования обнаружено снижение уровня экспрессии 17 микроРНК плазмы у больных РПЖ с метастазами в лимфатические узлы (рШМО) по сравнению с пациентами без метастазов (р^МО). Анализ транскриптомов первичных опухолей позволяет предполагать, что выявленные в плазме изменения отражают происходящие в процессе лим-фогенного метастазирования изменения профилей экспрессии микроРНК и их генов-мишеней в первичных опухолях. Поэтому обнаруженные микроРНК могут служить потенциальными маркерами лимфо-генного метастазирования при РПЖ.
1. Smith J.A., Seaman J.P., Gleidman J.B., Middleton R.G. Pelvic lymph node metastasis from prostatic cancer: influence of tumor grade and stage in 452 consecutive patients. J Urol 1983;130(2):290-2. PMID: 6876275.
2. Turchinovich A., Samatov T.R., Tonevit-sky A.G., Burwinkel B. Circulating miRNAs: cell-cell communication function? Front Genet 2013;4:119. DOI: 10.3389/ fgene.2013.00m. PMID: 23825476.
3. Peinado H., Zhang H., Matei I.R. et al. Pre-metastatic niches: organ-specific homes for metastases. Nat Rev Cancer 2017;17(5):302-17. DOI: 10.1038/ nrc.2017.6. PMID: 28303905.
4. Makarova J.A., Shkurnikov M.U., Wicklein D. et al. Intracellular and extracellular microRNA: an update on localization and biological role. Prog Histochem Cytochem 2016;51(3-4):33-49. DOI: 10.1016/j. proghi.2016.06.001. PMID: 27396686.
5. Shkurnikov M.Y., Knyazev E.N., Fomi-cheva K.A. et al. Analysis of plasma microRNA associated with hemolysis. Bull Exp Biol Med 2016;160(6):748-50. DOI: 10.1007/s10517-016-3300-y. PMID: 27165077.
6. Шкурников М.Ю., Макарова Ю.А., Князев Е.Н. и др. Профиль микроРНК
плазмы крови здоровых доноров. Бюллетень экспериментальной биологии и медицины 2015;160(11):577—9. [Shkurnikov M.Yu., Makarova Yu.A., Knyazev E.N. et al. Profile of microRNA in blood plasma of healthy humans. Bulleten eksperimentalnoy biologii i meditsiny = Bulletin of Experimental Biology and Medicine 2015;160(11):577-9. (In Russ.)].
7. Chou C.H., Chang N.W., Shrestha S. et al. miRTarBase 2016: updates to the experimentally validated miRNA-target interactions database. Nucleic Acids Res 2015;44(D1):D239-47. DOI: 10.1093/ nar/gkv1258. PMID: 26590260.
8. Brenu E.W., Ashton K.J., Batovska J. et al. High-throughput sequencing of plasma microRNA in chronic fatigue syndrome/ myalgic encephalomyelitis. PLoS One 2014;9(9):e102783. DOI: 10.1371/journal. pone.0102783. PMID: 25238588.
9. Williams Z., Ben-Dov I.Z., Elias R. et al. Comprehensive profiling of circulating microRNA via small RNA sequencing
of cDNA libraries reveals biomarker potential and limitations. Proc Natl Acad Sci USA 2013;110(11):4255-60. DOI: 10.1073/ pnas.1214046110. PMID: 23440203.
10. Liao W., Huang G., Liao Y. et al. High KIF18A expression correlates with unfa-
vorable prognosis in primary hepatocellular carcinoma. Oncotarget 2014;5(21):10271-9. DOI: 10.18632/ oncotarget.2082. PMID: 25431949.
11. Zhang W., He W., Shi Y. et al. High expression of KIF20A is associated with poor overall survival and tumor progression
in early-stage cervical squamous cell carcinoma. PLoS One 2016;11(12):e0167449. DOI: 10.1371/journal.pone.0167449. PMID: 27941992.
12. Chen Z., Zhang C., Wu D. et al. Phospho-MED1-enhanced UBE2C locus looping drives castration-resistant prostate cancer growth. EMBO J 2011;30(12):2405-19. DOI: 10.1038/emboj.2011.154.
13. Kuner R., Falth M., Pressinotti N.C. et al. The maternal embryonic leucine zipper kinase (MELK) is upregulated in high-grade prostate cancer. J Mol Med (Berl) 2013;91(2):237-48. DOI: 10.1007/s00109-012-0949-1. PMID: 22945237.
14. Duxbury M.S., Whang E.E. RRM2 induces NF-kappaB-dependent MMP-9 activation and enhances cellular invasiveness. Biochem Biophys Res Commun 2007;354(1):190-6. DOI: 10.1016/j. bbrc.2006.12.177. PMID: 17222798.
15. Kishi H., Igawa M., Kikuno N. et al. Expression of the survivin gene in prostate cancer: correlation with clinicopathologi-cal characteristics, proliferative activity and apoptosis. J Urol 2004;171(5): 1855-60. DOI: 10.1097/01. ju.0000120317.88372.03.
16. Pritchard C.C., Kroh E., Wood B. et al. Blood cell origin of circulating micro-RNAs: a cautionary note for cancer bio-marker studies. Cancer Prev Res (Phila) 2012;5(3):492-7. DOI: 10.1158/1940-6207.CAPR-11-0370. PMID: 22158052.
17. Cheng H.H., Yi H.S., Kim Y. et al. Plasma processing conditions substantially influence circulating microRNA biomarker levels. PLoS One 2013;8(6):e64795.
DOI: 10.1371/joumaLpone.0064795. PMID: 23762257.
18. Mitchell P.S., Parkin R.K., Kroh E.M. et al. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci USA 2008;105(30):10513-8. DOI: 10.1073/ pnas.0804549105. PMID: 18663219.
19. Mahn R., Heukamp L.C., Rogenhofer S. et al. Circulating microRNAs (miRNA) in serum of patients with prostate cancer. Urology 2011;77(5):1265.e9-16.
DOI: 10.1016/j.urology.2011.01.020. PMID: 21539977.
20. Musumeci M., Coppola V., Addario A.
et al. Control of tumor and microenvironment cross-talk by miR-15a and miR-16 in prostate cancer. Oncogene
2011;30(41):4231-42. DOI: 10.1038/ onc.2011.140. PMID: 21532615.
21. Bonci D., Coppola V., Musumeci M. et al. The miR-15a-miR-16-1 cluster controls prostate cancer by targeting multiple oncogenic activities. Nat Med 2008;14(11):1271-7. DOI: 10.1038/nm.1880. PMID: 18931683.
22. Walter B.A., Valera V.A., Pinto P.A., Merino M.J. Comprehensive microRNA profiling of prostate cancer. J Cancer 2013;4(5):350-7. DOI: 10.7150/jca.6394. PMID: 23781281.
23. Hart M., Nolte E., Wach S. et al. Comparative microRNA profiling of prostate carcinomas with increasing tumor stage
by deep sequencing. Mol Cancer Res 2014;12(2):250-63. DOI: 10.1158/1541-7786.MCR-13-0230. PMID: 24337069.
