Говоров А.В 1 ., Шадеркин И. А 2 .
Введение.
Криотерапия представляет собой аблацию ткани путём локального воздействия очень низкой температуры. Более полное определение этого термина предложено B.Patel и соавт., которые считают криоаблацию процессом локального замораживания и девитализации тканей, позволяющим прицельно создать зону некроза необходимой формы и размера для деструкции поражённой ткани и прилежащих по краю здоровых клеток.
В 1996 г. Американская ассоциация урологов признала криоаблацию простаты методом терапии локализованного рака предстательной железы (РПЖ) и перестала считать данную методику экспериментальной. В Guidelines Европейской ассоциации урологов 2009 года криоаблация простаты также отнесена к альтернативным методам лечения злокачественной опухоли предстательной железы. В настоящее время криоаблация простаты представляет собой минимально инвазивный, высоко эффективный способ лечения РПЖ. Лечение проводится стационарно и амбулаторно, сопровождается небольшим количеством осложнений и позволяет добиться высокой безрецидивной выживаемости.
Первая криоаблация простаты была проведена в 1966 г. M.Gonder и соавт. с использованием одного трансуретрального датчика (иглы) 26 Fr для лечения инфравезикальной обструкции, вызванной увеличением предстательной железы. В 1974 г. M.Megalli и соавт. впервые применили введение криоиглы через прокол кожи промежности.
Криобиология.
Основными факторами, обеспечивающими действие на ткань низкой температуры, являются механический и осмотический эффекты, а также клеточная гипоксия. При криоаблации происходят денатурация белка вследствие дегидратации, переход внутриклеточной воды в экстрацеллюлярное пространство и разрыв клеточных мембран из-за образования кристаллов льда. Создаётся токсическая концентрация внутриклеточных компонентов; после быстрого замораживания и медленного оттаивания наступают термальный шок, сосудистый стаз, усиливается апоптоз.
Основными параметрами, коррелирующими с вероятностью гибели опухолевых клеток, являются быстрота замораживания ткани и достигнутая минимальная температура (табл. 1).
Таблица 1. Факторы, влияющие на гибель опухолевых клеток при криотерапии.
- Длительность замораживания
- Минимальная достигнутая температура
- Число циклов замораживания и оттаивания
- Скорость замораживания
- Скорость оттаивания
Оборудование, используемое для криоаблации простаты.
Для проведения криоаблации простаты необходимо наличие бипланового ректального ультразвукового датчика, обеспечивающего визуализацию предстательной железы как в продольной, так и в поперечной проекциях, а также пошагового стабилизирующего устройства. В аппаратах для криотерапии в качестве криогена используется аргон (под очень высоким давлением). Гелий применяется для размораживания ткани.
Рисунок 1. Иглы для криоаблации простаты; сверху вниз – 1-го, 2-го и 3-го поколений. Самая нижняя – игла для биопсии простаты 18 G.
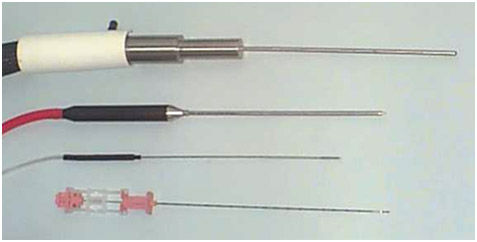
Для предохранения слизистой оболочки мочеиспускательного канала и наружного сфинктера от замораживания используется катетер, согревающий уретру. При помощи водяной помпы по двойному внутреннему просвету катетера в ходе всей операции циркулирует физиологический раствор, подогретый до +38-43°С со скоростью около 550 мл/мин.
Отбор пациентов для криотерапии.
Криоаблация простаты применяется как в виде первичного лечения, так и в качестве сальважной терапии.
Криотерапия простаты показана больным с локализованным РПЖ высокой степени злокачественности и / или опухолью большого объёма в том случае, если пациенты не заинтересованы в сохранении эректильной функции.
Также довольно часто криоблация используется в следующих случаях:
- у больных с клинически местнораспространённым раком (стадия Т3);
- у больных с такой стадией заболевания или степенью злокачественности опухоли, которые с высокой вероятностью будут прогрессировать без лечения (сумма баллов по Глисону ≥6, стадия >Т1а);
- у больных, не являющихся кандидатами для выполнения радикальной простатэктомии (страдающих болезнью Крона, язвенным колитом, выраженной кардиальной патологией, ожирением (вес более 150 кг));
- у больных неметастатическим раком простаты с ожидаемой продолжительностью жизни более 10 лет, которые, ознакомившись со всеми существующими методами лечения, предпочли именно криотерапию.
При помощи криоаблации предстательной железы также возможно лечение рецидива рака после лучевой терапии (дистанционной или внутритканевой).
Описано также применение криоаблации простаты при лечении местных рецидивов опухоли после радикальной простатэктомии, а также у больных местнораспространённым раком, получающих гормональную терапию, для предупреждения инфравезикальной обструкции или геморрагических осложнений.
Если объём предстательной железы превышает 50 см3, пациентам нередко назначается неоадъювантная гормонотерапия. По данным M.Ghafar и соавт., трехмесячная неоадъювантная андрогенная депривация приводит к увеличению расстояния между основанием простаты и стенкой прямой кишки, что важно для минимизации числа осложнений лечения.
Оптимальный срок для криоаблации простаты у больных с ростом уровня ПСА после лучевой терапии до конца не определён. Как правило, криотерапия не проводится раньше, чем через 18 месяцев после лучевой терапии, а решение о её начале принимается после выполнения контрольной биопсии предстательной железы.
Противопоказания к криоаблации простаты.
Относительные противопоказания к проведению криодеструкции предстательной железы аналогичны таковым при брахитерапии и включают:
- предшествующую трансуретральную резекцию (ТУР) простаты с наличием выраженного ТУР-дефекта ткани;
- наличие выраженной инфравезикальной обструкции;
- большой объём простаты;
- брюшно-промежностную резекцию прямой кишки по поводу рака в анамнезе, ректальный стеноз или другие серьёзные заболевания прямой кишки.
Перенесенная трансуретральная резекция простаты значительно повышает риск образования струпа слизистой уретры и острой задержки мочи. Инфравезикальная обструкция значительной степени выраженности также крайне затрудняет восстановление мочеиспускания после криотерапии.
Особенности техники проведения криоаблации простаты.
Перед лечением проводятся бритьё промежности и подготовка кишечника путём приёма слабительных или выполнения очистительной клизмы. Под общей или спинальной анестезией пациент укладывается в положение для операций на промежности. В мочевой пузырь по уретре устанавливается катетер Фоли, который пережимают. При помощи пошагового стабилизирующего устройства фиксируется насадка для проведения игл, после чего биплановый ультразвуковой датчик вводится в прямую кишку.
Для минимизации риска формирования в последующем уретроректальной фистулы возможно введение путём инъекции 15-30 мл физиологического раствора между стенкой прямой кишки и задней поверхностью простаты.
После определения размеров простаты криоиглы 17 G вводятся в ткань предстательной железы под ультразвуковым контролем – всего 12-20 игл на расстоянии 1 см одна от другой и от уретры (рис. 2, 3). Иглы располагаются в три или четыре горизонтальных ряда, в зависимости от высоты простаты при поперечном сканировании.
Далее в зависимости от опыта и техники врача вводятся до 5 температурных датчиков: в зону наружного сфинктера, сосудисто-нервных пучков, в средний отдел простаты и зону фасции Денонвилье.
Рисунок 2. Схематическое изображение размещения игл в простате в поперечной проекции.
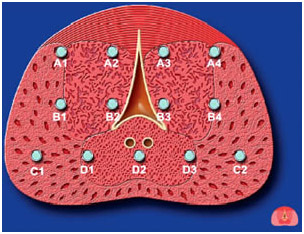
Рисунок 3. В прямую кишку введен ректальный ультразвуковой датчик, через насадку введена одна криоигла.
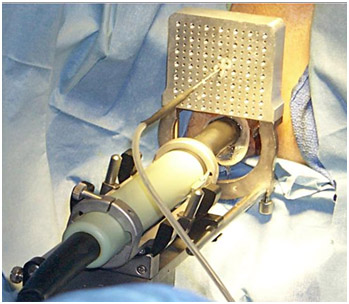
Температурные сенсоры в зоне наружного сфинктера и фасции Денонвилье используются для снижения риска недержания мочи или формирования уретроректальной фистулы, в то время как датчики в зоне обоих сосудисто-нервных пучков и в среднем отделе простаты позволяют контролировать адекватное замораживание ткани и достижение температуры -40°С. При этом температура в зоне наружного сфинктера, как правило, не опускается ниже 15 °С.
После введения всех игл выполняется фиброцистоскопия, чтобы убедиться, что нет перфорации стенки уретры. При необходимости осуществляется репозиция игл. Через рабочий канал фиброскопа в мочевой пузырь устанавливают проводник-струну, по которому проводится специальный катетер, согревающий уретру.
После завершения циклов замораживания и оттаивания простаты, катетер, согревающий уретру, оставляется в мочеиспускательном канале ещё на 5 минут. После извлечения криоигл осуществляется механическое давление на промежность в течение 2-5 минут, а затем накладывается повязка и устанавливается катетер Фоли.
В послеоперационном периоде назначаются пероральные фторхинолоны, обезболивающие препараты и альфа-блокаторы (не менее, чем на 1 месяц). Удаление уретрального катетера проводится через 7 дней. Если у пациента имеется цистостомическая дренажная трубка, начинают её пережимать также через 5-7 дней и удаляют после восстановления самостоятельного мочеиспускания при небольшом количестве остаточной мочи.
Дальнейшее наблюдение за пациентами осуществляется путём определения уровня общего ПСА крови каждые 3 месяца. Сразу после лечения уровень ПСА значительно возрастает вследствие клеточного некроза и поступления в кровь интрацеллюлярного ПСА.
Считается, что для достижения надира ПСА требуется 3 месяца. Вместе с тем, нет единого мнения об оптимальном надире ПСА после криотерапии. Наиболее часто используется пороговое значение 0,4 нг/мл.
Некоторые авторы выполняют трансректальную биопсию простаты всем пациентам через 6-12 месяцев после криоаблации простаты.
Осложнения криоаблации простаты.
В табл. 2 представлены осложнения криоаблации простаты при использовании оборудования 2 и 3 поколения. Очевидно, что за последние годы морбидность криотерапии значительно снизилась, особенно в сравнении с результатами лечения на оборудовании 1 поколения.
Таблица 2. Осложнения криоаблации простаты в зависимости от вида лечения (первичное или сальважное) и используемого оборудования.
Осложнения
Оборудование
2 поколения
(%)
Оборудование
3 поколения
(%)
Оборудование
2 поколения
(%)
Оборудование
3 поколения
(%)
Отхождение струпа уретры
*Включая ургентное недержание мочи при использовании оборудования 3 поколения.
По данным B.Donnelly, через 3 года после криодеструкции простаты у 47% пациентов эректильная функция восстанавливается (из них у 13% — без специального лечения). Авторы предположили, что данный феномен обусловлен постепенной регенерацией нервов, которые при криоаблации не пересекаются. Несмотря на эти наблюдения, считается, что криоаблация простаты не показана пациентам, заинтересованным в сохранении эректильной функции.
Отхождение струпа слизистой уретры встречается в 3,8% — 23% наблюдений. Лечение данного осложнения заключается в антибиотикотерапии и обеспечении адекватного отведения мочи. Иногда катетеризация способствует спонтанному отхождению некротических тканей, но в ряде случаев с этой целью применяется ТУРП.
Стриктура уретры или стеноз шейки мочевого пузыря редко формируются после криоаблации простаты при правильном использовании согревающего уретру катетера. При их образовании рекомендуется трансуретральная инцизия шейки мочевого пузыря и/или простаты, а также баллонная дилатация.
Ректоуретральная фистула ранее чаще имела место у больных с рецидивом рака после лучевой терапии (0 – 3%), тогда как за последние 4 – 5 лет данное осложнение практически не встречается, что обусловлено высоким качеством изображения современных ультразвуковых аппаратов, а также рутинным размещением температурных датчиков в области передней стенки прямой кишки. Диагностика уретроректальной фистулы помимо характерной клинической картины (пневматурия или выделение мочи из прямой кишки) включает в себя микционную уретрографию и компьютерную томографию, позволяющую определить локализацию свища.
Заключение.
16-19 марта 2010 года в ФГУ НИИ урологии Росмедтехнологий (Москва) и на кафедре урологии МГМСУ (на базе ГКБ № 50 г. Москвы) проведены первые в России операции криоаблации при раке предстательной железы и опухолях почек. Все операции прошли успешно, без осложнений. Теперь в двух ведущих клиниках России появилась еще одна возможность предложить своим пациентам малоинвазивный и высокотехнологичный метод лечения рака предстательной железы.
Криоаблация простаты – важная информация:
Криоабляция простаты – это локальное замораживание участка предстательной железы, пораженного раковой опухолью. В результате уничтожаются злокачественные образования и тонкий слой прилежащих здоровых клеток. Это позволяет предупредить рецидивы и дальнейшее распространение онкопроцесса.
При криотерапии под воздействием охлаждающего газа аргона образуется лед сначала в межклеточном пространстве, а затем и внутри клеток. Дальнейшая подача восстанавливающего нормальную температуру гелия вызывает резкое колебание температуры внутри тканей. При этом нарушается поступление питательных веществ, разрываются клеточные мембраны. В результате возникает необратимое повреждение и смерть раковых клеток.
Криоабляция является альтернативным и малоинвазивным методом терапии рака простаты. Эффективно помогает при лечении пациентов, у которых:
- риск развития метастазов низкий;
- противопоказано полное удаление простаты;
- обнаружена нечувствительность к лучевой и брахитерапии при имплантации радиоактивных элементов;
- возникли побочные эффекты радиоционной терапии;
- в молодом возрасте развилось раковое новообразование небольшого размера и дискретного типа, то есть состоящее из нескольких фрагментов.
Риск появления временной или постоянной импотенции составляет не менее 80%. Поэтому такой метод лечения является приоритетным для пациентов, не заинтересованных в сохранении сексуальной функции.
Криоабляцию опухоли предстательной железы выполняют в стационаре или поликлинике. Процедура длится полтора часа. С целью предупреждения переохлаждения мочеиспускательного канала и мочевого пузыря перед началом устанавливают уретральный катетер. Во время процедуры обеспечивают постоянную циркуляцию теплого физраствора.

Задайте вопрос врачу-урологу!

Под общим или регионарным обезболиванием аргон и гелий поочередно подают по специальным зондам, введенным через промежность. Трансректальный ультразвуковой контроль используют для прицельного создания ледяного шара. Также он позволяет предупредить повреждение прилежащих органов и наблюдать за изменениями в тканях. Воздействие низких температур проводят несколько раз. После окончания воздействия катетер оставляют в уретре на срок от 5 дней до 3 недель. Это обеспечивает своевременное выделение мочи даже в случае развития отека простаты.
Если у вас остались вопросы, задайте их в комментариях (это абсолютно анонимно и бесплатно). По возможности, я или другие посетители сайта помогут вам.
Современная термическая технология лечения рака простаты и почек
На вооружении современной науки появляется всё больше малоинвазивных методик, позволяющих эффективно воздействовать на ткани органов, поражённые раковой опухолью. Один из наиболее прогрессивных методов воздействия на раковые клетки получил название криоабляция. Это прицельное воздействие на раковые клетки при помощи замораживания.
Оно позволяет эффективно бороться с такими онкологическими заболеваниями, как рак почки и рак простаты. Замороженные клетки отмирают и опухоль прекращает распространение.
Эффективность криоабляции
Эта методика находится посредине между динамическим и радикальными методами, такими как лапароскопическая резекция, или нефрэктомия. При этом, криоабляция не уступает им по эффективности, являясь куда менее инвазивной процедурой. При минимальном травматизме врач получает возможность удалять опухоли, размер которых не превышает четырёх сантиметров.
Что касается опухолей в простате, то ещё совсем недавно радикальная простатэктомия не имела никаких альтернатив. Сейчас же у пациентов появляется шанс на спасение органа. При развитии подобных методик, возможно, они в будущем смогут заменить открытые операции и лапароскопию на начальных стадиях развития рака простаты.
Что происходит во время процедуры криоабляции?

В организм пациента вводится игла зонд, с помощью которой на опухоль подаётся аргон. Этот газ, предварительно охлаждённый до -40С, воздействует на клетки, вызывая в них образование льда. Кровообращение в этом участке прекращается. После этого через иглу подают гелий, нагретый до нормальной комнатной температуры. Резкий перепад вызывает внутри клеток разрыв мембран. Следствием этого становится коагуляционный некроз. Операция длится час. За это время врач дважды производит эти действия.
Для некоторых пациентов с диагнозом рак почки чрескожный доступ может быть невозможен, в связи с расположением раковой опухоли. В этом случае может проводиться лапароскопия, либо открытая операция. Врач принимает решение о выборе доступа, в зависимости от того, как локализована опухоль.
Этот метод эффективен, как основное лечение и при рецидивах, возникших после неудачи в применении других способов удаления опухоли. Его применяют при возникновении раковых опухолей не только в почечных тканях, но и в предстательной железе.
Такой доступ стал прекрасной альтернативой открытому и лапароскопическому, нисколько не уступая им по эффективности. Кроме того, он показан пациентам, которые в силу возраста, различных заболеваний (сердечных, или неврологических) могут не перенести общий наркоз.
В то же время, этот метод, в случае возникновения необходимости, не препятствует применению других способов доступа. Его преимущество в низком риске осложнений в ходе операции и после неё. В некоторых случаях могут возникать проблемы с эрекцией. Но с ними связаны любые методы лечения рака простаты.
Эффективность криоабляции зависит от того, на какой стадии находится развитие опухоли. Для определения проводятся различные тесты и анализы. В частности значение простат-специфического антигена в сыворотке крови, балла Глиссона, получаемого по заключению морфолога и другие биомаркеры рака.
В зависимости от онкологического риска криоабляция показывает различный процент эффективности, от 60% при высоком до 90 при низком.
В настоящее время Европейская ассоциация урологов рекомендует применять методику криогенного воздействия на опухоль для пациентов с низким и средним уровнем онкологического риска. Также важно обращать внимание на то, не задеты ли опухолью соседние органы.
Западные врачи уже достаточно давно и успешно применяют криоабляцию при таких заболеваниях, как рак простаты. В России данная методика появилась недавно, но уже активно внедряется в практику ведущими онкологическими центрами.
Этап освоения метода криохирургического лечения рака предстательной железы (РПЖ) начался в 1960-е годы с появлением криохирургических аппаратов, использующих в качестве хладагента жидкий азот.
Gonder предпринял первую попытку криогенного лечения простаты, используя трансуретральный доступ под пальпаторным трансректальным контролем.
Криодеструкция простаты (КД) первоначально выполнялась с паллиативной целью трансуретральным или чрезпузырным доступом.
Затем была предложена открытая промежностная криопростатэктомия, которая в последующем также не нашла широкого применения.
На этане внедрения метода в клиническую практику отмечалось большое количество осложнений, связанных с повреждением окружающих простату здоровых тканей, при этом онкоспецифические результаты лечения значительно уступали применяемым методам лечения РПЖ, в первую очередь радикальной простатэктомии. Проведенные в конце XX в. экспериментально-клинические исследования по протяженности зоны некроза внутри ледяного шара, введение ультразвукового исследования (УЗИ) как метода мониторирования криохирургических вмешательств привело к возрождению метода криодеструкции предстательной железы (ПЖ).
Предложенный в 1990-е годы G. Onic чрезкожный промежностный доступ в сочетании с интраоперационным ультразвуковым контролем и термометрией зоны вмешательства позволил существенно снизить травматичность метода и повысить его эффективность.
Физические и биологические основы применения криодеструкции
Физической основой метода криодеструкции является достижение гибели клеток путем их охлаждения до летальных температур.
Механизмы гибели клеток вследствие низкотемпературного повреждения изучены достаточно хорошо. Среди факторов, вызывающих деструкцию клеток при замораживании, авторы отмечают значительную дегидратацию клеток; механическое повреждение клеточных мембран и разрушение клеточных структур кристаллами льда; денатурацию фосфолипидов в клеточных мембранах; прекращение подвижности протоплазмы, или так называемый термальный шок; прекращение кровообращения в замороженной ткани, ведущее к развитию очага ишемического некроза.
Из экспериментальной криологии известно, что деструкция клеток во время оттаивания происходит не менее интенсивно, чем при замораживании. При оттаивании кристаллы льда внутри и вне клеток перемещаются (миграционная перекристаллизация), что усугубляет их деструктивное воздействие.
Температура цитодеструкции оценивается авторами по-разному. Уже в первых работах было обнаружено, что различные по гистологическому строению ткани имеют неодинаковую восприимчивость к холодовому воздействию. В большинстве проведенных исследований как in vivo, так и in vitro для клеток РПЖ была установлена летальная температура -40 С. Установлено, что внешняя, видимая при УЗИ граница ледяного шара не является границей зоны некроза тканей — между изотермой -40°С и наружным краем льда на расстоянии от 8 до 12 мм имеется зона частичного повреждения клеток (рис. 1.59).

Рис. 1.59. Схематичное изображение ледяного шара: С — криозонд; 1 — зона некроза тканей; 2 — зона частичного повреждения тканей (граница ледяного шара в ткани); 3 — зона гипотермии
Возможности радикального криогенного лечения злокачественных опухолей зависят от технических возможностей криогенной аппаратуры. Скорость падения температуры в активной части криозонда, величина наименьшей достигаемой температуры, способность формирования нужной по объему зоны крионекроза — эти немаловажные параметры напрямую зависят не только от диаметра применяемого криоаппликатора. но и от используемого в аппарате хладагента. Точки кипения основных хладагентов при атмосферном давлении представлены в табл. 1.39.
Таблица 1.39. Точки кипения основных хладагентов

В настоящее время основными используемыми хладагентами являются жидкий азот и аргон. В криогенных системах на жидком азоте хладагент циркулирует под давлением в жидком состоянии, закипая в области активной части криоэлектрода, забирая тепло из окружающих криозонд тканей. При использовании аргона в качестве хладагента принцип работы криоаппарата основан на эффекте охлаждения путем дросселирования жидкостей (эффект Джоуля-Томпсона).
Современные криоустановки, основанные на применении аргоногелиевой смеси, имеют заостренные аппликаторы диаметром от 1,4 до 2,4 мм. Диаметр формирующегося в тканях ледяного шара зависит от диаметра криоаппликатора, мощности криогенной установки, степени кровоснабжения замораживаемых тканей. Для криодеструкции предстательной железы используется несколько криозондов, при этом геометрия и объем общего ледяного шара зависят от взаимного расположения криозондов. В зависимости от желаемого объема крионекроза возможно использование от 1 до 8 криоаппликаторов.
Показания к применению криодеструкции простаты
Криодеструкция у первичных пациентов
Несмотря на то что КД является радикальным методом лечения РПЖ у пациентов в том числе с высоким риском проведения лечения, метод имеет некоторые ограничения в применении. В частности, большой объем предстательной железы (>60 см3) — относительное противопоказание к выполнению вмешательства. Это связано с трудностью охвата всего объема простаты критической изотермой -40 °С В данном случае рекомендуется применение неоадъювантной гормонотерапии, что позволяет уменьшить объем предстательной железы.
Показания к лимфодиссекций при планировании КД сходны с таковыми при ДЛТ. При уровне ПСА >20 нг/мл и показателе Глисона 8-10 вероятность поражения запирательных лимфоузлов >25% (по номограммам Partin), поэтому неоадъювантное выполнение лимфаденэктомии в данном случае оправдано.
Относительным противопоказанием к криодеструкции простаты является ранее выполненная тотальная трансуретральная резекция предстательной железы: в этом случае увеличивается риск некроза уретры вследствие неплотного прилегания обогревателя уретры к ее стенкам и, как следствие, возникает синдром отхождения струпа, часто приводящий к возникновению кровотечения и острой задержки мочи.
Криодеструкция простаты после лучевых методов лечения
Примерно треть первичных пациентов с локализованным раком предстательной железы подвергается различным видам лучевой терапии (ЛТ). После проведения конформальной лучевой терапии или брахитерапии, в том числе под КТ-контролем, у определенного числа пациентов возникает биохимический рецидив заболевания. В случае возникновения рецидива в ранние сроки после лучевой терапии и отсутствия признаков появления метастазов пациент может рассматриваться как кандидат на КД предстательной железы. Планирование дальнейшего лечения основывается на стадии заболевания на момент выявления рецидива, наличии сопутствующей патологии, возрасте и предпочтениях пациента.
При этом оценка прогноза заболевания с помощью номограмм Partin у пациентов после лучевой терапии не используется. Уровень ПСА >10 нг/мл в сочетании со временем удвоения этого показателя к 16 мес являются неблагоприятными прогностическими факторами при планировании КД, а увеличение уровня ПСА в 2 раза и более менее чем за 6 мес служит признаком наличия метастатического процесса — в этом случае криодеструкция простаты не применяется.
При наличии биохимического рецидива у пациента, перенесшего ДЛТ либо брахитерапию, роль повторной биопсии остается спорной. Американское общество терапевтической радиологии и онкологии (American Society for Therapeutic Radiology and Oncology — ASTRO) рекомендует выполнение биопсии при отсутствии противопоказаний к дальнейшему оперативному лечению.
Трактовка результатов биопсии может быть затруднена вследствие патоморфоза клеток, подвергшихся лучевому воздействию. При этом в случае подтверждения инвазии опухоли в семенные пузырьки прогноз радикального криохирургического лечения хуже, поэтому КД простаты в варианте монотерапии не должна применяться.
Таким образом, в настоящее время нет единого мнения о показаниях к применению КД простаты после ЛТ, не до конца ясным остается вопрос об отборе пациентов для подобного вмешательства. Кандидатами для КД простаты после ЛТ, по мнению ряда авторов, являются пациенты с гистологически верифицированным рецидивом РПЖ без инвазии в семенные пузырьки, без клинических признаков метастатизирования. при уровне ПСА 0,1 нг/мл.
Через 6 мес после криодеструкции простаты пациентам выполняли биопсию предстательной железы — в группе двойного замораживания-оттаивания отрицательные биопсии отмечены в 93% против 71% в случае однократного замораживания. У 56% пациентов признаков биохимического рецидива отмечено не было.
По результатам J. Cohen, безрецидивная 10-летняя выживаемость составила 57% при пороговой величине ПСА
Высокие показатели смертности от рака предстательной железы в России объясняются низким качеством диагностики. Несмотря на возрастающие темпы внедрения в клиническую практику современных методов диагностики, в последнее десятилетие число локализованных форм рака предстательной железы не только не ув.
Эпидемиология. Частота рака предстательной железы (РПЖ) неоднородна в разных странах. В США он занимает 2-е место среди злокачественных заболеваний у мужчин, составляет 18% от вновь выявленных опухолей и 10% от всех летальных исходов среди этих больных [Flanders W., 1984]. Выявлена э.
Клиническая картина аденомы простаты определяется тремя компонентами: симптомами нижних мочевых путей, увеличением предстательной железы и дисфункцией мочевого пузыря. Последняя может проявляться инфравезикальной обструкцией, нестабильностью или гипотонией (рис. 1). В клинической картине доброкачест.
К лечению пациентов приступают только тогда, когда патологические изменения достигают стадии клинических проявлений. Вопрос о показанности профилактической терапии сегодня остается открытым, а его целесообразность недоказанной. Если еще 10 лет назад реальной альтернативы операции при аденоме простат.
Наблюдение за больными в послеоперационном периоде является неотъемлемой частью процесса лечения онкоурологических больных. Это обусловлено в первую очередь тем, что у незначительной части больных после операции возникают ранние или отдаленные осложнения (стриктуры, недержание мочи, импотенция и.
До недавнего времени ведущей клинической классификацией доброкачественной гиперплазии предстательной железы являлась классификация Гюйона (Guyon), основанная на характеристиках функционального состояния мочевого пузыря и как следствие изменении количества остаточной мочи.
