Одним из самых современных методов лечения рака предстательной железы является метод высокоинтенсивного сфокусированного ультразвука — HIFU- терапия. Метод HIFU вышел за рамки экспериментального метода, разрешен к применению в Европе с 2005 года. Имеет регистрационное удостоверение министерства здравоохранения и социального развития РФ № 2005/245 от 15.02.2005 г. и внесен в государственный реестр изделий медицинского назначения и медицинской техники.
Это на сегодняшний день самый высокотехнологичный, малоинвазивный, радикальный метод лечения рака простаты. Он представляет собой современную технологию нового поколения, которая использует энергию ультразвуковых колебаний для нагревания глубоко лежащих тканей, не затрагивая при этом прилежащие здоровые ткани. Температура ткани в зоне фокусировки за одну секунду достигает 70-100°С, что позволяет произвести абляцию (выпаривание) пораженной ткани. Термическое воздействие хорошо управляется и регулируется в нужной дозе врачом во время процедуры, что является неоспоримым преимуществом метода. Окружающие ткани вокруг зоны фокусировки остаются неповрежденными.
Преимущества HIFU терапии по сравнению с остальными методами лечения:
- Отсутствие кровопотери.
- Отсутствие радиационного излучения.
- Кратковременность пребывания в стационаре.
- Возможность врача наблюдать и корректировать процессы, происходящие в зоне опухолевого очага во время процедуры.
HIFU-система Sonoblate 500® представляет собой современную революционную технологию, благодаря которой использование HIFU для лечения рака простаты более точное, безопасное и эффективное.


Схематичное изображение процедуры HIFU
Процедура выполняется под общей анестезией. Специальный датчик, помещается в баллон, наполненный жидкостью, комнатной температуры вставляется в прямую кишку. Предстательная железа внимательно осматривается врачом и выбирается с точностью до 1мм зона воздействия , после чего начинается процедура воздействия на опухоль , никаких неприятных ощущений пациент не испытывает (что связано и с проводимой анестезией и техническими особенностями аппарата). Обычно процедура занимает 2,5-3 часа, все это время врач постоянно наблюдает за происходящими в тканях предстательной железы изменениями. Для обеспечения мочеотделения после процедуры в мочеиспускательный канал устанавливается катетер, а перед процедурой в мочевой пузырь проводится специальная трубочка (эпицистостома), устанавливается по методике прокола кожи над мочевым пузырем.
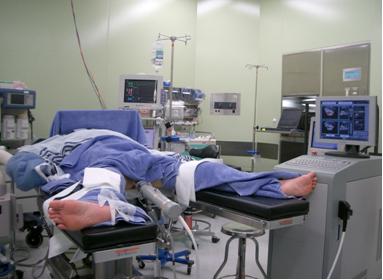
Положение пациента на операционном cтоле во время процедуры HIFU
Пациенты могут ощущать некий дискомфорт в течение нескольких первых дней в области мочевого пузыря. В послеоперационном периоде проводится антибактериальная терапия, контроль за стулом, контроль основных лабораторных показателей. Пациент сразу после процедуры переводится в отделении реанимации (после наркоза), затем переводится в общее отделение. После удаления катетера нормальное мочеиспускание восстанавливается спустя некоторое время, поскольку необходимо полное заживление тканей и нормализация размеров простаты.
Нежелательные явления процедуры HIFU:
- Сразу после операции, может наблюдаться задержка мочеиспускания вследствие отека простаты, в связи с этим в послеоперационном периоде всем пациентам, временно отведение мочи осуществляется путем установки в мочевой пузырь трубки, либо установкой уретрального катетера.
- Иногда встречается поражение ткани мочеиспускательного канала, что может приводить в очень небольшом проценте случаев к развитию стриктуры (сужению) уретры.
- Недержание мочи встречается очень редко, особенно при использовании системы HI FU Sonablate ® 500.
- У пациентов, которым была ранее проведена лучевая терапия, возможно образование свищевого хода через прямую кишку.
- После процедуры HIFU обычно не сохраняется эякуляция, хотя потенция не нарушается.
Как и для любой другой медицинской процедуры, все потенциально возможные побочные эффекты и осложнения необходимо обсудить с врачом перед терапией.
Пациенту, которому будет выполнена процедура HIFU , необходимо помнить о том , что в дальнейшем он будет наблюдаться врачом. Поэтому одним из важнейших этапов вашего лечения является регулярное посещение уролога и тщательное обследование. В первый год после проведения процедуры HIFU вы приходите на прием к вашему лечащему врачу каждые 3 месяца, в последующем каждые 6 месяцев с обязательным контрольным обследованием, включая определение ПСА, выполнение полифокальной биопсии предстательной железы, выполнения всего необходимого перечня обследований.
Обращаться по следующим адресам:
- Амбулаторно-поликлиническое отделение №1: пер. Доломановский ,70/3
понедельник, пятница с 16-00 до 18-00
- Амбулаторно-поликлиническое отделение №2: ул.21 линия,8
Обращаем Ваше внимание на то, что: лекарственные препараты, медицинские услуги, в том числе методы профилактики, диагностики, лечения и медицинской реабилитации, медицинские изделия, упомянутые на данном сайте – могут иметь противопоказания, проконсультируйтесь со специалистом!

Воздействие высокоинтенсивным фокусированным ультразвуком с лечебной целью –HIFU( англ: хайфу) – вид противоопухолевой, при котором поток ультразвука вызывает нагревание и гибель опухолевых клеток в простате. Данная манипуляция выполняется урологом. В настоящее время проводится множество клинических исследований, посвященных методу лечения HIFU.
Показанием для лечения является наличие локализованного рака простаты (без распространения на окружающие органы и ткани), а также пациентам с диагнозом рак простаты после проведенной радиотерапии. В случае, если за счет опухолевого процесса простата увеличена настолько, что это является противопоказанием для проведения HIFU, врач может рекомендовать проведение гормональной терапии или проведение трансуретральной резекции простаты (ТУР простаты) для уменьшения ее объема.
Выбор метода лечения пациента с диагнозом рак предстательной железы зависит от нескольких факторов, в частности, от того, имеется ли распространение рака простаты на другие окружающие ткани. Врач должен проинформировать пациента о других возможных методах ведения или лечения рака простаты (выбор методов зависит от конкретной клинической ситуации):
- наблюдение – мониторинг раковой опухоли без лечения до тех пор, пока она не растёт
- операция – хирург может удалить простату в ходе открытой или лапароскопической (через проколы брюшной стенки – с помощью роботизированной установки Да Винчи) операции. В ряде случаев выполняется симптоматическая ТУР простаты (трансуретральная резекция)
- дистанционная (наружная) лучевая терапия – уничтожение опухолевых клеток с помощью радиации
- брахитерапия – в предстательную железу помещаются небольшие радиоактивные зерна, которые постепенно теряют радиационную активность (внутритканевая лучевая терапия)
- криотерапия – повреждение опухолевых клеток воздействием отрицательной температуры
Процедура длится до трёх часов. Длительность сеанса коррелирует с объемом опухолевой ткани в простате. После анестезии, врач вводит зонд-излучатель ультразвука в прямую кишку. Ультразвуковой поток настраивается таким образом, чтобы он фокусировался именно в опухоли простаты. Процесс контролируется с помощью высокоточного и сложного программного обеспечения, благодаря чему лечебному воздействию подвергается только желаемая часть простаты.
После прекращения действия анестезии и восстановления болевой чувствительности пациенту могут понадобиться обезболивающие препараты для купирования возможного болевого синдрома. Отведение мочи будет осуществляться по мочевому катетеру через уретру или через прокол на брюшной стенке (цистостому). Через 2 недели катетер удаляется. Обычно пациент выписывается сразу после того, когда чувствует себя к этому готовым. Обычно это происходит в этот же день либо на следующий. Перед этим медсестра даёт рекомендации по уходу за катетером в домашних условиях и направление на удаление катетера через 2 нед. Предпочтительнее когда пациент добирается до дома на машине в качестве пассажира, а не сам ведет автомобиль. Общая анестезия может оказать временное влияние на координацию, поэтому в течение суток с момента процедуры пациенту не рекомендуется управлять транспортным средством, употреблять алкоголь, а так же подписывать официальные документы. Для профилактики инфекционных осложнений врач может назначить курс антибиотиков.
Пациент может отмечать следующие симптомы после процедуры:
- кровь в моче
- затруднения при мочеиспускании после удаления катетера (из-за отёка предстательной железы)
- отхождение некротизированной ткани простаты при мочеиспускании
Это проходящие симптомы, исчезающие в ближайшее время.
Поводом для обращения к врачу является:
- нарастание болевых ощущений, не купирующихся в результате приема обезболивающих медикаментов
- развитие высокой температуры тела
- увеличение количества крови в моче
- выраженное затруднение при мочеиспускании
К осложнениям после проведения процедуры относят:
- развитие инфекции мочевыводящих путей – риск развития осложнений высок в течение нескольких недель после сеанса. Для профилактики назначается курс антибиотикотерапии
- недержание мочи при напряжении – мышцы вокруг уретры могут ослабнуть, из-за этого малые дозы мочи могут подтекать при кашле, чихании или резком движении;
- ургентное недержание мочи – пациент ощущает частые или интенсивные позывы на мочеиспускание
- импотенцию – после терапии HIFU пациент может испытывать снижение эрекции
- бесплодие
- воспаление прямой кишки (заднего прохода) – из-за этого может возникать чувство жжения или кровотечение из прямой кишки
Основной метод для пациентов старше 75 лет, или имеющих тяжелые сопутствующие болезни
HIFU-абляцию применяют в случаях, когда невозможна радикальная простатэктомия . Или как спасительную терапию при рецидивах – повторном возникновении опухоли после других способов лечения. Метод не рекомендован пациентам, которые перенесли операцию на прямой кишке. В этом случае существует вероятность разрыва стенки кишки и появления свищей.
Наиболее эффективна при небольшом размере простаты. При объеме свыше 30 см.куб. сначала выполняют трансуретральную резекцию (ТУР) или лазерную энуклеация предстательной железы (НоLEP/ТhuLEP).
Раковые клетки разрушаются термическим воздействием при проникновении звуковых волн в глубокие ткани
Воздействие усиливает акустическая линза, она собирает волны в пучок высокой интенсивности подобно увеличительному стеклу.
В отечественной медицине клиника урологии Первого МГМУ первой использовала HIFU для лечения злокачественной опухоли простаты . Для ультразвуковой абляции мы используем роботизированный комплекс Ablatherm (Франция) последнего поколения – лучший в своем классе.
Преимущество ультразвуковой абляции – минимальная инвазивность
Органы и ткани вне зоны лечения остаются невредимыми. Исключены побочные эффекты хирургических методов: кровотечение в ходе операции и недержание мочи в послеоперационном периоде, существенно короче срок госпитализации и период восстановления.
Ультразвуковая терапия – ход процедуры
Диагностический и ультразвуковой зонды заводят в зону опухоли без разрезов, через прямую кишку. Врач наблюдает операционное поле через дисплей, джойстиком на управляющей консоли регулирует положение зондов и мощность ультразвуковых импульсов. Программное обеспечение помогает хирургу точно воздействовать на раковые клетки, не повреждая прилежащие структуры.
Операцию выполняют под щадящей спинальной анестезией. Продолжительность зависит от объема опухоли, обычно занимает два-три часа. В завершение устанавливают уретральный катетер, который удаляют через неделю. Госпитализация в течение двух-трех дней.
HIFU-абляция рака простаты стоимость
Гражданам России HIFU-терапию выполняем бесплатно по каналу высокотехнологичной помощи. Как правило, сложностей с выделением федеральной квоты на ультразвуковую терапию не возникает. Наши врачи помогут оформить необходимые документы. Стоимость операции по каналу платных медицинских услуг – около 100 тыс рублей. Это меньше, чем в других зарубежных или отечественных урологических центрах.
Успешное лечение рака простаты в нашей клинике проходят ежегодно свыше тысячи человек, в том числе из ближнего и дальнего зарубежья.

Что такое HIFU-терапия
Высокоинтенсивные ультразвуковые волны обладают способностью проникать сквозь здоровые ткани, не затрагивая их структуру. Линза излучателя на секунду фокусирует их в целевой (фокальной) зоне, в результате чего происходит нагрев тканей до 65-100 ˚Си их последующее разрушение. Принцип действия как у увеличительного стекла. Проходящие через него сфокусированные солнечные лучи приобретают разрушительную силу.
Клетки опухоли очень чувствительны к повышению температуры. При ее повышении до 40 ˚С белок в них начинает изменять свою структуру, а при 65 ˚С он сворачивается (коагулирует), клетка умирает (некротизируется). Окружающие ткани остаются неповрежденными.
Во время каждой фокусировки охватывается участок не более 10 мм 3 . Продолжительность и интенсивность воздействия регулирует врач. Метод также носит название высокочастотной гипертермии.

Принцип ультразвукового фокусированного воздействия
HIFU-терапия не требует механического вмешательства в организм: без разрезов, проколов, введения каких-либо инструментов в уретру. Ультразвуковая волна достигает новообразования вне зависимости от глубины его расположения. За несколько фокусировок можно удалить опухоль простаты любого размера. Главное условие – она должна быть ограниченной, обособленной, не распространенной на кости, семенные пузырьки и регионарные лимфоузлы.
Для HIFU-терапии требуется специальное оборудование. На сегодняшний момент в клиниках используют две системы: Sonablate 500 и Ablatherm.

Система Sonablate 500
Преимущества HIFU-терапии при лечении рака простаты:
- В 94% случаев в течение 5 лет уровень ПСА не поднимается;
- У большинства пациентов отсутствует недержание мочи – характерный побочный эффект для операций на простате;
- У 60-80% пациентов не происходит ухудшения потенции;
- Отсутствует опасность кровотечения и инфицирования.
Процедура безопасна для организма, поэтому ее можно повторять многократно. У ряда пациентов вырабатывается антиопухолевый иммунитет вследствие поглощения организмом некротизированых тканей.
Показания и противопоказания
Показания к проведению хайфу-терапии рака простаты:
- Опухоль на 1 или 2 стадии развития. При данном условии воздействие ультразвуком наиболее эффективно. На 3 и 4 стадиях рака простаты HIFU-терапия не применяется вследствие малой результативности.
- Наличие противопоказаний к другим методам лечения либо их неэффективность.
- Наличие технических препятствий для радикальной простатэктомии (лишний вес).
- Рецидив опухоли, в том числе после лучевой терапии (спасительная, сальважная HIFU-терапия).

Локальный рецидив, визуализированный при помощи ПЭТ-КТ у пациента с повышенным уровнем ПСА после РПЭ
Параметры идеального пациента для HIFU-терапии:
- ПСА менее 10 нг/мл (допустимо и 15);
- Сумма по Глисону равна или ниже 6;
- Объем простаты 40 см 3 ;
- Отсутствие в простате кальцинатов крупнее 1 см. (они блокируют прохождение ультразвука).

HIFU-терапия показана пациентам с ожидаемой продолжительностью жизни более 5 лет. Если простата больше 40 см 3 , то уменьшить ее размеры можно при помощи предварительной гормональной терапии (андрогенная блокада в течение 3-6 месяцев). В крайнем случае возможно совмещение с ТУР (ТУР-HIFU) или предварительная ТУР (за 2-5 дней или за месяц).
Параметры проблемного пациента:
- Рак мочевого пузыря.
- Расположение оставшихся после брахитерапии радиоактивных зерен в районе прямой кишки.
- Стриктура уретры.
- Лучевая терапия в анамнезе.
- Наличие отдаленных метастаз.
- Перенесенные операции на прямой кишке.
Перед проведением процедуры по возможности устраняют все препятствия (стриктуры, опухоль мочевого пузыря, спайки).
Противопоказания для проведения HIFU-терапии:
- Острый простатит;
- Метастазирование опухоли;
- Воспаление прямой кишки после лучевой терапии, утолщение ее стенки более 4 мм;
- Большой объем простаты (более 60 см 3 );
- Активные воспалительные процессы мочеполовой системы;
- Отсутствие прямой кишки вследствие хирургического удаления, а также свищи или стеноз (сужение) данной области.
После брахитерапии HIFU-терапию можно проводить не ранее, чем через 18 месяцев, поскольку в течение данного времени в организме могут присутствовать активные очаги радиации.
Нарушение свертываемости крови не является прямым противопоказанием для HIFU-терапии, но за 10 дней до процедуры антикоагулянты желательно отменить. Прием препаратов можно возобновить через сутки.
Как проводится HIFU-терапия рака простаты
Лечение рака простаты при помощи HIFU-терапии займет минимум 3 дня стационара: один на обследования, второй – сама операция, третий – постоперационное наблюдение. Обычно пациент проводит в клинике 5-7 дней.
Перед HIFU-терапией необходимо провести максимально точную диагностику при помощи остеосцинтиграфии (поиск метастазов в костях), ПЭТ-КТ или МРТ с контрастом, чтобы выявить все опухолевые очаги и оценить локализацию основной опухоли. О ее распространении за капсулу простаты может свидетельствовать высокий балл на Глисону и увеличенный ПСА.
Также пациенту назначают урофлоуметрию, УЗИ простаты, почек и мочевого пузыря, общий анализ крови и мочи, рентгенограмму грудной клетки, ЭКГ. При необходимости проводят биопсию.
HIFU-терапия рака простаты производится при помощи ректального датчика – таким образом достигается высокая точность воздействия. Поэтому за день до процедуры необходимо подготовить кишечник:
- Завтрак – единственный и последний прием пищи (без обеда и ужина), потом можно только пить;
- Питье прекращается за 2 часа до назначенного времени процедуры;
- Перед процедурой ставится клизма.
HIFU-терапия проводится под общим или эпидуральным наркозом (инъекция в позвоночник). Поза пациента зависит от используемого прибора: Sonablate – на спине с поднятыми ногами, Ablatherm – на правом боку.

HIFU-терапия на аппарате Ablatherm
После блокирования нервных окончаний врач вводит ректальный датчик в прямую кишку. Аппарат сканирует опухоль, делает несколько снимков и выводит их на контрольную панель. На основании полученных данных фокусировка лучей производится по программе или вручную. Железа разделяется на несколько целевых зон. Датчик будет перемещаться вдоль очага, пока не коагулирует его полностью.

Визуальный контроль
В зависимости от объема простаты весь процесс займет около 2-4 часов (порядка 600 импульсов).

После HIFU-терапии в простатической части уретры окажется участок некротизированной ткани, соответственно появится отечность, перекрывающая просвет мочеточника. Во избежание проблем с мочеиспусканием на 1-3 дня будет установлен катетер или цистостома.
Реабилитация и последствия
В раннем послеоперационном периоде (первые 2-3 дня) отвод мочи производится при помощи цистостомы (трубочка, выходящая из брюшной стенки). Это доставляет некоторый дискомфорт, возникают частые позывы к мочеиспусканию. На 4-5 день обычно восстанавливается естественный отток мочи и цистостому удаляют. Если простата крупная, то удаление производят на 6-7 день. Физическая активность допускается уже на следующий день после процедуры.

Цистостома для отвода мочи
Сразу после HIFU-терапии резко вырастет уровень ПСА, затем на протяжении 3 месяцев он будет постепенно падать до 0,1 нг/мл. Для облегчения мочеиспускания и для профилактики воспалений врач может назначить альфа-адреноблокаторы, антибиотики.
Если HIFU-терапия проводилась совместно с ТУР, то полное восстановление мочеиспускания занимает от 3 до 12 дней. Без предварительной ТУР – 10-40 дней, поскольку рассасывание некротизированных тканей происходит медленнее, при механическом удалении уретра сразу свободна . В сложных случаях проблемы с мочеиспусканием могут наблюдаться до полугода.
Сразу после HIFU-терапии резко вырастет уровень ПСА, затем на протяжении 3 месяцев он будет постепенно падать до 0,1 нг/мл. Для облегчения мочеиспускания и для профилактики воспалений врач может назначить альфа-адреноблокаторы, антибиотики.
Согласно общей статистике, последствия HIFU-терапии могут быть следующими:
- Недержание мочи слабой и средней выраженности – у 8% пациентов;
- Полное недержание – менее чем у 1% пациентов;
- Ухудшение потенции при нервосберегающей технике – у 20%;
- Сужение уретры (стриктура) – у 8% (рубцовые изменения удаляются при помощи ТУР);
- При повреждении нервов потенция ухудшается у 66% оперируемых.

Стриктура уретры – это патологическое сужение внутреннего просвета мочеиспускательного канала, приводящее к расстройствам мочеиспускания различной степени выраженности
После HIFU-терапии пациент ставится на учет у онкоуролога и периодически сдает ряд анализов:
- ПСА раз в месяц первые полгода.
- МРТ малого таза раз в полгода.
- Остеосцинтиграфия раз в полгода
По истечении 6 месяцев после HIFU-терапии может быть назначена контрольная биопсия простаты.
Стоимость и клиники
В настоящее время наибольшим опытом проведения операций на простате при помощи HIFU-терапии обладают специалисты Клиники урологии ММА им. Сеченова. Необходимое оборудование также установлено в следующих учреждениях (для некоторых учреждений даны цены за процедуру):
- Онкодиспансер в г. Уфа;
- Урологическое отделение МОНИКИ им. Владимирского;
- Онкоцентр в г. Оренбург;
- МЦ ЦБ РФ Москвы;
- МНИОИ им. Герцена (Москва): 21750 руб.;
- ГВКГ им. Бурденко (Москва): 54093 руб.;
- НИИ урологии им. Лопаткина (Москва): 65 тыс. руб.;
- ВМА им. Кирова (СПб): 40 тыс. руб.;
- ОКБ в г. Ханты-Мансийск.
Стоимость зависит от категории сложности операции, которая определяется объемом простаты, наличием сопутствующих заболеваний.
Отзывы
Заключение
HIFU-терапия – это наиболее безопасный и эффективный метод лечения рака простаты на ранних стадиях. Его можно применять и для пожилых мужчин без риска ухудшения их общего состояния. Эффект от терапии зависит от соблюдения критериев отбора пациентов.
Кафедра урологии Санкт-Петербургского государственного медицинского университета имени акад. И. П. Павлова
В последние годы все чаще используют высокоинтенсивное сфокусированное ультразвуковое излучение (HIFU) для лечения больных раком предстательной железы (РПЖ). Данный метод лечения может быть использован при лечении локализованных форм РПЖ — при единичных новообразованиях небольших размеров, а также при возникновении местного рецидива и в качестве дополнительного метода лечения, направленного на уменьшения массы опухолевой ткани. Анализ данных литературы свидетельствует о том, что HIFU-терапия связана с низким риском развития послеоперационных осложнений, легче переносится больными. Данный вид лечения может быть назначен в качестве первичного при РПЖ, в частности, рекомендован пожилым больным (в возрасте старше 70 лет), при РПЖ на стадии Т1-Т2 N0M0, при сумме баллов по шкале Глисона 10 нг/мл, повышением уровня ПСА > 1 нг/мл в послеоперационном периоде и риском биохимического рецидива (p 4 нг/мл — у 7 из 48 (14,6 %) пациентов (четверым из них был в последующем назначен курс гормонотерапии). У двух больных развилось осложнение — уреторектальный свищ (им проводился курс лучевой терапии), у троих — стрессовое недержание мочи в результате выполненных процедур ТУР простаты после HIFU-терапии. У 20 (32,3 %) пациентов понадобились трансуретральные вмешательства для удаления некротических масс или устранения стриктур уретры или шейки мочевого пузыря.
T. Uchida и соавт. [15] опубликовали предварительные результаты применения HIFU-терапии при лечении пациентов с раком простаты на стадии T1b-2 N0M0. Они выполнили 28 процедур 20 пациентам с гистологически подтвержденным РПЖ. Использовали аппарат Sonablate-200. Проанализированы исходы вмешательств через 6 и более (в среднем 13,5) месяцев. Полный ответ на лечение был достигнут у всех больных, что подтверждалось отрицательными результатами биопсии, проведенной после процедуры HIFU и отсутствием биохимического рецидива. Из этих 20 пациентов у 13 (65 %) уровень ПСА в плазме крови был менее 0,5 нг/мл, у 5 (25 %) — от 0,5 до 1,0 нг/мл, у 2 (10 %) уровень ПСА составил от 1,01 до 2,0 нг/мл. Из осложнений отмечены следующие: ректоуретральный свищ — у 1 пациента, стриктура уретры — у 2 пациентов, одному пациенту потребовалось выполнение трансуретральной резекции простаты по поводу хронической задержки мочеиспускания.
A. Gelet [8] с соавторами исследовали группу из 82 пациентов (средний возраст — 71,0 ± 5,7 г.) с гистологически верифицированным раком простаты (стадия Т1–Т2), которые были подвергнуты HIFU-терапии на аппарате Ablatherm в связи с имеющимися противопоказаниями к радикальной простатэктомии. Средний срок наблюдения после вмешательства составлял 17,6 (от 3 до 68) месяцев. Среднее значение сывороточного ПСА составляло 8,11 ± 4,64 нг/мл, средняя величина объема простаты — 34,9 ± 17,4 см3. Критериями опухолевой прогрессии были положительные результаты биопсии вне зависимости от уровня ПСА, а также три последовательных подъема уровня ПСА (на 0,75 нг/мл или больше при его определении через каждые 3 месяца после сеансов HIFU-терапии) при отрицательных результатах биопсии. Безрецидивная выживаемость составила 62 % больных при отсутствии у больных признаков опухолевой прогрессии течение 60 месяцев. В частности, процент безрецидивного течения заболевания в группе больных (50 человек) с умеренной степенью риска (уровень ПСА 20 нг/мл составила 94 %, 75 % и 35 % соответственно (p
ГУ Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского (МОНИКИ)
М.Ф. Трапезникова, К.В. Поздняков, С.Б. Уренков
Радикальными методами лечения локализованного рака предстательной железы в настоящее время являются радикальная простатэктомия и лучевая терапия. Однако, данные методы лечения высокоинвазивны, обладают рядом серьезных осложнений, неприменимы у пациентов, имеющих отягощенный соматический статус. В свою очередь, медикаментозная терапия, обладая такими положительными качествами как отсутствие травматичности и широкая доступность, является паллиативным методом лечения, должна применяться преимущественно при местно-распространенных и генерализованных формах заболевания и имеет ряд недостатков, таких как развитие гормон-рефрактерности опухоли, кардио- и гепатотоксических эффектов, а также осложнений, связанных с изменением гормонального фона пациента.
В связи с этим актуальным является разработка и применение малоинвазивных новых (т.н.»альтернативных») методов лечения больных с раком предстательной железы. Развитие научно-технического прогресса сделало возможным применение в данном разделе практической медицины таких методов как брахитерапия, криодеструкция и ультразвуковая аблация.
Метод ультразвуковой аблации простаты или HIFU (High Intensity Focused Ultrasound) — терапия в качестве самостоятельного метода применяется у пациентов с локализованным раком простаты (T1-2), а в сочетании с гормональной терапией и у пациентов с распространенными и метастатическими формами заболевания. Положительными моментами является отсутствие повреждения кожных покровов тела, проведение лечения в одну сессию, отсутствие риска возникновения кровотечения, возможность точного дозирования повреждающего действия, постоянной визуализации лечебного процесса, повторения процедуры при неудаче лечения, а также — выполнения лечения у пациентов с рецидивом заболевания после проведения радикальной простатэктомии и лучевой терапии.
Основным свойством метода, отличающим его от других методов лечения рака простаты, является его малая инвазивность, позволяющая применять его у пожилых пациентов с сопутствующей патологией сердечно-сосудистой и легочных систем – ведь известно, что 75-80% всех случаев заболевания раком простаты приходится на мужчин старше 65 лет.[1]
Сущность метода заключается в воздействии на ткань предстательной железы сфокусированными ультразвуковыми волнами частотой 3 МГц. Высокая интенсивность волн и сосредоточение излучения в одной точке вызывают термический эффект и явление кавитации, в результате чего происходит аблация тканей — нагревание их до 85 оС в течение нескольких секунд, с необратимым повреждением участка ткани длиной 19-28 мм и шириной 1,7 мм. Поскольку ультразвук является неионизирующим воздействием, ткани на входе и выходе пучка волн не повреждаются. Происходит полное разрушение ткани железы вследствие коагуляционного некроза (расплавление липидных мембран и денатурация белков). В дальнейшем, через 3-6 месяцев, некротизированная ткань простаты, включая капсулу, замещается фиброзной тканью (рис. 1 а, б).

Рис. 1. а) Полное разрушение железистой ткани вследствие коагуляционного некроза (через 48 часов после сеанса HIFU-терапии)

Рис. 1. б) Некротизированная ткань простаты замещается фиброзной тканью (через 3 месяца).
Показанием к выполнению метода служит:
- Локализованный рак простаты (T1-T2)
- Рецидив после радикальной простатэктомии, лучевой терапии
- Местно-распространенный и генерализованный рак простаты в сочетании с гормональной терапией
Противопоказания:
Абсолютные:
- Ректальный свищ в анамнезе
- Стеноз, ампутация прямой кишки
Относительные:
- Объем простаты более 40 см3
- Кальцинаты простаты
- Выраженная инфравезикальная обструкция
Для уменьшения объема предстательной железы, устранения инфравезикальной обструкции и удаления камней железы предварительно производится трансуретральная резекция простаты.
Пациенты и методы.


Рис. 2. Распределение пациентов по возрасту (а) и стадиям заболевания (б).
На данный момент времени оценены предварительные результаты лечения у 45 пациентов, срок наблюдения которых составляет от 3 до 17 месяцев (рис. 3). Уровень ПСА крови менее 1 нг/мл отмечен у 29 (64,4%) пациентов, 1-4 нг/мл — у 7 (15,6%) пациентов (данной группе пациентов проводится активное наблюдение). У 9 больных (20%) отмечалось сохранение либо повторное повышение уровня ПСА крови выше 4 нг/мл (7,1-19,1 нг/мл). Этим пациентам проведено повторное обследование. 7 из них выполнено повторное лечение на аппарате “Ablatherm”, двум из-за наличия метастатического поражения других органов и отрицательными результатами биопсии простаты назначена гормональная терапия.

Рис. 3. Результаты лечения (уровень ПСА крови) у 45 пациентов.
Отмечены следующие осложнения: острая задержка мочеиспускания, потребовавшая выполнения эндоскопического оперативного лечения (трансуретральной резекции некротических тканей простаты) – у 5 (8,2%) пациентов, временное недержание мочи (до 3-х месяцев) – у 16 (26,2%) больных, полностью исчезнувшее в результате фармакотерапии или самостоятельно у всех пациентов, длительное недержание мочи – у 2 (3,3%) пациентов. Эпидидит и уретрит встретились в 8,2% и 11,5% случаях соответственно, уретро-ректальные свищи – в 3,3%. Нарушение эякуляции и эректильная дисфункция отмечены нами у практически всех пролеченных пациентов. Декомпенсации имеющихся сопутствующих заболеваний непосредственно после лечения и при длительном наблюдении не было.
Основным критерием эффективности проведенного лечения является дианмика уровня ПСА крови. Показатель, не превышающий 1 нг/мл, свидетельствует о хорошем результате операции. Вторым показателем результата HIFU-терапии является стабильность надира уровня ПСА на протяжении длительного времени. По имеющимся литературным данным уровень ПСА крови, не превышающий 1 нг/мл отмечается в среднем у более 80% пациентов, получивших данное лечение [2], и у подавляющего большинства из них стабильность данного показателя сохраняется в течение нескольких лет наблюдения. Так, A.Blana et al. [3] приводит собственные данные, основанные на наблюдении 146 пациентов, о том, что через 3 месяца после HIFU-терапии концентрация ПСА крови менее 1 нг/мл отмечалась у 92% пациентов, а через 22 месяца – у 87% (медиана ПСА крови — 0,07 и 0,15 нг/мл, соответственно). В нашем исследовании мы отметили снижение ПСА крови менее 1 нг/мл у 64,4% и с учетом 15,6% пациентов, имеющих данный показатель от 1 до 4 нг/мл (в случае его стабильности не протяжении нескольких лет) суммарный процент удачно пролеченных больных будет составлять 80.
Наиболее же объективным методом оценки клинической эффективности метода, является контрольная биопсия простаты, проводимая через несколько месяцев после лечения. Ведь зачастую повышение уровня ПСА крови или его сохранение после сеанса на прежнем уровне вызвано не наличием патологического процесса в предстательной железе, а недиагностированным до лечения метастатическим поражением других органов. Процент отрицательных биопсий согласно приводимым литературным данным колеблется от 75 до 93,4 [4,5,6].
Частота осложнений, полученных нами, несколько отличается от имеющихся в литературе. Так, мы отметили высокую частоту развития недержания мочи – 29,5%, как стрессорного, так и ургентного характера. Однако только у 2 пациентов (3,3%) это осложнение сохраняется на протяжении длительного времени. У всех остальных пациентов оно носило временный характер и полностью исчезло максимум через 3 месяца после операции. Такие воспалительные осложнения, как эпидидимит и уретрит, частота встречаемости которых в нашем исследовании сопоставима с имеющейся в литературе (14-15%), мы полностью относим к проводимой катетеризации пациентов. Снижение процента этих осложнений видится, прежде всего, в проведении предоперационной антибактериальной подготовки, а также более строгом соблюдении мер асептики при установке уретрального катетера. Одним из наиболее серьезных осложнений при проведении HIFU – терапии можно признать возникновение уретро-ректального свища. И хотя процент данного осложнения и по нашим данным и по данным литературы относительно невелик – 3,3 и 1,3-6, соответственно, что обусловлено, прежде всего, системой безопасности аппарата (постоянный контроль за расположением, толщиной и температурой стенки прямой кишки во время лечения), именно это осложнение является наиболее серьезным в силу резкого снижения качества жизни пациента, а также потребностью в проведении сложного, длительного и зачастую малоэффективного лечения. С учетом того, что в нашем наблюдении данное осложнение развилось у одного пациента с генерализованной формой заболевания (T4 N0 M1), а у другого пациента в анамнезе имелась левосторонняя гемиколэктомия, произведенная несколько лет назад по поводу рака толстого кишечника (T4 N1 M0), мы видим меры по уменьшению частоты данного осложнения, прежде всего, в более тщательном отборе пациентов к данному методу лечения.
Важным положительным моментам ультразвукой аблации как метода лечения рака предстательной железы является и то, что пожилые пациенты с отягощенным соматическим статусом получают малоинвазивное, достаточно эффективное лечение и в случае его хорошего эффекта они могут продолжать свою жизнь в прежнем своем статусе, не принимая гормональной терапии, не имея каких-либо физических или иных ограничений. Единственным необходимым исследованием у них является периодическое определение ПСА крови. То есть данный метод лечения позволяет сохранить у пациента не только здоровье, но и качество жизни.
Пациент З., 72 года. Диагноз: Рак простаты T2N0M0. Клинические проявления заболевания – учащенное мочеиспускание, ноктурия до 5 раз. Из анамнеза: ДГП с 1998 года, наблюдался по м/жительства. В связи с подъемом уровня ПСА крови за время наблюдения с 1,5 до 5,6 нг/мл в апреле 2007 г. выполнена мультифокальная трансректальная биопсия простаты. Гистологическое заключение – аденокарцинома 7 (3+4) баллов по Глисону. УЗИ: Верхние мочевые пути не расширены. Остаточной мочи нет. Простата – V – 20 см куб., сравнительно однородной эхо-структуры. УФМ: V – 170 мл, Qmax – 13 мл/сек. Сопутствующие заболевания: гипертоническая болезнь 2 ст., ИБС, диффузный кардиосклероз, стенокардия 2 ф. кл., бр. астма, эндогенная форма, ожирение. Выполнение радикальных методов лечения пациенту было противопоказано в связи с отягощенным соматическим статусом. Было принято решение провести Ультразвуковую аблацию простаты. Сеанс HIFU-терапии выполнен 11.2007 г. В послеоперационном периоде — постоянная и интермиттирующая катетеризация мочевого пузыря, антибактериальная, противовоспалительная терапия, альфа–адреноблокаторы. Однако, мочеиспускание не восстановилось, в связи с чем, выполнена троакарная цистостомия под контролем УЗИ. 12.2007 г. Цистостомическая дренажная трубка при повторной госпитализации пациента удалена. Мочеиспускание восстановилось. Мочепузырный свищ закрылся. В настоящее время: УФМ: V- 131 мл, Qmax- 11,2 мл/сек. При УЗИ – остаточной мочи нет. ПСА крови — 0,3 нг/мл. Декомпенсации сопутствующих заболеваний в результате проведенного лечения нет.
Данный клинический пример иллюстрирует возможности применения метода у соматически отягощенных пожилых пациентов с локализованным раком простаты, большинству из которых в настоящее время проводится гормональная терапия.
Таким образом, ультразвуковая аблация (HIFU-терапия) у пациентов с раком предстательной железы является эффективным, малоинвазивным, достаточно безопасным, имеющим малое количество осложнений методом лечения. Это позволяет рекомендовать его к проведению у соматически отягощенных пациентов. Метод требует дальнейшего исследования для оценки его роли среди методов лечения рака предстательной железы.
