Неймарк А.И. 1 , Тачалов М.А. 2 , Неймарк Б.А. 1 , Торбик Д.В. 1 , Арзамасцев Д.Д. 3
1 Кафедра урологии и нефрологии (зав. – проф. А.И. Неймарк) ГБОУ ВПО Алтайский государственный медицинский университет Росздрава (г. Барнаул)
Введение. Пик заболеваемости раком предстательной железы (РПЖ) и доброкачественной гиперплазии предстательной железы (ДГПЖ) приходится на возрастную категорию 70 – 75 лет и выше. Ожидаемая продолжительность жизни менее 10 лет и выраженная соматическая патология ограничивают использование традиционных хирургических методик. Улучшение качества жизни таких пациентов является актуальной задачей современной урологии.
В последние годы отмечается повышенный интерес врачей различных специальностей к такой отрасли медицины как интервенционная хирургия, которая позволяет проводить эндоваскулярные вмешательства с минимальной травматичностью, низким операционным риском и отсутствием необходимости в проведении анестезиологического пособия.
Впервые эндоваскулярная эмболизация в урологической практике нашла свое применение при купировании опасных для жизни кровотечений из мочевого пузыря и предстательной железы (ПЖ). Эмболизация артерий предстательной железы использовалась в течение многих лет для остановки кровотечения в связи с прогрессирующим РПЖ, а также для остановки кровотечения после операций на ПЖ [1].
Эмболизация артерий ПЖ при ДГПЖ применяется с 2004 года. Исследования отечественных и зарубежных авторов показали, что применение данного метода лечения ДГПЖ позволяет добиться уменьшения объема ПЖ более чем на 40% у 80 – 93% пациентов [2,3,4,5,6].
Основным источником кровоснабжения ПЖ является нижняя пузырная артерия — ветвь внутренней подвздошной артерии, от которой отходят от 2 и более артерий ПЖ. Современное оборудование для рентгенэндоваскулярных вмешательств позволяет проводить суперселективную катетеризацию и различные манипуляции, используя просвет мелких сосудов.
Возможности суперселективной катетеризации мелких артериальных сосудов обеспечивают не только эмболизацию, но и введение лекарственных препаратов непосредственно в ткань органа.
Химиоэмболизация (ХЭ) – это инновационный метод лечения злокачественных новообразований различной локализации, сочетающий в себе эмболизацию артерии, питающей опухоль, эмболизирующим материалом, в состав которого входит противоопухолевый препарат.
Эмболизация артериального сосуда, питающего пораженный злокачественной опухолью орган, приводит к некрозу опухоли и замедлению ее роста [7, 8, 9, 10].Суть методики заключается в резком замедлении регионарного кровотока в опухоли путем химиоэмболизации, что обеспечивает пролонгированный контакт опухоли с высокой концентрацией химиопрепарата. Это вызывает усиленную диффузию его в ткань, что позволяет добиться выраженного противоопухолевого эффекта без увеличения суммарной дозы препарата.
Цель исследования: оценка эффективности и безопасности суперселективной эмболизациии химиоэмболизации простатических артерий как самостоятельного метода лечения РПЖ и ДГПЖ.
Материалы и методы: эмболизацию артерий ПЖ проводили под местной анестезией трансфеморальным доступом по методике Сельдингера. Под рентгеновским контролем выполняла и суперселективную катетеризацию ветвей внутренней подвздошной артерии (ВПА) (Рис 1.). У пациентов с ДГПЖ производили эмболизацию сосудов, питающих ПЖ, путѐм применения микрокатетерной техники с введением микросфер EmboGold (Biosphere Medical, Франция) размером 100-300 мкм или 300-500 мкм до полной блокады кровотока (Рис. 2). У пациентов с РПЖ проводили суперселективную катетеризацию ВПА поочередно с обеих сторон с последующей химиоэмболизацией сосудов, питающих ПЖ, путем введения химиопрепарата и полимерных микросфер (Рис. 3.). Химиопрепаратом для проведения данной процедуры служил веромитомицин в дозировке 20 мг. В качестве источника транспортировки химиопрепарата применяли микросферы HepaSphere™ с размером микросфер 300-500 мкм – это новейший эмболизационный материал с высокими абсорбционными свойствами.
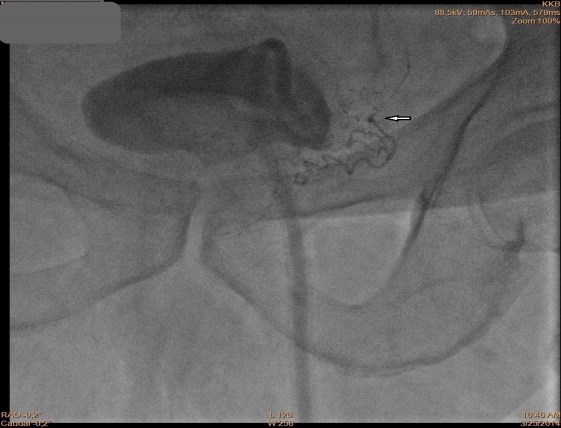
Рис.1. Ангиографический катетер подведен суперселективно к простатическим ветвям нижней мочепузырной артерии слева, стрелкой отмечен дистальный конец катетера
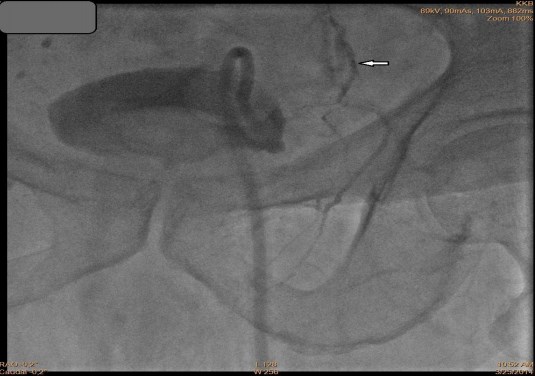
Рис.2. Выполненаэмболизация артерий простаты, кровоток блокирован, стрелкой отмечен дистальный конец катетера
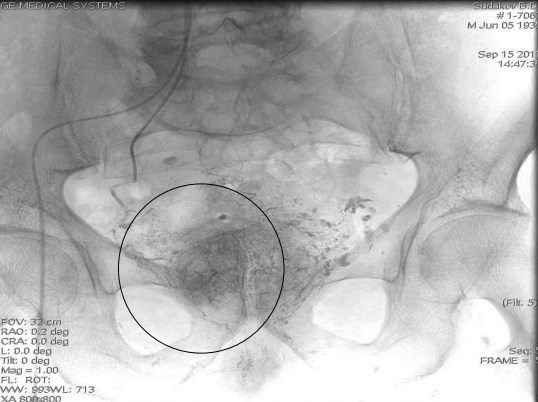
Рис.3. Выполнена супер селективная химиоэмболизация с двух сторон. Отмечено накопление химиоэмболизата в тканях ПЖ.
Лечение осуществляли на базе отделения рентгеноперационных методов диагностики и лечения Краевой клинической больницы. С 2004 по 2014 год проведена эмболизация артерий ПЖ у 59 пациентов с ДГПЖ, средний возраст, которых составил 68,2 ± 6,2 лет. Объем ПЖ варьировал от 35 до 296 см. куб.
В период с 2011 по 2014 годы, проведено лечение 36 пациентов с РПЖ методом рентгенэндоваскулярной химиоэмболизации. Все пациенты имели верифицированный РПЖ стадии T2а – 6 пациентов и стадии T2с – 30 пациентов. Средний возраст пациентов составил 72,3±2,06 года. Уровень простатспецифического антигена (ПСА) колебался от 0,8 до 17 нг\мл. Средний – 13,1±3,9 нг/мл. Объем ПЖ составил от 41 до 93 см. куб (средний объем 59±9,3). До проведения ХЭ 8 пациентов получали антиандрогенную терапию в монорежиме, 4 была выполнена хирургическая кастрация. 24 (66,6%) пациента имели симптомы нижних мочевых путей, в том числе у четверых цистостомические дренажи. Срок наблюдения составил от 3 до 36 месяцев. Все пациенты с ДГПЖ и РПЖ имели сопутствующую патологию, не позволяющую проводить радикальные методы лечения.
Результаты лечения оценивали по динамике уровня ПСА в сыворотке крови, данным трансректального ультразвукового исследования ПЖ, при котором определяли степень редукции объема ПЖ, ее эхоструктуру и васкуляризацию, анкетирование по международной системе суммарной оценки симптомов при заболеваниях простаты (IPSS), данным урофлоуметрии. Контрольными точками для оценки эффективности лечения стали: 3, 6, 9, 12, 18 и 24 месяца. 16 (44,4%) пациентам с РПЖ выполнена контрольная трансректальная мультифокальная биопсия ПЖ.
Противопоказаниями для проведения рентгенэндоваскулярных вмешательств являлись:
- Непереносимость рентгенконтрастных веществ;
- Наличие острых инфекционно-воспалительных заболеваний простаты;
- Декомпенсированная патология внутренних органов (сердечнососудистой системы, паренхиматозных органов);
- Декомпенсированная патология эндокринной системы;
- Нарушения сердечного ритма независимо от причины;
- Тяжелая форма бронхиальной астмы;
- Состояние после перенесенного инфаркта миокарда или острого нарушения мозгового кровообращения в срок до 6 месяцев;
- Наличие флотирующих тромбов в бассейне вен нижних конечностей;
- Анемия тяжелой и средней степени;
- Окклюзионно-стенотические поражения подвздошных сосудов;
- Аномалии анатомического строения подвздошных сосудов, не позволяющие выполнить операцию.
Данные подвергались статистической обработке посредством программы STATISTICA 10.0 и пакета прикладных программ, встроенного в программную среду MicrosoftExel 2010.
Результаты: в послеоперационном периоде у 63% больных наблюдали явления так называемого постэмболизационного синдрома, проявлявшегося умеренными болями в области промежности, по ходу уретры при мочеиспускании, в небольшойчасте случаев субфебрилитет имел место не более суток. 47% больных однако не испытывали какого-либо дискомфорта в послеоперационном периоде.
Для предупреждения и уменьшения проявлений болевого синдрома перед вмешательством и после операции в течение 7 дней больным назначали нестероидные противовоспалительные препараты (НПВП) в стандартных дозировках.
Каких-либо серьезных осложнений отмечено не было, за исключением одного случая, когда в послеоперационном периоде наблюдали ишемию головки полового члена, купированную консервативной терапией.
Таблица 1. Результаты лечения пациентов с ДГПЖ
| Показатели\сроки | Через 3 мес. | Через 6 мес. | Через 12 мес. | Через 24 мес. |
| Объем остаточной мочи(мл) | 158,2±0,028 1 | 143,0±0,0023 1 | 25,3±0,0020- | 26,3±0,0020 3 |
| Баллы по шкале IPSS | 6,2±0,051 1 | 4,0+0,014′ | 3,6+0,011- | 3,9+0,011 3 |
| ПСА (общи й/ с вобод н ы й) (нг/мл) | 1,3±/0,03± 0,0036 1 | 1,08± 1 /0,027 1 ± 0,0015 1 | 1,06± 2 /0,022± 0,0015 2 | 1,09± 3 /0,027 ± 0,0017 3 |
| Qmax (мл/сек) | 14,7±0,0043 1 | 15,9±0,0027 1 | 16,1+0,0014 2 | 16,4+0,0014 3 |
| Объем предстательной железы (см ) | 83,4±8,3 1 | 54,29 ±5,37 1 | 52,07+5,37 2 | 53,07+5,38 3 |
| Объем узла (см 3 ) | 52,9±5,17 1 | 33,26±6,67 1 | 32,16±5,43 2 | 33,18±4,83 3 |
Примечание: 1 результат достоверный по сравнению с данными до лечения – (р>0,01), 2 результат достоверный по сравнению с данными через 3 месяца после лечения (р0,01)
Через 3 месяца ( табл.1) достоверно уменьшилось количество симптомов по шкале IPSS, увеличилась Q макс. Эта тенденция сохранилась и в течение годового мониторинга, при наблюдении за пациентами в течение 24 месяцев после эмболизации достигнутый эффект был стабилен. Объем предстательной железы и узлового образования в среднем уменьшился на 53 и 47% соответственно, максимальный эффект – уменьшение объема железы на 82%.
Положительный эффект от проведения суперселективной рентгенэндоваскулярной химиоэмболизации опухолевой простаты был достигнут у 30 (83,3%) пациентов.Объективный ответ получен по результатам снижения уровня ПСА, уменьшения объема ПЖ по данным ТРУЗИ и улучшения качества мочеиспускания. Снижение уровня ПСА отмечено уже через 1 месяц после проведения химиоэмболизации. Средний уровень ПСА через 1 месяц составил 9,2±0,8 нг\мл.в сравнении с дооперационным значением – 13,1±3,9. Максимальное снижение уровня ПСА отмечено к 6 месяцам после проведения химиоэмболизации. Медиана ПСА через 6 месяцев составила – 3,4±0,02нг\мл. При дальнейшем наблюдении отмечено достоверное снижение уровня ПСА до 60 % от первоначального уровня (p
Многие мужчины после 50 лет сталкиваются с патологиями предстательной железы, в том числе и аденомой. Для устранения заболевания применяется медикаментозная терапия или операции. Эмболизация простатических артерий – новый, малоинвазивный метод лечения, основанный на нейтрализации притока крови к пораженной простате, что останавливает рост новообразования.
Показания к процедуре
В последнее время в медицинской практике все чаще применяется эмболизация артерий простаты (ЭАП), особенно если предыдущее медикаментозное лечение не принесло положительного результата. Рекомендована при доброкачественной гиперплазии, когда размер железы с опухолевыми тканями превышает 80 см³. Среди прочих показаний к проведению следует выделить:
- злокачественные новообразования (рак простаты),
- механические повреждения, травмы железы,
- варикозное расширение вен простаты, обильное кровотечение,
- повреждение простатических артерий,
- непереносимость общего наркоза,
- наличие мочевого катетера или проведение цистостомии.
Эмболизация назначается в случае тяжелых сопутствующих заболеваний у мужчины: сахарный диабет, почечная или печеночная недостаточность, нарушение кроветворной функции, ишемия, инфаркт миокарда, инсульт. Процедура проводится при отказе пациента от открытой операции, или если состояние здоровья не допускает разреза мочевого пузыря, хирургического вмешательства через мочеиспускательный канал. Врачи настаивают на эмболизации, когда происходит разрыв сосудов, по которым поступает кровь в простату.
Противопоказания
Решение о целесообразности проведения эмболизации принимается лечащим врачом. В случае дополнительных заболеваний у мужчины необходима консультация нескольких профильных специалистов. Процедура доступна не всем, имеет ряд противопоказаний:
- индивидуальная непереносимость йодистых препаратов,
- флотирующие (способные оторваться в любой момент) тромбы,
- окклюзия подвздошных сосудов,
- патологические изменения подвздошных сосудов,
- коагулопатия (нарушение свертываемости крови).
Невозможно сделать эмболизацию простатических артерий при нарушении проходимости подвздошных сосудов. В этом случае возникают сложности с направлением по ним катетера.
В борьбе с гиперплазией предстательной железы чаще всего используется медикаментозная терапия. К сожалению, в 10% случаев данный способ лечения не приносит желаемых результатов, поэтому возникает необходимость оперативного вмешательства. До недавнего времени применялись аденомэктомия либо трансуретральная резекция простаты. Новейшая методика – блокировка простатических артерий (эмболизация), в основе которой лежит внедрение специальных веществ, что перекрывают просветы сосудов.
Эффективность процедуры зависит от нескольких факторов: запущенности заболевания, возраста пациента, наличия инфекций органов мочевой системы, сопутствующих патологий, степени нарушения мочеиспускания, опыта эндоваскулярного хирурга, который будет проводить ЭАП.
Исследования, проведенные на международном уровне, показали, что в 90% случаев эмболизация дает положительный результат. В испытуемую группу вошли мужчины возрастом от 47 до 86 лет, большая часть которых имели лишний вес и сопутствующие патологии разной степени сложности.
У трети пациентов положительная уродинамика наблюдается в течение недели. Снижаются позывы, болезненные ощущения и прочие отрицательные симптомы. В первый месяц после блокировки простатических артерий отмечается уменьшение размера предстательной железы, восстановление сексуальной функции и мочеиспускания. Есть случаи, когда необходимый эффект достигается на протяжении года.
Подготовительный этап
Проведение такой высокотехнологичной операции требует тщательной предварительной диагностики. Плановая госпитализация включает ряд инструментальных обследований и анализов: общий и биохимический крови, ВИЧ, реакцию Вассермана, пробы на гепатит, коагулограмму, электрокардиограмму, флюорографию. 
Дополнительно рекомендуется пройти УЗИ предстательной железы и сосудов ног. При подозрении на рак назначаются анализы на онкомаркеры, уровень простатспецифического антигена в крови и биопсия тканей простаты.
Обязательно проводится ректальное пальцевое обследование пораженного органа. Перед операцией выполняется проба на чувствительность пациента к анестезии. Необходимо сообщить врачу о наличии аллергии на любые медикаменты.
Мужчина выполняет гигиенические процедуры и сбривает волосяной покров в интимной зоне (на 10 см ниже и выше паховой складки). Утром нужно сделать очистительную клизму.
Накануне эмболизации нежелательно употреблять тяжелую, калорийную пищу. За четыре часа до процедуры следует отказаться от еды и ограничить питье.
Непосредственно перед операцией пациенту устанавливают гибкий катетер для отвода урины во время эмболизации артерий в области простаты. Выполняется предварительная медикаментозная подготовка к хирургическому вмешательству, которая включает седативные и антибактериальные препараты. В случае возникновения негативных эффектов во время процедуры проводится симптоматическая терапия.
Все манипуляции мужчина переносит в положении лежа на спине. Чтобы контролировать самочувствие больного, его подключают к специальной аппаратуре. Датчики, отслеживающие работу сердца, размещают на груди, на руку надевают манжету, позволяющую следить за давлением. На палец руки устанавливают датчик, контролирующий уровень кислорода в крови. Некоторым пациентам (особенно преклонного возраста) может понадобиться дополнительная его подача через маску или пластиковую трубку в ноздри. 
Эмболизация относится к малоинвазивным и безболезненным методам борьбы с патологиями простаты. В общем наркозе мужчина не нуждается, достаточно местного обезболивания.
Процесс проведения ЭАП
Все манипуляции во время эмболизации артерий предстательной железы выполняются с использованием высокоточного медицинского оборудования, которое обеспечивает четкую визуализацию в режиме реального времени.
Для начала выполняется местное обезболивание в районе бедренной артерии. В паховой области делают небольшой прокол, через который специальный катетер вводят в крупный сосуд. По этой артерии гибкая трубка проходит к более мелким простатическим участкам.
После попадания инструмента в нужную артерию, обеспечивающую питание железы, проводится ее закупорка путем введения специального вещества, состоящего из крошечных частиц (эмболов). Эмболы перекрывают кровоток в пораженный орган. Кровоснабжение блокируется с двух сторон, при этом дополнительный прокол не требуется.
Чтобы проверить качество закупорки, выполняется контрольное контрастирование. В конце процедуры хирург убирает катетер, надавливает на область прокола, закрывает повязкой. В зависимости от состояния пациента и степени запущенности заболевания, эмболизация занимает 1–5 часов. Нет длительного реабилитационного периода.
Ожидаемые результаты
Статистика проведения ЭАП показала, что на протяжении нескольких лет после процедуры наблюдается стойкая ремиссия. Эмболизация артерий в районе простаты позволяет добиться следующих результатов:
- простата уменьшается более чем в половину,
- не требует повторного вмешательства,
- при катетеризации мочевого пузыря или цистостомии, уровень ПСА снижается до 5,37 нг/мл,
- без предварительного воздействия на органы мочеполовой системы уровень ПСА снижается до 3,5 нг/мл,
- аденоматозный узел уменьшается на 43%,
- нормализация процесса мочеиспускания (скорость – 13–16 мл/с, длительность – 30 секунд).

Пациенты, страдающие острой задержкой мочи, постоянно пользуются катетерами. После эмболизации артерий, питающих простату, у трети мужчин сразу нормализуется мочеиспускание. Негативный результат был зафиксирован только в 2% всех случаев. Пациентам понадобилось хирургическое вмешательство (троакарная эпицистомия) для создания условий оттока урины. Спустя полтора месяца больные полностью восстанавливаются и могут ходить в туалет самостоятельно.
Возможные осложнения
Эмболизация артерий предстательной железы – высокоэффективный и сравнительно безопасный способ лечения патологий. Мужчины переносят процедуру хорошо, а осложнения возникают редко. Среди отрицательных результатов проведения ЭАП выделяются: появление крови в моче (гематурия) и семенной жидкости (гемоспермия), нарушения мочеиспускания (задержка, частые позывы, болезненность процесса), аллергические реакции на медикаменты, появившиеся при операции и после нее. Половина пациентов жалуется на рези и тянущую боль в нижней части живота в первые часы после процедуры. Снять неприятный симптом могут нестероидные противовоспалительные препараты.
Самой распространенной проблемой является гематома, образовавшаяся на месте введения катетера. Обычно не требует дополнительного лечения и проходит самостоятельно спустя несколько дней. В тяжелых случаях рекомендуются холодные компрессы и специальные мази. Определенные сложности возникают с выводом контрастного вещества из тела мужчины. Процесс должен проходить под наблюдением врача, тогда маркер не доставит вреда мочеполовой системе пациента.
Для эмболизации не характерны инфекционные осложнения. Процедура малоинвазивная с минимальным вмешательством, а медицинские инструменты проходят тщательную стерилизацию. Если у врача возникли сомнения либо подозрения на инфицирование, тогда после операции назначается курс антибиотиков. Лекарственные препараты устранят любые патогенные микроорганизмы. В случае неопытности или халатности эндоваскулярного хирурга эмболизация станет причиной травм кровеносных сосудов.
Как правило, негативные последствия блокировки простатических артерий исчезают довольно быстро. За всю практику проведения процедуры не было случая возникновения тяжелых осложнений (например, кровотечений, нарушения потенции). Благодаря этому, метод приобретает все большую популярность, а его эффективность в борьбе с доброкачественной гиперплазией простаты признана во всем мире.
Успех проведения операции во многом зависит от качества медицинского оборудования и квалификации лечащего врача. Чтобы достичь положительного результата и не допустить возникновения осложнений важно подобрать хорошую клинику и профессионала, имеющего богатый опыт работы с мелкими сосудами. В этом случае риск для мужского здоровья минимален.
Аннотация научной статьи по клинической медицине, автор научной работы — Табынбаев Н.Б., Жуков О.Б., Ким Г.В., Боровский С.П., Жумагазин Ж.Д.
Приведены результаты использования эмболизации простатических артерий при доброкачественной гиперплазии предстательной железы (ПЖ) 3 больным, у 2 из них были надлобковые цистостомические дренажи. У пациента без надлобкового цистостомического дренажа количество остаточной мочи составляло 120 мл. Возраст пациентов колебался от 68 до 70 лет. По данным трансректального ультразвукового исследования, средний объем ПЖ составил 86,0 ± 12,6 см3. Четверым пациентам при раке предстательной железы (РПЖ) была выполнена суперселективная химиоэмболизация простатических артерий. Химиопрепаратом для проведения данной процедуры служил адриамицин в дозе 50 мг. У 2 из 4 больных РПЖ диагностирована гормонорезистентная форма. У 3 пациентов установлен РПЖ Т3bN0М0 стадии, у 1 – Т2bN0М0, гистологически верифицированные, сумма баллов по шкале Глисона соответственно 7, 7, 8, 9. Все четверо имели затрудненное мочеиспускание, количество остаточной мочи составило от 54 до 98 мл. В качестве источника транспортировки химиопрепарата применяли микросферы (гепасферы) размерами 300–500 мкм. Результаты лечения оценены через 1 мес. Показана эффективность методов при лечении доброкачественной гиперплазии и РПЖ в виде восстановления самостоятельного мочеиспускания, уменьшение остаточной мочи, снижения уровня простатспецифического антигена.
Похожие темы научных работ по клинической медицине , автор научной работы — Табынбаев Н.Б., Жуков О.Б., Ким Г.В., Боровский С.П., Жумагазин Ж.Д.
EMBOLIZATION AND CHEMOEMBOLIZATION PROSTATIC ARTERIES OF BENIGN PROSTATIC HYPERPLASIA AND PROSTATE CANCER
Эмболизация и химиоэмболизация простатических артерий при доброкачественной гиперплазии и раке предстательной железы
Н.Б. Табынбаев1, О.Б. Жуков2, Г.В. Ким3, С.П. Боровский1, Ж.Д. Жумагазин1, Е.К. Сарсебеков1, Н.Б. Малаев1
Владимировский спуск, 2а
Контакты: Олег Борисович Жуков ob.zhukov@yandex.ru
Приведены результаты использования эмболизации простатических артерий при доброкачественной гиперплазии предстательной железы (ПЖ) 3 больным, у 2 из них были надлобковые цистостомические дренажи. У пациента без надлобкового цистосто-мического дренажа количество остаточной мочи составляло 120мл. Возраст пациентов колебался от 68 до 70лет. По данным трансректального ультразвукового исследования, средний объем ПЖ составил 86,0 ± 12,6 см3. Четверым пациентам при раке предстательной железы (РПЖ) была выполнена суперселективная химиоэмболизация простатических артерий. Химиопрепара-том для проведения данной процедуры служил адриамицин в дозе 50 мг. У 2 из 4 больных РПЖ диагностирована гормонорези-стентная форма. У 3 пациентов установлен РПЖ Т3ЬШ0М0 стадии, у 1 — Т2ЬШ0М0, гистологически верифицированные, сумма баллов по шкале Глисона соответственно 7, 7, 8, 9. Все четверо имели затрудненное мочеиспускание, количество остаточной мочи составило от 54 до 98 мл. В качестве источника транспортировки химиопрепарата применяли микросферы (гепасферы) размерами 300—500 мкм. Результаты лечения оценены через 1 мес. Показана эффективность методов при лечении доброкачественной гиперплазии и РПЖ в виде восстановления самостоятельного мочеиспускания, уменьшение остаточной мочи, снижения уровня простатспецифического антигена.
Ключевые слова: предстательная железа, доброкачественная гиперплазия, рак, эмболизация простатических артерий, цисто-стома, химиоэмболизация
Embolization and chemoembolization prostatic arteries of benign prostatic hyperplasia and prostate cancer
N.B. Tabynbaev1, O.B. Zhukov2, G. V. Kim3, S.P. Borovsky1, Zh.D. Zhumagazin1, E.K. Sarsebekov’, N.B. Malaev1
1 National Scientific Center of Oncology and Transplantation; 3 Kerey and Zhanibek Khandar St., Astana city 020000, Kazakhstan;
2N.A. Lopatkin Research Institute of Urology and Interventional Radiology, Branch of National Medical Radiology Research Center, Ministry of Health of Russia; Build. 4, 51, 3rdParkovaya St., Moscow 105425, Russia;
Key words: prostate, benign prostatic hyperplasia, cancer, prostatic artery embolization, cystostomy, chemoembolization
Доброкачественная гиперплазия предстательной железы (ДГПЖ) и рак предстательной железы (РПЖ) занимают лидирующее место по числу заболеваний органов мужской половой сферы во всем мире. В лечении этих болезней много моментов, когда невозможно использовать рутинные методы лечения в силу ряда объективных причин (возраст и сопутствующие болезни). Следовательно, становится проблемным применение хирургических методов лечения, особенно при гормонорефрактерной форме РПЖ, когда раковые клетки нечувствительны к антиандрогенотерапии. Альтернативой рутинным методам лечения могут стать малоинвазивное хирургическое вмешательство — эм-болизация артерий предстательной железы (ЭАП) при ДГПЖ и химиоэмболизация при РПЖ. ЭАП для лечения пациентов с ДГПЖ широко применяется с 2009 г. В 2012 г. на сессии Общества интервенционной радиологии (Society of Interventional Radiology) в Сан-Франциско доложены данные применения метода ЭАП в течение 4 лет для лечения ДГПЖ двумя независимыми группами под руководством ЕС. Carnevale (Университет Сан-Паулу, Бразилия) и J. Pisco (Университет Лиссабона, Португалия) [1—3].
В России применяется ЭАП, но пока не имеет широкого распространения в силу таких обстоятельств, как дефицит эндоваскулярных хирургов, владеющих данным методом, и настороженным отношением к нему со стороны урологического сообщества. В Казахстане ранее не было публикаций на эту тему.
Указанные выше 2 группы ученых ведут рандомизированные исследования применения ЭАП. Для объективизации результатов опыт применения ЭАП в лечении ДГПЖ накапливается в нескольких российских клиниках. Судя по данным литературы, появились единичные сообщения о применении химиоэмболизации артерий ПЖ при РПЖ в российских научных медицинских журналах в России [4—6]. Нам не удалось найти в зарубежных источниках информацию о применении химиоэмболизации артерий ПЖ при ее раке.
В настоящее время показаниями для ЭАП являются аденома ПЖ объемом > 40 см3, невозможность выполнить аденомэктомию, трансуретральную резекцию (ТУР) в связи с общим тяжелым состоянием пациента, сопутствующими заболеваниями, неэффективность консервативного лечения, отказ пациента от открытой или разновидности ТУР операции, желание больного сохранить антеградное семяизвержение и избежать эяку-ляторной дисфункции [7].
У пациентов с ДГПЖ неспецифическими противопоказаниями для ЭАП являются аномалии развития подвздошно-бедренных артериальных сегментов, окклюзия артерий данных сегментов, флотирующие тромбы в бассейне вен нижних конечностей, непереносимость рентгенконтрастного препарата.
Специфическими противопоказаниями считаются атония мочевого пузыря, острое инфекционное поражение мочевого пузыря, острая почечная недостаточность. Вопрос о цистолитиазе и/или выраженной средней доле сейчас активно обсуждается в литературе [3—7].
Решение о необходимости ЭАП коллегиально принимается урологом и эндоваскулярным хирургом. В России группа из урологов и эндоваскулярных хирургов впервые применила химиоэмболизацию при РПЖ с положительным эффектом в 2015 г. [6].
Материалы и методы
Четверым пациентам с РПЖ была выполнена суперселективная химиоэмболизация простатических артерий (СХЭПА). В качестве химиопрепарата использовали адриамицин в дозе 50 мг. Для его транспортировки применяли микросферы (гепасферы) (Merit Medical, США) размерами 300—500 мкм. У 2 из 4 больных РПЖ была гормонорезистентная форма. У 3 пациентов установлен РПЖ Т3ЪК0М0 стадии, у 1 пациента — Т2ЪК0М0, гистологически верифицированные, сумма баллов по шкале Глисона составила соответственно 7, 7, 8, 9. Все пациенты имели затрудненное мочеиспускание, количество остаточной мочи колебалось от 54 до 98 мл. По данным ультразвуковой сонографии, у 1 больного имелось выраженное расширение верхних мочевых путей. По данным ТРУЗИ, средний объем ПЖ составил 63 см3. Средний уровень простатспецифиче-ского антигена — 17 нг/мл.
Выполнялись следующие этапы: обрабатывалось операционное поле, чаще использовался правосторонний бедренный доступ, в 1 случае — левосторонний лучевой доступ. Проводилась местная анестезия места пункции артерии, затем выполняли пункцию и установку интродьюсера в артерию (по Сельдингеру). В дальнейшем выполняли артериоскопию для подтверждения правильного внутрисосудистого положения интродью-сера в просвете артерии. Далее проводили брюшную аортографию и серийную тазовую ангиографию, после чего осуществляли селективную и суперселективную катетеризацию и артериографию нижнепузырных артерий. Затем по коаксиальной методике проводили непосредственную катетеризацию микрокатетером ветвей
простатической артерии и эмболизацию или химио-эмболизацию. Мы использовали микросферы 300— 500 мкм, для химиоэмболизации применяли гепасфе-ры, предварительно насыщенные доксирубицином. Завершающим этапом стала контрольная артериогра-фия, после чего удаляли катетер из артерии и проводили гемостаз (рис. 1—4).
Рис. 1. Пациент В., 68лет. РПЖ Т3ЬШМ0 стадии. Суперселективная химиоэмболизация простатических артерий с левой стороны
Рис. 2. Пациент В., 68лет. РПЖТ3ЬЫ0М0. Суперселективная химиоэмболизация простатических артерий с правой стороны
Рис. 3. Пациент Г., 69лет. Доброкачественная гиперплазия предстательной железы II стадии. Суперселективная эмболизация простатических артерий с левой стороны
Рис. 4. Пациент Г., 69лет. ДГПЖ IIстадии. Суперселективная эмболизация простатических артерий с правой стороны
Все пациенты были выписаны на 3-й день после оперативного вмешательства. Все были приглашены на контрольный осмотр через 1 мес после ЭАП и СХЭПА.
Результаты лечения оценивались по общему состоянию, жалобам, симптомам нижних мочевых путей по шкале 1Р8Б, уменьшению объема ПЖ и количеству остаточной мочи. У больных РПЖ определяли уровень простатспецифического антигена в динамике.
В первые 7 дней у 3 из 7 пациентов наблюдался умеренный болевой синдром, который проходил после применения ненаркотических анальгетиков. Не отмечалось изменений в анализах крови, гипертермии, а также местных патологических изменений в области введения сосудистого катетера в бедренную артерию.
Основные показатели результативности ЭАП и СХЭПА у больных с ДГПЖ и РПЖ до лечения и в динамике через 1 мес после лечения приведены в таблице. При контрольном обследовании через 1 мес после лечения у всех пациентов, имеющих обструктивную симптоматику,
Основные показатели результативности ЭАП и СХЭПА у больных ДГПЖ и РПЖ в динамике
Пациенты с ДГПЖ
Объем ПЖ, мм3: до лечения через 1 мес
Количество остаточной мочи, мл: до лечения через 1 мес
Уровень ПСА, нг/мл: до лечения через 1 мес
Шкала 1Р88, балл: до лечения через 1 мес
отмечено улучшение мочеиспускания. Согласно шкале 1Р8Б, через 1 мес после операции градиент уменьшения составил 37,4 ± 3,6 %, индекс качества жизни Ь изменился и в среднем составил 3,2.
У пациента с РПЖ и с двусторонним расширением верхних мочевых путей отмечено значительное сокращение пиелоэктазии с 3,8 до 2,1 см. У всех 7 пациентов количество остаточной мочи не превышало в среднем 50 см3. У 2 пациентов удалены надлобковые цистосто-мические дренажи в связи с восстановлением самостоятельного мочеиспускания. По данным контрольного ТРУЗИ, при ДГПЖ объем ПЖ уменьшился в среднем с 86 до 47 см3, или на 48 %, при РПЖ — с 63 до 38 см3, или на 43 %.
Таким образом, ЭАП и СХЭПА являются малоин-вазивными, но эффективными методами лечения при ДГПЖ и РПЖ. Данные методики целесообразны для более широкого применения, когда интеркуррент-ные заболевания не позволяют выполнить радикальные операции по поводу ДГПЖ, РПЖ и его гормонореф-
рактерной формы. Перспективным направлением для применения этого метода станет лечение больных с тяжелой сопутствующей патологией и высоким операци-онно-анестезиологическим риском. Важными дополнительными направлениями применения будут служить лечение ЭАП и СХЭПА пациентов с цистостомой и сохраненной емкостью мочевого пузыря, а также с острой задержкой мочи на фоне ДГПЖ. В перспективе многоцентровые исследования и накопление знаний в этой области помогут ответить на вопрос о необходимости применения химиоэмболизации в ликвидации продолженного роста и местного локального рецидива РПЖ. Данные методики ведения больных можно рекомендовать для применения в клинической практике крупных урологических и многопрофильных лечебно-профилактических учреждений. Предварительные результаты и небольшое число пациентов с коротким сроком наблюдения не дают оснований для окончательных выводов о длительности и необходимости повторных сеансов СХЭПА при РПЖ, однако по мере накопления опыта можно будет представить четкий протокол ведения этой категории больных.
1. Carnevale F.C., Motta Leal Filho J.M., Antunes A.A. et al. Quality of life and symptoms relief support prostatic artery embolization for patients with acute urinary retention due to benign prostatic hyperplasia. J Vasc Interv Radiol 2012;24(4):535-42.
2. Pisco J^., Pinheiro L.C., Bilhim Т. et al. Prostatic arterial embolization to treat benign prostatic hyperplasia. J Vasc Interv Radiol 2011;22(1):11-9.
3. Carnevale F.C., Antunes A.A., da Motta Leal Filho J.M. et al. Prostatic artery embolization as a primary treatment for benign prostatic hyperplasia: preliminary results in two patients. Cardiovasc Intervent Radiol 2010 33(2):355-61.
4. Нотов К.Г., Ким Г. В., Добряк А.Ю.
embolization, a method for surgical treatment of benign prostatic hyperplasia. Meditsina i obrazovanie v Sibiri = Medicine and Education in Siberia 2015;5. (In Russ.)].
5. Яковец Е.А., Неймарк А. И., Карпенко А. А., Яковец Я. В. Эмболи-зация артерий предстательной железы в лечении больных аденомой предстательной железы с высоким хирургическим риском. Андрология и гениталь-ная хирургия 2010;(1):38—43. [Yakovets E.A., Neymark A.I., Karpenko A.A., Yakovets Ya.V. Prostatic artery embolization in treatment
of patients with prostate adenoma and high surgical risk. Andrologiya i genitalnaya khirurgiya = Andrology and Genital Surgery 2010;1:38-43. (In Russ.)].
6. Неймарк А.И., Тачалов М.А., Неймарк Б. А. и др. Использование суперселективной рентгенэндоваскулярной химиоэмболизации в лечении пациентов с локализованным раком предстательной железы: наш первый опыт.
