Вирусов папилломы человека существует более ста различных видов.
На основании способности к активации опухолевых изменений в клетках организма все известные папилломавирусы можно разделить на три основных типа: неонкогенные, высокого онкогенного риска и низкого онкогенного риска. Важно понимать, что человек одновременно может заразиться несколькими типами вируса.
Неонкогенные папилломавирусы никогда не станут причиной злокачественного заболевания.
Вирусы низкого онкогенного риска вызывают появление вирусных бородавок на коже, а также аналогичных образований на слизистых – остроконечные кондиломы. Эти образования часто называют папилломы, но в медицинской терминологии это не принято. При определенных условиях они могут привести к озлокачествлению вызванного ими процесса, но это происходит сравнительно редко.
Вирусы высокого онкогенного риска более опасны, под влиянием различных факторов они могут спровоцировать появление злокачественной опухоли. Именно они являются причиной предраковых заболеваний и рака шейки матки — наиболее часто встречаемой злокачественной опухоли женской половой системы в репродуктивном периоде.
Попав в организм, вирус папилломы человека проникает в эпителий. Длительное присутствие вируса в клетках шейки матки вызывает изменения, приводящие к появлению раковых клеток. Ежегодно персистирующая инфекция вызывает более чем 500 000 случаев заболевания раком шейки матки. При этом практически половина женщин умирает в течение первого года в связи с поздним диагностированием III — IV стадий заболевания.
Факторы риска ВПЧ
Как передается вирус папилломы? Основным путём заражения является половой. Использование барьерной контрацепции (презервативы) снижает риск передачи, но не на 100%. Также существует контактный механизм передачи — через повреждения на коже, при контакте с зараженной поверхностью пораженные клетки могут проникать в организм человека.
Симптомы и первые признаки заболевания
Даже попав в организм человека, вирусы папилломы человека вначале могут никак себя не проявлять. При снижении иммунитета вирус активируется и начинает размножаться. На этой стадии возникают клинические проявления.
При заражении ВПЧ низкого онкогенного риска пациентов наиболее часто пациентов беспокоит визуальный дискомфорт, связанный с появлением бородавок на любом участке кожи и слизистых оболочек. Данные образования в аногенитальной области носят особое название – остроконечные кондиломы или аногенитальные бородавки. Они нередко сопровождаются кожным зудом. Как правило, это образования различных оттенков коричневого цвета, имеющие неровную поверхность, могут быть на узком основании (ножке).
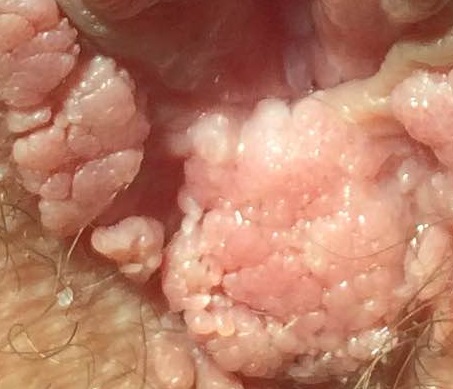
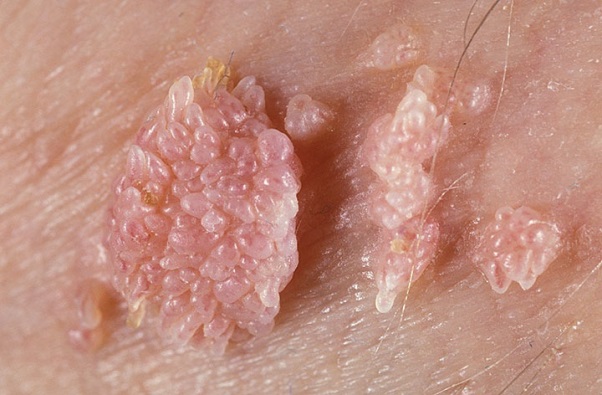
Внешний вид кожных бородавок
Отличительной особенностью бородавок и кондилом является быстрый и мультицентрический рост. Наличие единичных бородавок на коже и слизистых является косвенным признаком ВПЧ инфекции и требует диагностики.
Большинство инфекций, которые вызваны высокоонкогенными типами ВПЧ, протекают бессимптомно. Возможно лишь общее снижение иммунитета. Зачастую вирус можно определить только после забора мазков. Однако длительное присутствие онкогенного типа вируса приводит к развитию предраковых патологий, которые без соответствующей терапии перерождаются в злокачественный процесс. Хорошо известно, что на ранних стадиях заболевания рак шейки матки практически бессимптомен, а специфические проявления (выделения и нерегулярные кровотечения, боли в спине, в области таза, в ногах; односторонняя отечность ног) возникают уже при большом распространении процесса.
Вирусы высокого онкогенного риска — HPV 16, 18, 31, 33, 39, 50, 59, 64, 68, 70. Наиболее изученные и агрессивные — 16 и 18 типов, эти ВПЧ у женщин являются причиной до 70% всех случаев предраковых состояний и рака шейки матки.
Диагностика ВПЧ у женщин
Выявить отдельный тип вируса папилломы достоверно позволяет метод полимеразной цепной реакции, так называемый ПЦР. Для анализа достаточно мазка из влагалища в пробирку со специальной средой. ПЦР — это простой, но высокочувствительный способ.
Положительный тест на ВПЧ 16 и 18 ассоциируется с более высоким риском злокачественного заболевания.
Пробирка типа Eppendorf для сбора материала для анализа на ВПЧ
Важно понимать, что изменения на шейке матки часто не видны невооруженным глазом, поэтому необходимо использовать специальные методы дообследования, такие как кольпоскопия и мазки с шейки матки и цервикального канала.
Кольпоскопия – осмотр слизистой шейки матки с помощью специального прибора — кольпоскопа.
При этом проводятся 2 пробы:
- Acetic Acid Test — тест с раствором уксусной кислоты
- проба Шиллера — обработка поверхности шейки матки йодным раствором Люголя.
На основании полученных данных судят об удовлетоворительной или неудовлетворительной кольпоскопической картине. Это исследование проводят с использованием специальной окраски по методу Папаниколау, поэтому оно часто встречается под термином PAP test.
Выявление патологического типа мазка и неудовлетворительная кольпоскопическая картина являются показаниями для биопсии подозрительных очагов.
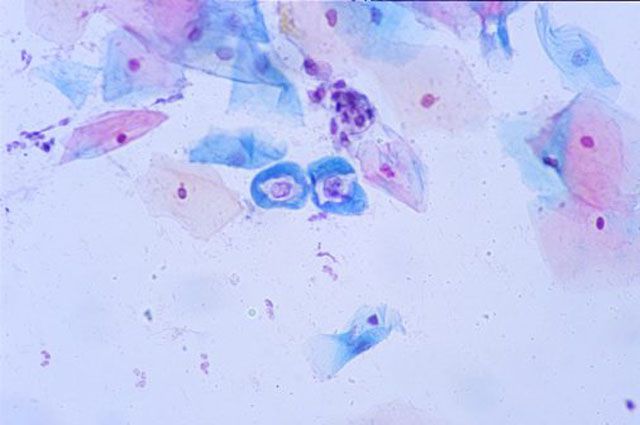
Окраска мазка по методу Папаниколау
Профилактика и лечение
На настоящий момент активно обсуждается вопрос профилактики вируса папилломы человека.
Пациенты часто спрашивают, существует ли вакцина от рака шейки матки?
На самом деле такой вакцины не существует. Не существует лечения вируса папилломы, которое бы позволило полностью убрать вирус из организма человека. Лечению подлежит только результат воздействия вируса на клетки организма. Используются схемы, содержащие противовирусные препараты и иммуномодуляторы. Сами папилломы можно удалять хирургическим путем: радиоволновой методикой, лазерокоагуляцией, а также методами химической деструкции.
Все данные виды терапии активно применяются на базе Национального медицинского исследовательского центра онкологии имени Н.Н. Петрова после тщательного осмотра, обследования и индивидуального подбора лечения высококвалифицированными специалистами. Прохождение терапии в условиях неспециализированного учреждения может повлечь распространение вируса на окружающие ткани, повреждённые в процессе удаления поражённых участков.
Вакцины против вируса папилломы человека
На сегодняшний день используются 2 вакцины, рекомендованные к применению. Оптимальным считается проведение вакцинации девочек до начала половой жизни.
С 2006г применяется вакцина Gardasil (рис.4). Это квадривалентная вакцина, т.е. она направлена против ВПЧ 6, 11, 16 и 18 типов.
Рекомендуемый курс вакцинации состоит из 3 доз и проводится по схеме: первая доза — в назначенный день; вторая — через 2 мес после первой; третья — через 6 мес после первой. Проведение полного курса приводит у 99% вакцинированных к образованию стойкого иммунитета на период не менее 36 мес во всех возрастных группах. Вакцинации подлежат дети и подростки, а также молодые женщины в возрасте от 9 до до 26 лет.
Другая вакцина — Церварикс. Создана в 2007году для профилактики заболеваний, вызванных вирусами папилломы человека 16 и 18 типов. Полный курс вакцинации по схеме 0–1–6 мес приводит к образованию специфического иммунитета у 100% вакцинированных через 18 мес после введения последней дозы вакцины в возрастных группах от 10 до 25 лет. Необходимость ревакцинации к настоящему времени не установлена.
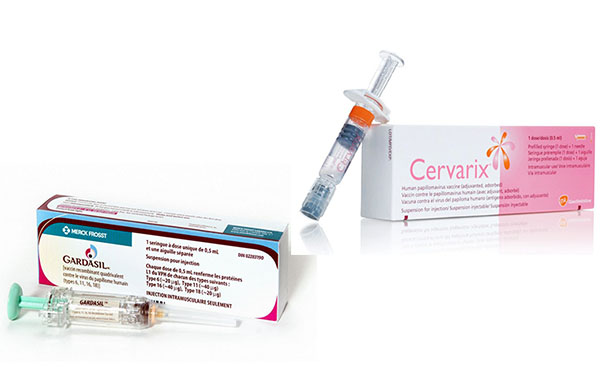
Вакцины против вируса папилломы человека а) Гардасил б) Церварикс
В ряде регионов РФ пациенток прививают бесплатно, в других же вакцинация осуществляется на коммерческой основе.
Динамическое наблюдение
На сегодняшний день скрининг рака шейки матки на территории РФ регламентирован Приказом № 572н Министерства здравоохранения: профилактические осмотры c проведением цитологического скрининга проводятся не реже 1 раза в год. Контроль ПЦР отделяемого из влагалища на наличие вируса папилломы человека в рамках профилактического медицинского осмотра не прописан. Однако, согласно мировым стандартам, определение ВПЧ является важным и неотъемлемым фактором прогноза заболеваний шейки матки. Первичное тестирование ВПЧ рекомендовано, как и рекомендован цитологический скрининг эпителия шейки матки. Интервал скрининга для пациентов с нормальными результата цитологического теста и отрицательным тестом на ВПЧ варьирует от 1 до 3х лет.


Авторская публикация:
СМИРНОВА ОЛЬГА АЛЕКСЕЕВНА
врач-онколог, акушер-гинеколог
НМИЦ онкологии им Н.Н. Петрова Минздрава России
Текущий раздел: Гинекология
Роль папилломавирусной инфекции при раке женской репродуктивной системы в постменопаузальном периоде.
Бабаева Н.А., Ашрафян Л.А., Антонова И.Б., Люстик А.В.
Бабаева Наталия Александровна – к.м.н., научный сотрудник отделения гинекологии ФГБУ РНЦРР, +7(4990)1206077, e — mail : natbabaeva @ yandex . ru
Ашрафян Лев Андреевич – член-корреспондент РАМН, д.м.н., профессор, руководитель отделения гинекологии ФГБУ РНЦРР
Антонова Ирина Борисовна – д.м.н., ведущий научный сотрудник отделения гинекологии ФГБУ РНЦРР
Бабаева Наталия Александровна, +7(499)1206077, e — mail : natbabaeva @ yandex . ru
Введение: в работе изучен спектр вирусов папилломы человека, а также произведено определение онкобелка Е 7.
Материалы и методы: образцы ткани 67 пациенток злокачественными опухолями яичников, 80 больных раком вульвы, 60 больных раком эндометрия, 111 женщин, находившихся в периоде постменопаузы без анамнестических данных о наличии рака любой локализации, в качестве группы контроля.
Результаты исследования свидетельствуют о существенной роли инфекционного фактора в патогенезе таких злокачественных опухолей как рак вульвы и эпителиальный рак яичников, в то время как в возникновении рака эндометрия вирусная инфекции не играет существенной роли.
Ключевые слова: рак вульвы, эпителиальный рак яичников, рак эндометрия, папилломавирусная инфекция, онкобелок Е 7
The role of papillomavirus infection in cancers of female reproductive system after menopause.
Babaeva , N . A ., Ashrafyan L . A., Antonova I . B. , Lyustik A . V .
Federal State Enterprise Budget“Russian Scientific Center of Roentgen radiology” of Russian Health Development Ministry, Moscow
Introduction : We studied the spectrum of human papillomaviruses , and defined levels of oncoprotein E7 .
Materials and Methods: 67 tissue samples from patients with malignant ovarian tumors , 80 patients with vulva cancer, 60 patients with endometrial cancer and 111 postmenopaus al women in without anamnestic data on the presence of cancer were a control group .
These results suggest an important role of infectious factors in the pathogenesis of malignant tumors such as vulvar cancer and the epithelial ovarian cancer, while virus infection does not play a significant role in the occurrence of endometrial cancer.
Key words: vulva cancer, epithelial ovarian cancer, endometrial cancer, HPV infection, oncoprotein E7
Статистический анализ показателей количества злокачественных новообразований в России свидетельствует о росте заболеваемости раком женских половых органов за последнее десятилетие. Число больных с впервые установленным диагнозом на 100 000 населения в 2007 году составило при раке шейки матки (РШМ) 15,9 (в Европе 14,2, в мире 11,1), при раке эндометрия (РЭ) 20,1 (в Европе 17,6, в мире 12,8), при раке яичников (РЯ) 15,4 (в Европе 13,5, в мире 10,3) [7]. При этом абсолютный прирост за 10 лет с 1997г был наиболее существенным при РЭ – 32,6%, при РЯ — 14,3%, при РШМ наименьший – 6,6%. В структуре онкологической заболеваемости за период с 1996 г . по 2006 г . отмечено снижение доли РШМ, увеличение доли РЭ. При этом РЭ находится на 5 месте – 7,0%, РШМ на 6 – 5,2%, РЯ на 7 месте – 4,9% [3,4]. За последние десятилетия во всех экономически развитых странах отмечается неуклонный рост заболеваемости РЭ. Почти все авторы отмечают, что 80-90% больных находятся в постменопаузе [8,10,11]. Тенденция к снижению доли больных с запущенными процессами ( III — IV ст.), остается не столь явной (8,8% за 10 лет с 1997 г .). Максимальная запущенность отмечалась при РЯ (одна из самых высоких среди всех злокачественных опухолей) – 62,9% (соответственно, самая высокая смертность – 6 место среди всех злокачественных опухолей – 5,6%). При РЭ этот показатель находился на уровне 21,8% [3,7]. Средний возраст заболевших РШМ был 55,1 года, при РЭ 62,0 года, при РЯ – 58,5 года. Анализ динамики заболеваемости демонстрирует рост в периоде после наступления менопаузы (в среднем это возраст 51 год). Тенденция эта характерна для всех опухолей женской репродуктивной системы. Наиболее ярко она прослеживается при РЭ – с 11,4 в возрасте 40-44 года и 21,7 в 45-49 лет до 42,0 в возрасте 50-54 года и далее рост до максимума 59,7 и 58,9 в 60-69 лет. При раке яичников рост заболеваемости также предшествует наступлению менопаузы (с 14,6 в 40-44 года до 27,9 в 50-54 года). Далее число заболевших постепенно растет, достигая наибольших значений в 36,3-37,3 в возрасте 65-74 года. При РШМ заболеваемость возрастает, начиная после 30 лет, пик заболеваемости 29,0-29,4 приходится на возраст в 65-74 года [3,4,7].
Таким образом, именно в периоде постменопаузы отмечается рост заболеваемости опухолями женской репродуктивной системы. Это еще раз подталкивает нас к необходимости более полного изучения и осмысления всех процессов, идущих в организме женщины в этом возрасте, а в особенности тех из них, что приводят к возникновению рака.
Вирус папилломы человека ( Human papillomavirus ( HPV ) is one of the most common causes of sexually transmitted infection ( STI ) in the world . ВПЧ) является одной из наиболее распространенных инфекций, передаваемых половым путем (ИППП) в мире. At least 20 million people in this country are already infected. Сама по себе инфекция ВПЧ – не заболевание . В большинстве случаев заражения иммунная система справляется с вирусом в течение года без какого-либо лечения. От момента инфицирования вирусом до клинических проявлений, а затем злокачественной трансформации, проходит достаточно длительный промежуток времени, более 10-20 лет. В постменопаузальном возрасте происходит кардинальная перестройка многих гомеостатических систем. В результате нарушаются механизмы взаимодействия макро-микроорганизм, изменяется баланс и регуляция микробиоценоза урогенитального тракта. В этой ситуации неустойчивого равновесия агрессивное взаимодействие инфекционного агента с клеткой приводит к возникновению опухоли.
Отмечено, что в инфицированных клетках ВПЧ может существовать как в свободной эписомальной, так и интегрированной формах. Интеграция вирусного генома в генетический аппарат клетки хозяина характеризует переход к предраковым состояниям или инвазивному раку [19].
В исследованиях in vitro доказано, что интеграция вирусной ДНК в клеточной геном хозяина ведет к суперэкспрессии гена Е6 ВПЧ высокого онкологического риска, продукт которого – онкобелок Е6, взаимодействуя с супрессорным белком р53, приводят к ингибированию последнего [15,16].
Другой антионкоген – ген ретинобластомы ( RB ) находится в хромосоме 13, его инактивация чаще всего происходит под действием ДНК-содержащих вирусов, в частности, ВПЧ высокого онкологического риска. Так, взаимодействие вирусного белка Е7 ВПЧ с продуктами гена-супрессора RB приводит к выделению транскрипционного фактора Е2 F , который действует на промоторные элементы множества клеточных генов, экспрессия которых специфична для синтетического периода цикла деления клетки ( S -фаза), и как следствие, приводит к неконтролируемой пролиферации клеток [13,19].
Онкобелок Е7 поддерживает репликацию вируса в дифференцирующихся клетках, задерживая их терминальную дифференцировку, что блокирует экспрессию генов, контролирующих клеточное деление. Таким образом, онкопротеин Е7 ВПЧ способен стимулировать неконтролируемый синтез ДНК. И, наконец, онкопротеин Е7 подавляет индукцию генов, отвечающих активацией экспрессии под влиянием эндогенного интерферона. Таким образом, накопившиеся в онкогинекологии за последние два десятилетия факты свидетельствуют о связи инфицирования вирусом папилломы человека и развития рака женских половых органов, в основном, рака шейки матки. Роль ВПЧ в злокачественной трансформации других опухолей женского полового тракта остается недостаточно изученной. Целью нашего исследования явилось изучение данного инфекционного фактора при раке яичников, вульвы и раке эндометрия.
В нашем исследовании с целью решения поставленных задач были сформированы следующие группы пациенток, наблюдавшихся и лечившихся в ФГУ РНЦРР МЗ России за период с 2000 по 2010г.г.: 111 женщин, находящихся в периоде постменопаузы без анамнестических данных о наличии рака любой локализации, и группы больных раком женских половых органов в постменопаузальном возрасте, в том числе 60 больных раком эндометрия (РЭ), 67 больных со злокачественными эпителиальным опухолями яичников (ЗЭОЯ), и 80 больных раком вульвы (РВ).
Распределение больных РЭ по стадиям было следующим: I стадия была у 43 (71,7%) больных, II стадия – у 7 (11,7%), III стадия – у 10 (16,6%). При ЗЭОЯ I стадия была диагностирована у 19 (28,4%) больных, II стадия – у 11 (16,4%), III стадия – у 31 (46,3%) и IV стадия – у 6 (8,9%). При РВ I стадия определялась у 17 больных, II стадия — у 19, III стадия — у 19 и IV стадия — у 25 женщин.
Все обследуемые пациентки находились в периоде постменопаузы. Средний возраст в группе больных РЭ составил 62± 2,3 г ., ЗЭОЯ — 56± 1,8 г ., РВ — 66±3,1г., в группе контроля — 58±3,1г.
Для обнаружения вирусов в образцах опухолевой и нормальной тканей в настоящей работе применяли метод полимеразной цепной реакции (ПЦР). Этот метод позволяет избирательно синтезировать in vitro относительно небольшие участки ДНК. Необходимым условием для проведения ПЦР является информация о нуклеотидной последовательности амплифицируемой области ДНК. Выбор участка ДНК осуществлялся путем гибридизации матричной ДНК с двумя искусственно синтезированными праймерами. Один цикл ПЦР включает несколько этапов с различными температурными режимами.
Полученные данные обрабатывались при помощи пакета статистических программ “ SPSS 19.0 for Windows ” . Для графического представления данных использовался MS Excel . При этом соблюдались общие рекомендации для медицинских исследований. Определялись арифметические величины (М), их ошибки ( m ). Для оценки статистической значимости различий (р-оценка) качественных данных использовались следующие критерии: χ 2 (хи-квадрат) Пирсона для четырехпольных таблиц (2 группы, дихотомические данные), критерий χ 2 (хи-квадрат) Пирсона с поправкой Йетса на непрерывность для четырехпольных таблиц и малых выборок. Для оценки статистической значимости различий (р-оценка) количественных данных применялся t -тест для сравнения двух групп; метод Ньюмена-Коулса (аналог t -теста) применялся для сравнения нескольких групп). Различия в полученных показателях считались достоверными при P
Последние годы принесли немало интересных эпидемиологических и клинических наблюдений в области молекулярной биологии, свидетельствующие о присутствии папилломавирусной инфекции (ПВИ) в тканях злокачественных эпителиальных опухолей яичников (ЗЭОЯ) [9,12,17,18]. Тем не менее, до настоящего времени подтверждений истинной причастности ВПЧ в процессе злокачественной трансформации эпителия яичников не получено. Все это и предопределило изучение нами целого ряда принципиальных моментов, обосновывающих и формирующих позиции инфекционной составляющей в канцерогенезе эпителиального РЯ. К их числу можно отнести: частоту сочетания ПВИ со ЗЭОЯ, специфичность ассоциации различных серотипов ВПЧ при серозном и муцинозном вариантах эпителиального РЯ и продукция специфического протеина Е 7 в тканях ЗЭОЯ.
Таблица 1. Частота определения ВПЧ в образцах опухолевой и нормальной тканях яичников с использованием метода ПЦР (абс. число/%)
Вирус папилломы человека принадлежит к роду папилломавирусов. Он приводит к изменениям в процессе роста клеток кожного покрова и эпителия слизистых оболочек. Передается от человека к человеку при контакте с кожей или слизистыми оболочками. 
Особая опасность этого вируса в том, что поскольку он передается не только половым путем, но даже при рукопожатии, поцелуе, прикосновении, то почти невозможно уберечься от него. От генитального вируса, к сожалению, не спасает презерватив.
Другая опасность вируса – его скрытое течение. Сам инкубационный период может продолжаться от нескольких месяцев до нескольких лет, и даже потом вирус может никак не давать о себе знать – его можно выявить только при помощи анализа. Оставаясь невыявленным, вирус даром времени не теряет – он активизируется, размножается и затем уже проявляется, первыми (и быстро разрастающимися) образованиями.
Если у вас появились образования, напоминающие бородавки и папилломы, не стоит впадать в панику – всего вирусов папилломы человека существует около ста, и вовсе не все из них провоцируют рак. Все эти 100 вирусов делятся на разновидности низкого, среднего, и высокого онкогенного риска. Известно также, что 40 видов из 100 могут базироваться на половых органах и анальном проходе. И вот уже из этих сорока – 13 разновидностей вируса обладают высокой онкогенной опасностью. Это 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68 типы вируса.
Проявления папилломавирусной инфекции 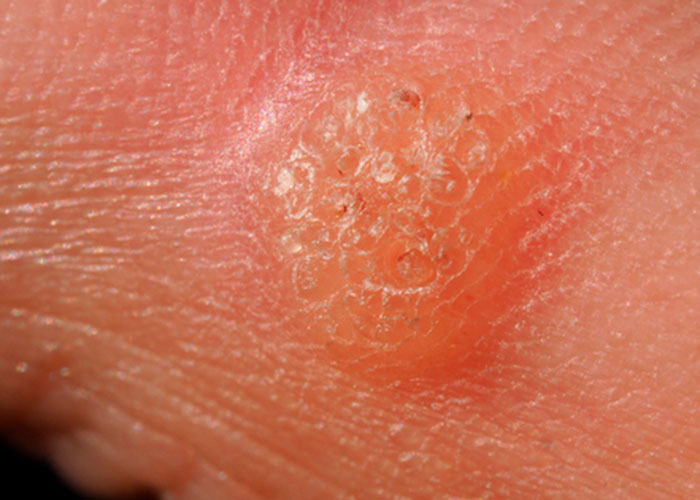
Вот некоторые факты 
Сегодня распространенность папилломавирусной инфекции генитального тракта внушает большие опасения – она уверенно выходит на первое место среди прочих вирусов и инфекций. Ввиду такой высокой распространенности вируса растет и урон, наносимый им здоровью в масштабах населения всей планеты.
- Рак шейки матки – следствие инфекции онкогенными типами ВПЧ – второй по частоте в структуре онкологических заболеваний у молодых женщин и в России и в глобальном масштабе. Ежедневно от рака шейки матки в России умирает 17 женщин, причем более чем в 70% случаев рак шейки матки вызывается 16 и 18 типами вируса.
- Эти же типы преобладают при онкологической патологии вульвы, влагалища, анальной области, полового члена и ротовой полости.
- Генитальные кондиломы, как правило, обусловленные 6 или 11 типами ВПЧ, являются одной из самых частых причин обращения молодых людей в венерологические и гинекологические клиники. Хотя генитальные кондиломы и не злокачественны, они вызывают значительный физический и психологический дискомфорт и требуют многочисленных визитов к врачу для диагностики и лечения.
- Папилломатоз дыхательных путей может развиваться у детей, рожденных через родовые пути, если мать инфицирована 6 или 11 типами ВПЧ. Это заболевание редкое, однако приводит к повреждению голосовых связок, непроходимости дыхательных путей и является причиной значительной детской заболеваемости и смертности.
- Кондиломы у беременных из-за снижения иммунитета склонны размножаться, расти и разрыхляться. Таким образом, они могут весьма затруднять процесс родов.
Лечится ли вирус? 
Сам вирус имеет такую странную особенность – он порой может взять и сам собой исчезнуть из организма, а вот лечению не поддается, то есть невозможно добиться полного уничтожения в организме. Поэтому когда мы говорим о лечении, то подразумеваем лечение самих кондилом, папиллом и бородавок. Для этого применяются хирургические методы (удаление лазером, химическими препаратами, иссечение и пр.). У здоровых молодых пациентов применяются очень сильные т.н. цитотоксические препараты – препараты, уничтожающие размножающиеся клетки. Третья стратегия лечения подразумевает укрепление иммунитета при помощи интерфероновых препаратов. И, наконец, применяются общие и местные противовирусные препараты.
Профилактика. Существует ли она?
Сегодня созданы две вакцины, защищающие от двух наиболее онкогенных типов ВПЧ – 16 и 18, а одна из них – еще и от типов 6 и 11 , то есть она квадривалентна. Поскольку вакцины наиболее полно проявляют свою эффективность, если введены до встречи с вирусом, наиболее целесообразна, по мнению разработчиков, вакцинация девочек-подростков до начала половой жизни и молодых женщин.
В России эти вакцины не включены в календарь прививок, и как выясняется… может быть, даже к лучшему. Сегодня в мире грядет скандал, связанный с этими вакцинами. По словам компаний-производителей профилактическая вакцинация против ВПЧ доказала свою высокую эффективность в масштабных клинических исследований с участием десятков тысяч молодых женщин. С этим, однако, не согласна общественная организация, объединяющая женщин из шести разных стран. В настоящее время она предоставила в FDA (американское агентство по лекарствам и пищевым продуктам) сведения относительно побочных эффектов этих вакцин. В отчете скрупулезно обобщены данные о множественных нежелательных последствиях вакцин у привитых девочек в США, Великобритании, Австралии, Испании, Новой Зеландии. Это головная боль, выпадение волос, энцефалит, потеря зрения, сыпь, паралич групп мышц, обмороки, боли в суставах и мышцах. Согласитесь, пища для размышлений есть! По имеющимся на сегодня сведениям, FDA проверяет предоставленные сведения и, если они окажутся правдой, эта организация готова отказаться от своего прошлого заключения о полной безопасности этих вакцин.
Так что пока нам просто остается следить за своим иммунитетом и периодически проверять свое здоровье на предмет ВПЧ.
