Пазопаниб улучшает выживаемость без прогрессирования при раке яичников
По сравнению с плацебо длительный прием пазопаниба после окончания хирургического и химиотерапевтического этапов лечения приводит к удлинению выживаемости без прогрессирования у пациенток с раком яичников. Результаты второго промежуточного анализа исследования AGO-OVAR16 были представлены 1 июня 2013 года на конгрессе Американского общества клинической онкологии (ASCO), прошедшего в Чикаго с 31 мая по 4 июня 2013 г.
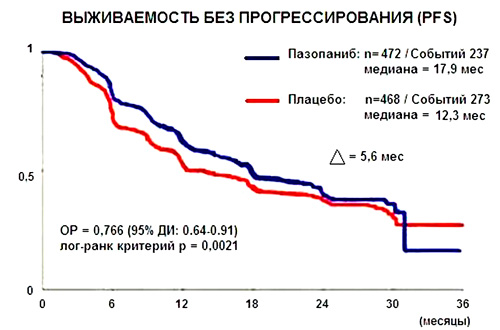
Медиана времени до прогрессии заболевания на фоне приема Пазопаниба составила 17,9 месяца по сравнению с 12,3 месяцами в группе пациентов, получавших плацебо. Ведущий автор исследования профессор Андреас Дю-Буа из Центральной клиники Эссена (Германия) считает, что они нашли препарат, который может длительно контролировать рак яичников.
В рандомизированное двойное слепое исследование III фазы было включено 940 пациенток с распространенными формами эпителиального рака яичников, фаллопиевых труб и первичного перитонеального рака. После завершения оперативного и химиотерапевтического этапов лечения пациентки были разделены в соотношении 1:1 на 2 группы. Первой группе назначали пазопаниб в дозе 800 мг/сут ежедневно в течение 24 месяцев, второй – плацебо. Химиотерапевтический этап включал проведение не менее 5 курсов комбинированной химиотерапии таксанами и препаратами платины. Первичной целью исследования стало определение выживаемости без прогрессирования (PFS) по критериям RECIST, вторичной – определение общей выживаемости, PFS по критериям GCIG безопасности и качества жизни.
Большинство пациенток, включенных в исследование, имели III или IV стадии заболевания (91%). В 58% случаях удалось выполнить циторедуктивную операцию в полном объеме. Медиана времени от момента постановки диагноза до рандомизации составила для первой группы 7,1 месяца и 7,0 месяцев – для второй группы.
Первый промежуточный анализ исследования AGO-OVAR16 не показал статистически значимых различий между двумя группами. При втором промежуточном анализе выявлено увеличение медианы PFS пациенток, получавших пазопаниб, до 17,9 мес. по сравнению с пациентками, принимавших плацебо, где медиана PFS составила 12,3 мес. Разница в 5,6 мес. между группами была статически значима (отношение рисков = 0,766, 95% ДИ от 0,63 до 0,91, p=0,0021). Показатели общей выживаемости между группами значимо не отличались (рис.1).
В группе, получавшей пазопаниб, чаще развивались нежелательные явления (21% против 11%). Основными нежелательными явлениями были повышение артериального давления, диарея, тошнота, головные боли и нейтропения, однако развитие фатальных серьезных нежелательных явлений было зарегистрировано лишь у 3 пациенток.
Новость подготовил: Р.Т. Абдуллаев, к.м.н., ассистент кафедры онкологии и лучевой терапии педиатрического факультета ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России.
Аннотация научной статьи по клинической медицине, автор научной работы — Румянцев А.А., Покатаев И.А., Тюляндин С.А.
Процессы неоангиогенеза критически важны для роста и распространения злокачественных опухолей. Антиангиогенная терапия прочно вошла в стандарты лечения диссеминированного рака яичников (РЯ). Результаты многочисленных исследований продемонстрировали ее эффективность на различных этапах терапии этого заболевания, наиболее изученным при РЯ антиангиогенным препаратом является бевацизумаб . В этой статье представлены обзор и анализ наиболее значимых исследований эффективности антиангиогенной терапии при РЯ, описаны различные аспекты ее применения при этом заболевании.
Похожие темы научных работ по клинической медицине , автор научной работы — Румянцев А.А., Покатаев И.А., Тюляндин С.А.
Modern aspects of antiangiogenic therapy in ovarian cancer
The process of angiogenesis is essential for the growth and spread of malignant tumours. Antiangiogenic therapy is deeply embedded in the standard treatment of disseminated ovarian cancer (OC). The numerous studies have demonstrated its efficacy in various stages of the therapy of this disease; bevacizumab is the best-investigated anti-angiogenic drug for OC. This article presents a review and analysis of the most significant studies of the efficacy of anti-angiogenic therapy in ovarian cancer , and describes various aspects of its use in this disease.
А.А. РУМЯНЦЕВ, И.А. ПОКАТАЕВ, С.А. ТЮЛЯНДИН
СОВРЕМЕННЫЕ АСПЕКТЫ АНТИАНГИОГЕННОЙ ТЕРАПИИ
ПРИ РАКЕ ЯИЧНИКОВ
Процессы неоангиогенеза критически важны для роста и распространения злокачественных опухолей. Антиангиогенная терапия прочно вошла в стандарты лечения диссеминированного рака яичников (РЯ). Результаты многочисленных исследований продемонстрировали ее эффективность на различных этапах терапии этого заболевания, наиболее изученным при РЯ антиангиогенным препаратом является бевацизумаб. В этой статье представлены обзор и анализ наиболее значимых исследований эффективности антиангиогенной терапии при РЯ, описаны различные аспекты ее применения при этом заболевании.
Ключевые слова: рак яичников, антиангиогенная терапия, бевацизумаб. А.А. RUMYANTSEV, I.A. POKATAEV, S.A. TYULYANDIN
Blokhin National Medical Research Cancer Centre, Federal State Budgetary Institution of the Ministry of Health of Russia, Moscow, Russia
MODERN ASPECTS OF ANTIANGIOGENIC THERAPY IN OVARIAN CANCER
The process of angiogenesis is essential for the growth and spread of malignant tumours. Antiangiogenic therapy is deeply embedded in the standard treatment of disseminated ovarian cancer (OC). The numerous studies have demonstrated its efficacy in various stages of the therapy of this disease; bevacizumab is the best-investigated anti-angiogenic drug for OC. This article presents a review and analysis of the most significant studies of the efficacy of anti-angiogenic therapy in ovarian cancer, and describes various aspects of its use in this disease. Keywords: ovarian cancer, antiangiogenic therapy, bevacizumab.
На долю рака яичников (РЯ) приходится около 4% в структуре заболеваемости злокачественными новообразованиями в России, однако эта патология уверенно занимает первое место среди причин смертности от онкогинекологических заболеваний [1]. В значительной степени высокая смертность от РЯ объясняется поздней диагностикой — в 70% случаев заболевание выявляется на поздних стадиях [2], а также хроническим рецидивирующим течением. Несмотря на высокую чувствительность к химиотерапии, у большинства пациенток отмечаются рецидивы заболевания, которые требуют повторного проведения химиотерапии.
В течение многих лет основой лечения РЯ являются хирургическое лечение и цитотоксическая химиотерапия. При этом в настоящее время в клиническую практику активно внедряются современные таргетные препараты. Их механизм действия реализуется за счет избирательного воздействия на определенные мишени в опухолевых клетках, что и дало название данному виду лечения. Антиангиогенная терапия является одной из наиболее изученных разновидностей таргетной терапии при РЯ, которая прочно вошла в стандарты лечения этого заболевания [3].
Образование новых кровеносных сосудов является обязательным условием для опухолевого роста и мета-стазирования, при этом процессы неоангиогенеза начинаются на самых ранних этапах опухолевой прогрессии. Опухоль может достигнуть размеров не более 1-2 мм3
до того момента, как возрастающая потребность в кислороде и питательных веществах начнет препятствовать ее дальнейшему росту. Для увеличения размеров опухоли ее клетки вынуждены активно вырабатывать различные проангиогенные вещества, которые запускают процессы неоангиогенеза и способствуют васкуляризации опухоли [4].
Важную роль в этих процессах играет фактор роста эндотелия сосудов (Vascular Endothelial Growth Factor, VEGF), взаимодействие VEGF и его рецепторов (VEGFR) вызывает активацию клеток эндотелия, их пролиферацию и миграцию. Именно сигнальный путь VEGF/VEGFR наиболее изучен при РЯ, хотя известна роль и других про-ангиогенных факторов [4, 5]. Данная статья посвящена обзору современных аспектов применения антиангио-генных препаратов при диссеминированном РЯ.
ПЕРВАЯ ЛИНИЯ ТЕРАПИИ РАКА ЯИЧНИКОВ
Общепринятый стандарт первой линии терапии РЯ -применение паклитаксела и платиновых агентов, цисплати-на или карбоплатина [6, 7]. РЯ высокочувствителен к первоначальному лечению, но у большинства пациенток отмечаются рецидивы заболевания. С учетом того, что добавление к стандартной терапии дополнительных цитотоксических препаратов не позволяет улучшить результаты лечения пациенток [8], антиангиогенные препараты активно изучались в первой линии терапии РЯ с целью снижения риска рецидива заболевания и смертности пациенток.
Наиболее изученным антиангиогенным препаратом, применяемым при РЯ, является бевацизумаб — монокло-нальное антитело к фактору роста эндотелия (VEGF-A). Действие бевацизумаба реализуется за счет блокирования активации сигнального пути VEGF его лигандом, что нарушает процессы васкуляризации опухоли. Эффективность бевацизумаба в первой линии терапии РЯ была продемонстрирована в нескольких клинических исследованиях.
В двойном слепом исследовании III фазы GOG-218 (n = 1873) была показана эффективность добавления бевацизумаба в дозе 15 мг/кг к стандартной химиотерапии паклитакселом и карбоплатином [9]. Включались пациентки с III стадией РЯ с наличием макроскопической остаточной опухоли или с IV стадией заболевания. Рандомизация пациенток осуществлялась в три группы:
1) химиотерапия + плацебо в период лечения и в качестве поддерживающей терапии;
2) химиотерапия + бевацизумаб 15 мг/кг в период лечения + плацебо в качестве поддерживающей терапии;
3) химиотерапия + бевацизумаб 15 мг/кг в период лечения + бевацизумаб в качестве поддерживающей терапии.
Бевацизумаб/плацебо применялись в течение 15 мес. Медиана выживаемости без прогрессирования (ВБП) среди пациенток, получавших бевацизумаб в периоды лечения и поддерживающей терапии, составила 14,1 мес. по сравнению с 10,3 мес. в группе плацебо (отношение рисков (ОР) 0,71; p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
нение получило применение бевацизумаба. Его эффективность была доказана как при платиночувствительных, так и при платинорезистентных рецидивах РЯ 17.
Рандомизированное плацебо-контролируемое исследование III фазы OCEANS (n = 484) было посвящено изучению эффективности добавления бевацизумаба к химиотерапии гемцитабином/карбоплатином при платиночувствительных рецидивах РЯ (интервал после последнего введения платинового агента £6 мес.) во второй линии терапии заболевания. Пациентки рандомизировались в соотношении 1:1 в группу химиотерапии гемцитабином 1000 мг/м2 день 1,8 + карбоплатин AUC4 день 1 (курсы каждые 3 нед.) в сочетании с бевацизумабом 15 мг/кг или в группу только химиотерапии по указанной схеме [18].
Медиана ВБП составила 12,4 мес. в группе бевацизумаба по сравнению с 8,4 мес. в группе химиотерапии (ОР 0,48; p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
TRIAS [24]* 172 Топотекан ± сорафениб 6,7 vs 4,4 мес. (p = 0,018)
Richardson et aL 2017 [26]* 106 Паклитаксел ± пазопаниб 7,5 vs 6,2 мес. (p = 0,20)
MITO-11 [25] 74 Паклитаксел ± пазопаниб 6,4 vs 3,5 мес. (p = 0,002)
AEROC [27] 35 Этопозид + апатиниб 8,1 мес.
«рандомизированные плацебо-контролируемые исследования
учался только в режиме дозирования 15 мг/кг 1 раз в 21 день или 10 мг/кг 1 раз в 14 дней.
■ Пациентки, ранее получавшие бевацизумаб, могут получить преимущество от повторного применения данного агента.
БЕВАЦИЗУМАБ В РОССИЙСКОЙ ОНКОЛОГИЧЕСКОЙ ПРАКТИКЕ
Как было отмечено выше, применение бевацизумаба входит в современные стандарты лечения диссеминиро-ванного РЯ. Несмотря на его высокую эффективность при данном заболевании, по причине высокой стоимости бевацизумаб в течение длительного времени оставался малодоступным для российских пациентов. Стоимость 400 мг оригинального препарата (Авастин, Roche/ Genentech) в 2012 г. составляла 61 500 руб. (=2000 долл. на момент регистрации цены) [28]. Ситуация в корне изменилась с момента выхода препарата из-под патентной защиты и появления биоаналогов препарата — в ноябре 2015 г. был зарегистрирован первый российский биоаналог бевацизумаба Авегра® БИОКАД. Вследствие выхода биоаналога цена снизилась на терапию в 4 раза.
Авегра® БИОКАД — рекомбинантное гуманизированное моноклональное антитело, которое селективно связывается с биологически активным фактором роста эндотелия сосудов (VEGF) и нейтрализует его. Как и оригинальный препарат, Авегра® БИОКАД ингибирует связывание фактора роста эндотелия сосудов с его рецепторами на поверхности эндотелиальных клеток, что приводит к снижению васкуляризации и угнетению роста опухоли.
Современные антиангиогенные препараты позволяют значительно расширить возможности лечения диссемини-рованного РЯ на различных этапах терапии данного заболевания. Появление доступного биоаналога бевацизумаба будет способствовать расширению его применения и улучшению отдаленных результатов лечения пациенток. ф
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов в ходе написания данной статьи.
3. Folkman J. Tumor angiogenesis: therapeutic implications. The New England Journal of Medicine, 1971 Nov 18, 285(21): 1182-1186.
4. Carmeliet P, Jain RK. Angiogenesis in cancer and other diseases. Nature, 2000 Sept, 407(6801): 249-257.
5. Avril S, Dincer Y, Malinowsky K, Wolff C, Gundisch S, Hapfelmeier A et al. Increased PDGFR-beta and VEGFR-2 protein levels are associated with resistance to platinum-based chemotherapy and adverse outcome of ovarian cancer patients. Oncotarget, 2017 Jun 8, 8(58): 97851-97861.
6. NCCN Clinical Practice Guidelines. Ovarian cancer. Version 1, 2018.
7. Тюляндин СА., Коломиец Л.А., Морхов К.Ю., Нечушкина В.М., Покатаев И.А., Тюляндина А.С. и соавт. Практические рекомендации по лекарственному лечению рака яичников, первичного рака брюшины и рака маточных труб. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2017, 7: 135-145. /Tyulyandin SA, Kolomiets LA, Morkhov KYu, Nechushkina VM, Pokatayev IA, Tyulyandina AS, et al. Practical guidelines for the drug treatment of ovarian cancer, primary peritoneal cancer and tubal cancer. Zlokachestvennye Opukholi: Prakticheskie Rekomendacii RUSSCO # 3s2, 2017, 7: 135-145.
8. Bookman MA, Brady MF, McGuire WP, Harper PG, Alberts DS, Friedlander M et al. Evaluation of New Platinum-Based Treatment Regimens in Advanced-Stage Ovarian Cancer: A Phase III Trial of the Gynecologic Cancer InterGroup. J Clin Oncol, March 20, 2009, 27(9): 1419-1425.
9. Burger RA, Brady MF, Bookman MA, Fleming GF, Monk BJ, Huang H et al. Incorporation of Bevacizumab in the Primary Treatment of Ovarian Cancer. N Engl J Med, 2011 Dec 29, 365(26): 2473-2483.
10. Oza AM, Selle F, Davidenko I, Korach J, Mendiola C, Pautier P et al. Efficacy and Safety of Bevaci-zumab-Containing Therapy in Newly Diagnosed Ovarian Cancer: ROSiA Single-Arm Phase 3B Study Int J Gynecol Cancer, 2017 Jan, 27(1): 50-58.
11. Perren TJ, Swart AM, Pfisterer J, Ledermann JA, Pujade-Lauraine E, Kristensen G et al. A Phase 3 Trial of Bevacizumab in Ovarian Cancer. N Engl J Med, 2011 Dec 29, 365(26): 2484-2496.
12. Du Bois A, Floquet A, Kim J-W, Rau J, del Campo JM, Friedlander M et al. Incorporation of Pazopanib in Maintenance Therapy of Ovarian Cancer. J Clin Oncol, 2014 Oct 20, 32(30): 3374-3382.
13. Kim J-W, Mahner S, Wu L-Y, Shoji T, Kim B-G, Zhu J-0 et al. Pazopanib Maintenance Therapy in East Asian Women With Advanced Epithelial Ovarian Cancer: Results From AGO-OVAR16 and an East Asian Study. Int J Gynecol Cancer. 2018 Jan, 28(1): 2-10.
14. Hainsworth JD, Thompson DS, Bismayer JA, Gian VG, Merritt WM, Whorf RC et al. Paclitaxel/ carboplatin with or without sorafenib in the first-line treatment of patients with stage III/IV epithelial ovarian cancer: a randomized phase
II study of the Sarah Cannon Research Institute. Cancer Med, 2015 May, 4(5): 673-681.
15. Du Bois A, Kristensen G, Ray-Coquard I, Reuss A, Pignata S, Colombo N et al. Standard firstline chemotherapy with or without nintedanib for advanced ovarian cancer (AGO-OVAR 12): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet Oncol, 2016 Jan, 17(1): 78-89.
16. Kommoss S, Winterhoff B, Oberg AL, Konecny GE, Wang C, Riska SM et al. Bevacizumab May Differentially Improve Ovarian Cancer Outcome in Patients with Proliferative and Mesenchymal Molecular Subtypes. Clin Cancer Res, 2017 Jul 15, 23(14): 3794-3801.
17. Pujade-Lauraine E, Hilpert F, Weber B, Reuss A, Poveda A, Kristensen G et al. Bevacizumab Combined With Chemotherapy for Platinum-Resistant Recurrent Ovarian Cancer: The AURELIA Open-Label Randomized Phase III Trial. J Clin Oncol, 2014 May, 32(13): 1302-1308.
18. Aghajanian C, Blank SV, Goff BA, Judson PL, Teneriello MG, Husain A et al. OCEANS: A Randomized, Double-Blind, Placebo-Controlled Phase III Trial of Chemotherapy With or Without Bevacizumab in Patients With Platinum-Sensitive Recurrent Epithelial Ovarian, Primary Peritoneal, or Fallopian Tube Cancer. J Clin Oncol, 2012 Jun 10, 30(17): 2039-2045.
19. Aghajanian C, Goff B, Nycum LR, Wang YV, Husain A, Blank SV. Final overall survival and safety analysis of OCEANS, a phase 3 trial of chemotherapy with or without bevacizumab in patients with platinum-sensitive recurrent ovarian cancer. Gynecol Oncol, 2015 Oct, 139(1): 10-16.
20. Coleman RL, Brady MF, Herzog TJ, Sabbatini P Armstrong DK, Walker JL et al. Bevacizumab and paclitaxel-carboplatin chemotherapy and secondary cytoreduction in recurrent, platinum-sensitive ovarian cancer (NRG Oncology/ Gynecologic Oncology Group study GOG-O213): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol, 2017 Jun, 18(6): 779-791.
21. Bamias A, Gibbs E, Khoon Lee C, Davies L, Dimopoulos M, Zagouri F et al. Bevacizumab with or after chemotherapy for platinum-resistant recurrent ovarian cancer: exploratory analyses of the AURELIA trial. Ann Oncol, 2017 Aug 1, 28(8): 1842-1848.
22. Oza AM, Cook AD, Pfisterer J, Embleton A, Ledermann JA, Pujade-Lauraine E et al. Standard chemotherapy with or without bevacizumab for women with newly diagnosed ovarian cancer (ICON7): overall survival results of a phase 3 randomised trial. Lancet Oncol, 2015 Aug, 16(8): 928-936.
23. Pignata S, Lorusso D, Gallo C. Chemotherapy plus or minus bevacizumab for platinum-sensitive ovarian cancer patients recurring after a bevacizumab containing first line treatment: The randomized phase 3 trial MITO16B-MaNGO OV2B-ENGOT OV17. J Clin Oncol, 2018, 36(suppl; abstr 5506).
24. Chekerov R, Hilpert F, Mahner S, El-Balat A, Harter P, De Gregorio N et al. Sorafenib plus topotecan versus placebo plus topotecan for platinum-resistant ovarian cancer (TRIAS): a multicentre, randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Oncol, 2018 Sep, 19(9): 1247-1258.
Pignata S, Lorusso D, Scambia G, Sambataro D, Tamberi S, Cinieri S et al. Pazopanib plus weekly paclitaxel versus weekly paclitaxel alone for platinum-resistant or platinum-refractory advanced ovarian cancer (MITO 11): a randomised, open-label, phase 2 trial. Lancet Oncol, 2015 May, 16(5): 561-568. Richardson DL, Sill MW, Coleman RL, Sood AK, Pearl ML, Kehoe SM et al. Paclitaxel With and Without Pazopanib for Persistent or Recurrent Ovarian Cancer: A Randomized Clinical Trial. JAMA Oncol, 2018 Feb 1, 4(2): 196. Lan C-Y, Wang Y, Xiong Y, Li J-D, Shen J-X, Li Y-F et al. Apatinib combined with oral etoposide in patients with platinum-resistant or platinum-refractory ovarian cancer (AEROC): a phase 2, single-arm, prospective study. Lancet Oncol. 2018 Sep, 19(9): 1239-1246.
28. Государственный реестр лекарственных средств. Государственный реестр предельных отпускных цен. Бевацизумаб (09.11.2012 (274/20-12). Последний доступ: 13.10.2018. / State register of medicinal products. State register of maximum selling prices. Bevacizumab (09/11/2012 (274 / 20-12). Last Access: 10/13/2018.
СВЕДЕНИЯ ОБ АВТОРАХ:
