Вторжение лимфатических сосудов (LVI) является многообещающим при определении прогнозов и стратегий лечения, но применение LVI в качестве гистопатологического критерия у пациентов с раком молочной железы, особенно у разных подгрупп, вызывает противоречивость. Это исследование направлено на оценку прогностической ценности LVI, оцененной D2-40 не только у пациентов с ранним инвазивным раком молочной железы, но также у пациентов с отрицательным лимфоузлом, лимфоузлом, просветом A-like, просветом B-like, HER2-обогащенным , и тройные отрицательные подгруппы.
Исследовательская когорта включала 255 пациентов с медианным наблюдением в течение 101 месяца. Иммуногистохимическое окрашивание для D2-40 проводили для идентификации LVI.
LVI присутствовал в 64 (25,1%), 15 (12,1%), 49 (37,4%), 19 (20,9%), 23 (27,7%), 13 (31,7%) и 9 (22,5%), соответственно, в целая когорта, лимфоузел-отрицательный, лимфоузел-положительный, просвет A-like, просвечивающий B-подобный, HER2-обогащенный и тройной-отрицательный пациенты. LVI ассоциировался с большим размером опухоли (P = 0,04), высоким гистологическим классом (P = 0,004), участвовал лимфатический узел (P 268 000 женщин были диагностированы с раком молочной железы и около 70 000 случаев умерли от него в 2015 году, что составляет 15% всех новых случаев рака у женщин и 7% всех случаев смерти женщин из-за рака. [1] Однако из-за обнаружения и системной адъювантной терапии показатель выживаемости улучшился за последнее десятилетие.
Поскольку прогностическая ценность LVI при раке молочной железы впервые была зарегистрирована в 1964 году [5], многочисленные исследования подтвердили важность LVI как прогностического фактора, но применение LVI в качестве гистопатологического критерия оставалось спорным 9. Согласно статус экспрессии ER, PR, HER2 и Ki-67, рак молочной железы можно классифицировать как 4 молекулярных подтипа: просвет A-like, просвет B-like, HER2-обогащенный и тройной-отрицательный. [12] В обзоре предыдущих исследований мы обнаружили, что в этих исследованиях часто изучалась комбинация отрицательных и положительных раковых опухолей лимфатических узлов и пациентов всех подтипов (просвечивание A-like, просвечивание B-like, HER2-обогащенный и тройной-отрицательный). Несомненно, эти пациенты были гетерогенными как по поведению, так и по терапии. Следовательно, прогностические значения LVI в этих подгруппах пока еще не определены. Кроме того, наличие или отсутствие поражения подмышечных лимфатических узлов, которое определяется как положительный отрицательный результат лимфатического узла или лимфатического узла, связано со значительно отличающимся прогнозом рака молочной железы. Отрицательный рак молочной железы с лимфатическим узлом имеет относительно хороший прогноз (10-20% смертности), а улучшение выживаемости с адъювантной химиотерапией у этих пациентов меньше, чем в случае лимфатических узлов. Поэтому надежные прогностические маркеры важны при принятии решения о необходимости использования адъювантной системной терапии или нет. Для сравнения, мы оценивали LVI не только во всей когорте, но и в каждой подгруппе: лимфоузел-отрицательный, лимфоузел-положительный, люминальный A-подобный, просвечивающий B-подобный, HER2-обогащенный и тройной-отрицательный пациенты. Кроме того, в большинстве прежних исследований использовалось окрашивание гематоксилином и эозином (H & E), при котором нельзя было различить инвазию кровеносных сосудов. D2-40 представляет собой новое моноклональное антитело, которое реагирует с фиксирующим резистентным эпитопом, который является гликозилированным или негликозилированным эпитопом gp36, на лимфатическом эндотелии, но не реагирует с эндотелием капилляров, артерий и вен в нормальных и неопластических тканей на фиксированных формалином парафиновых тканях [13]. Его полезность для выявления внутриутробных лимфатических сосудов была зарегистрирована в различных карциномах, в том числе в грудной клетке 13. Чувствительность и специфичность использования D2-40 как метода выявления лимфатической инвазии при раке молочной железы, а также других типов рака составляют 97,3% и 98,8% соответственно. [17] С тех пор в нескольких исследованиях было установлено, что использование D2-40 для выявления LVI было очень ответственным подходом к прогнозированию результатов у пациентов с раком молочной железы [2,18-20]
В этом исследовании мы изучаем прогностическую ценность LVI с использованием окраски D2-40 у китайских пациентов с ранним и, в частности, лимфоузлом, лимфоузлом, просветом A-like, просветом B-like, HER2-обогащенным и тройной отрицательный инвазивный рак молочной железы.
Первичные опухоли у пациентов, перенесших хирургическое вмешательство в период с 2005 по 2008 год в больнице Шаньдунского рака, связанных с университетом Шаньдун, были фиксированными формалинами и парафинами для этого исследования (n = 255). Чтобы ограничить потенциальные смешающие эффекты других типов опухолей при анализе, в настоящее исследование были включены только инвазивные протоковые карциномы груди. Пациенты, которые не получали никакого хирургического лечения, диагностировали инвазивные протоковые карциномы in situ или метастазы и не имели достаточных данных для последующего наблюдения, слабины патологии и блоки тканей, были исключены. Возраст, размер опухоли, статус лимфатических узлов, гистологический тип и класс были получены из обычных отчетов. Средний возраст пациентов в момент постановки диагноза составлял 48 лет (диапазон — 26-72 года). Пациенты получали радиацию, гормоны или химиотерапию в соответствии с их патологическими отчетами. Безрецидивная выживаемость (DFS) определялась как период с даты первичной хирургии до даты первого рецидива рака молочной железы. Письменное информированное согласие было получено от каждого пациента, и протокол был одобрен комитетом по этике больницы провинции Шаньдун, связанным с университетом Шаньдун.
Один представительный блок из каждого из 255 экземпляров окрашивали D2-40 (Принстон, Нью-Джерси, Кованс, Моноклональное антитело, SIG-3730), разбавленным 1: 100. Тканевые секции (толщиной 4 мкм) депарафинизировали в ксилоле и регидратировали в последовательности нисходящих концентраций этанола. Блокировать эндогенную активность пероксидазы водорода в 3% H2O2 в течение 15 минут и блокировать неспецифическое связывание путем инкубации в 10% лошадиной сыворотке в течение 30 минут. Затем секции инкубировали с первичным антителом при комнатной температуре в течение часа. Определить сайты связывания с 3, 30 диаминобензидином (Вектор, код SK 4001, Burlingame, CA) в качестве хромогенного субстрата по методике Envision (Dako, код K5007) в соответствии с инструкцией производителя. После контрастного окрашивания гематоксилином секции обезвоживали и монтировали с помощью DPX.
Статус ER и PR определялся с предельным значением 1% положительных опухолевых клеток [21]. HER2-положительный был определен как забитый 3+ иммуногистохимией (IHC); для забитых 2+, FISH выполнялось для определения положительности HER2; и 0 и 1+ считаются отрицательными. [22] Ki-67 часто измеряется как как статический маркер пролиферативной активности, так и в качестве возможного динамического промежуточного или суррогатного маркера эффективности лечения [23]. Ki-67-позитивные опухолевые клетки идентифицировали по методу, описанному Bukholm et al. [24] Короче говоря, всего 10 полей ячеек клеток Ki-67, окрашенных клетками, были случайным образом выбраны, и 500 клеток подсчитывались под каждым полем. Затем мы вычислили процентные доли положительных клеток Ki-67. Ki-67 ≤14% определяли как низкую экспрессию и Ki-67> 14% в качестве высокой экспрессии. [25,26] LVI идентифицировали опухолевыми клетками внутри D2-40 положительно окрашенных сосудов [18]. Случаи были классифицированы как LVI-позитивные или LVI-отрицательные. Типичные гистологические картины LVI-положительного и LVI-отрицательного окрашивания D2-40 показаны на рисунках 1A и B соответственно. Молекулярные подтипы рака молочной железы были классифицированы следующим образом: просвет A-like (ER и PR-положительный и HER2-отрицательный и низкий Ki-67), просвечивающий B-подобный (ER и / или PR-положительный и по меньшей мере один из следующих: HER2 отрицательный и высокий Ki-67, HER2 положительный), HER2-обогащенный (ER и PR отрицательный, HER2-положительный) и тройной-отрицательный (ER, PR и HER2 отрицательный)). [12] Интерпретация результатов IHC была сделана 2 исследователями без знания клинических характеристик и состояния других прогностических переменных.
(A) LVI-положительный путем окрашивания D2-40. Положительное окрашивание лимфатического эндотелия с D2-40 показывает наличие опухолевых эмболов в просвете лимфатических сосудов (красная стрелка). Эндотелия соседних кровеносных сосудов отрицательна для D2-40 (черная стрелка) (× 100). (B) LVI-отрицательный путем окрашивания D2-40. В просвете лимфатических сосудов положительно окрашивается D2-40 (красная стрелка). Эндотелия соседних кровеносных сосудов отрицательна для D2-40 (черная стрелка) (× 100). LVI = инвазия лимфатического сосуда.
Кроме 6 признаков, входящих в систему AJCC, существуют и другие предикторы исхода:
— гистологический подтип. 30-летняя выживаемость женщин со специфическим типом карциномы молочной железы (тубулярной, муцинозной, медуллярной, дольковой и папиллярной) составляет > 60%, а женщин с инвазивной протоковой карциномой — 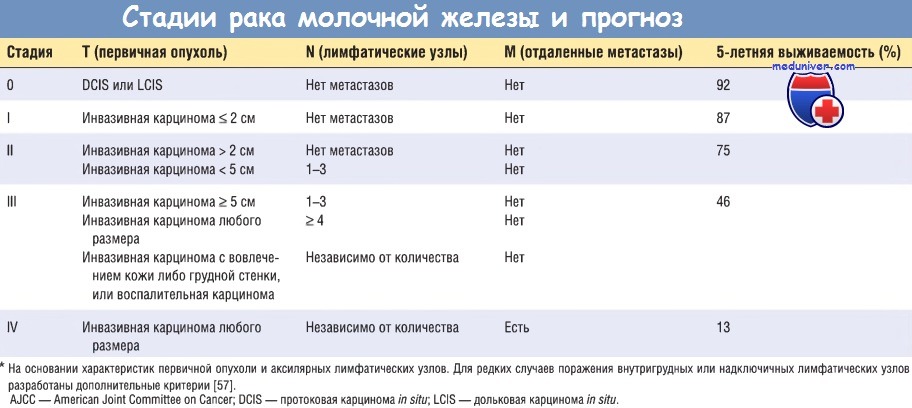
— лимфоваскулярная инвазия. В 50% инвазивных карцином выявляют опухолевые клетки в лимфатических пространствах (мелких сосудах и капиллярах), что коррелирует с метастазами в лимфатических узлах. Лимфоваскулярная инвазия — неблагоприятный прогностический фактор при оценке общей выживаемости женщин без метастазов в лимфатических узлах. Как уже было отмечено, выраженное поражение лимфоваскулярных пространств опухолевыми клетками (воспалительная карцинома) свидетельствует об очень неблагоприятном прогнозе;
— пролиферативная активность. Пролиферативную активность можно измерить, подсчитав количество митозов (например, при определении степени дифференцировки), иммуногистохимически выявив белки, продуцируемые во время клеточного цикла (например, циклины, Ki-67), определив S-фазу с помощью проточной цитометрии или выявив тимидин с помощью радиоактивной метки. Опухоли с высокой пролиферативной активностью имеют худший прогноз, но могут лучше отвечать на химиотерапию;
— состояние ДНК. Количество ДНК в опухолевых клетках можно измерить с помощью проточной цитометрии или анализа срезов ткани. Опухоли с индексом ДНК, равным 1, имеют то же количество ДНК, как и нормальные диплоидные клетки, однако могут содержать выраженные изменения хромосом. Анеуплоидные опухоли характеризуются несколько худшим прогнозом;
— ответ на неоадъювантную терапию. В большинстве случаев выполняют хирургическое вмешательство с последующим системным лечением (адъювантной терапией). Неоадъювантная терапия — альтернативный вариант, когда пациентки получают лечение до операции. Такой подход не улучшает выживаемость, но реакция злокачественной опухоли на лечение является важным прогностическим фактором.
Для контроля изменений во время лечения используют клинические и рентгенологические методы, однако часто объем остаточной опухоли недооценивают или переоценивают. Опухоли, хорошо реагирующие на терапию, обычно низкодифференцированные, ER-негативные и содержат очаги некроза. У пациенток, у которых удалось достичь полного морфологического регресса опухоли (т.е. отсутствует остаточная опухоль в молочной железе и лимфатических узлах) отдаленная выживаемость составляет более 95%, если сравнивать с низкодифференцированными опухолями в целом.
Патоморфологический регресс можно использовать в клинических исследованиях в качестве конечной точки (что может способствовать получению полезной информации при меньшем количестве больных и за меньший период времени) и в молекулярных исследованиях чувствительности или резистентности опухоли к лечению;
— профиль экспрессии генов. Определение экспрессируемых генов используют для прогнозирования общей выживаемости и интервала без рецидива. Определение профиля экспрессии генов позволяет выявить пациенток, у которых эффективность определенного варианта химиотерапии будет наибольшей. Методы исследований замороженных тканей сложно воспроизводимы в клинической практике, но начинают применять альтернативные подходы, использующие парафиновые блоки.
Хотя иммунофенотип содержит большой объем информации, он плохо коррелирует с размером злокачественной опухоли или статусом лимфатических узлов — двумя важнейшими прогностическими факторами.
Местный и регионарный контроль патологического процесса основан на хирургическом методе (мастэктомии или органосохраняющих операциях), в то время как системный контроль заболевания — на гормональной терапии и/или химиотерапии. Для определения прогноза удаляют подмышечные лимфатические узлы или сторожевой лимфатический узел, однако сами по себе метастазы в подмышечных лимфатических узлах можно лечить исключительно лучевым методом. Новые методы терапии включают ингибиторы мембранных факторов роста (например, HER2/Neu), стромальных протеаз и ангиогенеза.
Методы лечения основаны на модели распространения рака молочной железы, которая менялась вместе с изменениями наших представлений о биологии заболевания. Раньше считали, что рак молочной железы распространяется непосредственно из железы в лимфатические узлы (первая модель), поэтому его можно вылечить блоковой резекцией. Однако выполнение радикальной резекции (мастэктомии с резекцией пекторальной мышцы, внутригрудных узлов и надключичных лимфатических узлов) не снизило смертность.
Исследования показали, что органосохраняющие операции и облучение по эффективности идентичны радикальной мастэктомии, поскольку на момент диагностики все опухоли уже имеют отдаленные метастазы (вторая модель). Таким образом, применение методов местного или системного лечения не влияет на выживаемость. В нынешнюю эпоху ранней диагностики злокачественной опухоли с помощью маммографии формируется третья модель, которая совмещает первые две и считается более подходящей для разработки лечения.
В последние годы взгляд на объем хирургического вмешательства при первичных операбельных опухолях изменился. Радикальная мастэктомия была стандартной процедурой, с тех пор как Холстед опубликовал первую серию своих работ в 1894 г. Его концепция удаления единым блоком первичной опухоли вместе с подмышечными лимфоузлами была признана во всем мире. Этот метод лечения преобладал в течение приблизительно 50 лет, несмотря па недостаточно высокие показатели эффективности.
В дальнейшем неудовлетворенность стандартной радикальной мастэктомией усиливалась, и в последние два десятилетия возросла тенденция к менее радикальным хирургическим вмешательствам.
В 1992 г. American Colleges of Surgeons, Radiologists and Pathologist вместе с ACS и Society of Surgical Oncology начали изучать методики органосохраняющего лечения рака молочной железы (РМЖ). Многие ретроспективные, а также проспективные рандомизированные исследования подтвердили одинаковую эффективность результатов лечения больных с ранним РМЖ с помощью мастэктомии или органосохраняющей операции.
Результаты обсуждений были опубликованы в 1998 г. В 6 современных проспективных рандомизированных исследованиях мастэктомия сравнивалась с органосохраняющим хирургическим вмешательством в комбинации с лучевой терапией (ЛТ) при раке молочной железы (РМЖ) I и II стадий. ЛТ молочной железы (45—50 Гр) применялась во всех 6 исследованиях с бустом на ложе первичной опухоли в 5 из них.
Обязательным условием для органосохраняющей операции и лучевой терапии (ЛТ) было отсутствие опухолевых клеток в краях резекции. На протяжении более 18 лет ни в одном из исследований не обнаружены значимые различия между общей и безрецидивной выживаемостью при двух типах лечения. В исследованиях Milan I и NSABP В-06 у больных с наличием метастазов в лимфоузлах после мастэктомии и XT выживаемость не улучшалась.
В 5 из 6 исследований не было значительных различий в частоте рецидивов в оперированной молочной железе или грудной стенке после мастэктомии. В исследовании NCI отмечен значительно более высокий уровень местного рецидивирования при органосохраняющей лечении, но для включения в исследование требовалась резекция видимой опухоли.
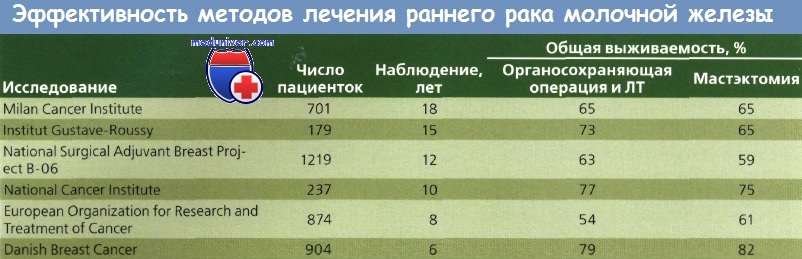
При метаанализе 7 из 9 проспективных рандомизированных исследований, сравнивавших органосохраняющее хирургическое вмешательство и ЛТ с мастэктомией, различий в выживаемости выявлено не было. Местное рецидивирование отмечено у 6,2 % больных после мастэктомии и у 5,9 % — после органосохраняющей операции. Различия в частоте рецидивов в противоположной молочной железе или вторичных злокачественных опухолей в оперированной железе не обнаружены.
Частота рецидивов в оперированной молочной железе после лечения колебалось от 3 до 19 %. В большинстве случаев при неэффективности органосохраняющего лечения может применяться мастэктомия, при этом 5-летняя выживаемость составляет 70 %. Мастэктомия не предотвращает местных рецидивов, частота которых может составлять 4 — 14 %.
Было проведено 6 рандомизированных исследований, сравнивавших органосохраняющее хирургическое вмешательство и такое же вмешательство в сочетании с ЛТ. Выбор терапии, объем хирургического вмешательства и ЛТ, использование адъювантной системной терапии в разных исследованиях варьировали. Несмотря на различия, общий коэффициент уменьшения частоты рецидивирования в молочной железе составил 84 % (диапазон 73—97 %) после лучевой терапии (ЛТ). Не удалось провести анализ подгруппы больных без эффекта от ЛТ.
Для оптимальной органосохраняющей операции на молочной железе необходим тщательный отбор больных, осуществляемый бригадой специалистов разного профиля. Выбор метода лечения должен основываться на данных анамнеза, физикального исследования, маммографии, гистологической оценке биоптата молочной железы и пожеланиях пациентки. Возраст (ни молодой, ни пожилой) не может быть противопоказанием к сохранению молочной железы. Втяжение кожи, соска или молочной железы может и не быть признаком локального прогрессирующего РМЖ и необязательно служит противопоказанием к сохранению молочной железы.
Для уточнения возможности проведения органосохраняющей операции необходимо предоперационное маммографическое исследование. Должно использоваться высококачественное, сертифицированное, специализированное маммографическое оборудование, определяющее объем поражения и возможное наличие нескольких очагов. Необходимо провести двустороннюю маммографию. При непальпируемых образованиях и микрокальцификатах органосохраняющие операции выполняются все чаще. Размер патологических очагов (по крайней мере, двух) должен быть указан.
Кожу молочной железы над опухолью нужно обследовать на предмет утолщения, по которому можно предположить поражение ее раком. Если есть микрокальци-фикаты, необходимо определить их протяженность в пределах или вне образования, описать их расположение и распределение, особенно если они — единственный признак опухоли.
Необходимо оценить различные патологические находки, которые могут быть факторами риска рецидива рака молочной железы (РМЖ). Инвазия в кровеносные или лимфатические сосуды, некроз опухоли и воспалительный инфильтрат повышают риск рецидивирования (10—15 % в течение 5 лет). У больных с метастазами в лимфоузлах нет повышенного риска рецидивирования РМЖ после органосохраняющей операции и ЛТ; однако у больных после мастэктомии число метастазов в лимфоузлах коррелирует с частотой рецидивирования опухоли в грудной стенке.
Более низкая частота рецидивирования при органосохраняющей операции и облучении может быть следствием комбинированного эффекта XT и тамоксифена. Крупный внутрипротоковый очаг может быть связан с высоким риском рецидивирования. Риск может быть увеличен при наличии значительной остаточной опухоли после удаления видимых очагов. Риск рецидивирования у этих больных уменьшается при отсутствии опухолевых клеток в краях резекции. По-видимому, крупный внутрипротоковый очаг служит показателем того, что заболевание более тяжелое, чем предполагалось до операции.
При наличии опухолевых клеток в краях резекции следует расширить объем операции. В случае повторного обнаружения опухолевых клеток наиболее целесообразно провести мастэктомию. Gage и соавт. показали различную частоту рецидивирования опухоли в течение 5 лет после резекции: 3 % при отсутствии опухолевых клеток в краях резекции, 9 % при наличии отдельных опухолевых клеток и 28 % при наличии опухолевых клеток по всей линии резекции.
Последние данные подтверждают, что системная терапия может уменьшить 5-летний уровень рецидивирования рака молочной железы (РМЖ) у пациенток с наличием опухолевых клеток в краях резекции. Состояние краев резекции — вероятно, самый важный аспект гистологической оценки операционного материала, если изначально планировалась орга-носохраняющая операция.
LCIS — это случайная находка (в противоположность DCIS); он считается маркером повышенного риска рака молочной железы (РМЖ) в будущем, но не служит показанием для расширения объема операции при наличии опухолевых клеток в краях резекции. Повышенный риск относится к обеим молочным железам и остается па протяжении жизни.

Очевидно, что есть как абсолютные, так и относительные противопоказания к органосохраняющим операциям и лучевой терапии (ЛТ). Беременность считается абсолютным противопоказанием к ЛТ. Альтернативой может быть послеродовая ЛТ, что зависит от срока беременности во время установления диагноза. Женщины с двумя или более первичными опухолями в разных квадрантах либо с диффузными характерными микрокальцификатами не рассматриваются как возможные кандидатки для органосохраняющего хирургического вмешательства. Наличие опухолевых клеток в краях резекции после расширения объема операции, а также предшествующая ЛТ молочной железы служат абсолютным противопоказанием к органосохраняющей операции.
Относительными противопоказаниями могут быть коллагенозы в анамнезе (склеродермия или системная красная волчанка), т. к. эти больные плохо переносят ЛТ. Ревматоидный артрит не считается противопоказанием. Размер опухоли не есть абсолютное противопоказание, хотя крупная опухоль в небольшой молочной железе, адекватная резекция которой может привести к косметическому дефекту, может быть относительным противопоказанием. Семейный РМЖ не влияет на выживаемость.
Тенденции проведения менее радикальных операций появились после введения метода удаления молочной железы и подмышечных лимфоузлов без грудных мышц. Было показано, что простая мастэктомия с последующей ЛТ приводит к таким же результатам выживаемости, как и радикальная мастэктомия. В настоящее время проходит много рандомизированных исследований, но ограничения этического и юридического характера затрудняют получение значительного количества данных. В большинстве исследований графики выживаемости сравнивались с исследованиями, основанными на радикальной мастэктомии по Холстеду.
Важно, что все менее травматичные процедуры приводят к подобным конечным результатам, но ни один не превзошел результаты, полученные при радикальной мастэктомии. Соответственно, многие сторонники радикальной мастэктомия по Холстеду будут продолжать применять этот метод до появления альтернативы, при которой 10-летняя выживаемость будет лучше.
В некоторых исследованиях продемонстрированы благоприятные результаты органосохраняющего лечения рака молочной железы (РМЖ), но не всем больным показан этот метод, заключающийся в минимальном хирургическом вмешательстве и послеоперационной ЛТ. Hellman описал 255 больных РМЖ I и II стадий, получающих такое лечение. У 97 % женщин с I стадией заболевания и 87 % — со II стадией проведена резекция опухоли. Частота выживаемости составила 93 % при I стадии и 84 % — при II.
После удаления опухоли проводили лучевую терапию (ЛТ) всей молочной железы (45—50 Гр), всего 23 сеанса в течение 5 нед., и дополнительное облучение области первичной опухоли (20—22 Гр) с использованием интерстициального 192Ir. Удаление опухоли рекомендуется при ее диаметре более 2 см. Послеоперационная ЛТ предположительно должна приводить к 80—85%-й частоте локального контроля со сравнимой выживаемостью.
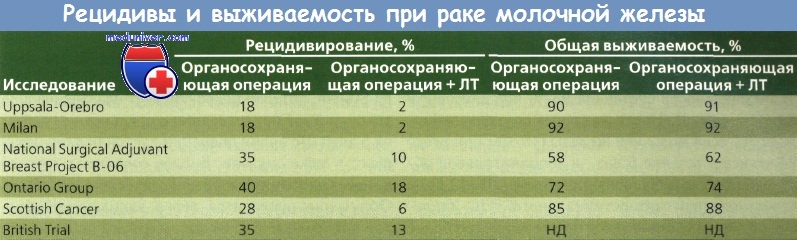
Montague описал 1073 пациентки с благоприятным результатом лечения рака молочной железы (РМЖ), получавших лечение в M.D. Anderson Hospital между 1955 и 1980 г. У 355 больных этой группы проведено органосохраняющее хирургическое вмешательство и ЛТ, а у 728 — только радикальная или модифицированная радикальная операция. Частота местного регионарного рецидивирования при органосохраняющей операции составила 4,9 %, после радикальной или модифицированной радикальной мастэктомии — 5,6 %. В целом значимых различий в уровне безрецидивной выживаемости в течение 10 лет в двух группах не обнаружено.
Хотя это исследование не было рандомизированным, его результаты согласуются с данными других исследований.
Lichter и соавт. из NCI сообщили о рандомизированном исследовании, проведенном в 1992 г., в котором мастэктомия сравнивалась с органосохраняющей операцией при РМЖ I и II стадий. 237 женщин были разделены на две группы: в одной проведена мастэктомия, в другой — эксцизионная биопсия опухоли и ЛТ. Всем женщинам в обеих группах выполнена полная подмышечная лимфодиссекция; больные с метастазами в лимфоузлах в обеих группах дополнительно получали циклофосфамид и доксорубицин каждые 28 дней в течение 1 года и тамоксифен 40 мг/сут в течение 5 лет.
Общая и безрецидивная выживаемость при двух видах лечения значительно не отличались. Авторы также суммировали результаты 6 крупных проспективных рандомизированных исследований с участием более 3800 пациенток, в которых сравнивали мастэктомию и лампэктомию в комбинации с ЛТ при лечении РМЖ I и II стадий. В результате этих исследований были сделаны такие же выводы в отношении безрецидивной выживаемости. Таким образом, врачи могут теперь смело рекомендовать лампэктомию в сочетании с ЛТ больным РМЖ I и II стадий, т. к. этот метод лечения оказался эквивалентным мастэктомии по выживаемости и оптимальному локальному и регионарному контролю.
В мае 2002 г. Управление по контролю за качеством пищевых продуктов и лекарственных средств США (FDA) одобрило MammoSite Radiation Therapy System, которая подразумевает назначение внутриполостной брахитерапии в предписанных дозах на 5 дней. Во время операции пустой баллон помещают в ложе опухоли. Баллон соединен с трубкой и может наполняться физиологическим раствором. Облучение проводится через наполненный баллон в течение 1—5 дней, затем баллон опорожняют и извлекают. Время ЛТ сократилось с традиционных 6 нед. до 5 дней. Эта технология находится в стадии разработки, и критерии включения больных для этого метода ЛТ пока изучаются.
Карцинома смешанного типа
Для того чтобы классифицировать опухоль как протоковую карциному необходимо иметь признаки, которые занимают более 50% от массы при тщательном исследовании ее репрезентативных участков. Если же протоковая составляющая карциномы неспецифического типа составляет 10-49% ,а остальная часть опухоли распознается как опухоль специфического типа – в таком случае опухоль должна быть отнесена к одной из смешанных групп опухоль смешанная протоковая и специфического типа или смешанная протоковая и лобулярная карцинома. Помимо перечисленных существуют другие новообразования которые нужно дифференцировать с вышеперечисленными.
Плеоморфная карцинома является редким вариантом высокодифференцированной протоковой карциномы, которая характеризуется пролиферацией плеоморфных и многоядерных гигантских клеток составляющих более 50 %всех опухолевых клеток, на фоне аденокарциномы или аденокарцинома с веретенообразованием, или сквамозной дифференцировки. Пациенты с данным типом опухоли варьируют от 28 до 96 летнего возраста. Средний возраст 51 год.
У большинства первый симптом-пальпируемое новообразование. В 12% случаев метастазирование опухоли является первым симптомом заболевания. Средний размер этих опухолей составляет 5,4 см. В опухолях большого размера возникают полости и некроз. В большинстве случаев гигантские клетки составляют более 75% всех клеток опухолевой массы. Митотические фигуры более 20 на 10 полей зрения при большом увеличении. Все эти опухоли классифицированы как 3 Grade. Интраэпителиальный компонент опухолей отображает протокковую организацию. Часто является высокогрейдной с частыми участками некрозов. Лимфоваскулярная инвазия присутствует в 19% случаев.
Чаще анализы на BCR-2,ER и PR оказываются отрицательными. 2\3 этих плеоморфных карцином являются положительными по TP53 маркерам. А 1\3 позитивна к S100 протеину. Все опухоли данного класса позитивны на SAM5,2;EMA и панцитокератин (AE1,AE3,CK1). Большинство (68%)этих клеток является анеуплоидными, а 47%триплоидными. Высокое значение S фазы обнаруживается в 63% случаев. Митостазы в подмышечные лимфатические узлы обнаруживаются у 50% пациентов, большинство из которых имеют вовлечение 3 и более узлов. Многие пациенты имеют признаки заболевания при далекозашедшем процессе.
Карцинома из гигантских остеокластов
Частым признаком этих карцином является наличие в строме гигантских остеокластов. Гигантские клетки обычно ассоциированы с воспалительной инфильтрированной фиброзной гиперваскуляризированной строме с экстравазированными эритроцитами , лимфоцитами , моноцитами, на ряду с одноядерными и двуядерными гистиоцитами некоторые из которых содержат гемосидерин.
Гигантские клетки варьируют в размере и выглядят так как-будто обнимают эпителиальный компонент или находятся внутри выстилки. Гигантские клетки содержат вариабельность ядер. Эти клетки, а также гиперваскулярная реактивная строма может наблюдаться в метастазах в лимфотических узлах. Наиболее часто канцероматозная часть новообразования представлена высоко или умереннодифференцированной высокоактивной протоковой карциномой. Однако при этом наблюдается и все другие гистологические типы, вчасности инвазивный прибрефорбный рак, а также тубулярная, муцинозная, сквамозная, папиллярная, лабилярная и другие метопластические участки. Приблизительно в 3 из зарегистрированных случаях имелись метастазы в лимфатические узлы.
Пятилетняя выживаемость составляет около 70 %заболевших, что соответствует или даже выше пятилетней выживаемости среди пациентов с обычными инфильтративными карциномами. Прогноз связан с характеристиками ассоциированных карцином, похоже на него не оказывает влияние наличие гигантских стромальных клеток.Гигантские клетки экспресируют CD68(это показано с помощью KPантител на парафиновой матрице). Данные клетки отрицательны по S100 протеину, актину, цитокератину, EMA, эстрогеновым и прогестероновым рецепторам.
Определение количества ультраструктур и иммуногистохимическое исследование подтверждает гистиоцитарную природу остеокластов присутствующих в этих карциномах. Недавние проводимые исследования in vitro показало, что могут происходить непосредственно из клеток предшественников моноцитов и макрофагов. Макрофаги способны к дифференцировке в мультинуклеарные клетки, которые могут воздействовать на резорбцию кости в метастаз.
Гигантская остеокластная карцинома, вероятно, связана с опухолями ассоциированными макрофагами. Ангиогенез и хемотаксические факторы, продуцируемые карциномой могут быть ответственные за миграцию гистиоцитов в область развития рака, а также за их окончательную трансформацию в гигантские остеокласты.
Карцинома с чертами хорионкарциномы
Пациенты с протоковой карциномой могут иметь увеличенный уровень сывороточного B-хорионического гонадотропина человека. А 60%пациентов с протоковой карциномой имеют B-хорионический гонадотропин человека положительные клетки. Однако гистологические доказательства хорионканцероматозной дифференцировки встречается исключительно редко; о них сообщалось лишь в некоторых докладах, все они встречаются у женщин 50-70 лет.
Карцинома с чертами меланомы
Несколько докладов клинических случаев описывали исключительно опухоли паренхимы молочной железы, при которой встречались комбинации протоковой карциномы и меланомы. В некоторых из этих случаев описан переход клеток одного типа в другой. Недавно проведенный генетический анализ одного из таких случаев указывал на утрату гетерозиготности на одних и тех же хромосомных фокусах всех компонентов опухоли, что предполагает их происхождение от одного неопластического клона.
Само по себе присутствие меланомы в клетках рака молочной железы не следует рассматривать как доказательство меланоцитарной дифференцировки, потому как меланиновая пигментация раковых клеток может возникнуть в тех случаях, когда рак молочной железы проник в кожу и вовлекает дермо-эпидермальную границу. В дополнение необходимо различать опухоль с меланоцитарной дифференцировкой и карциному молочной железы с выступающими скоплениями липофусцина.
Большинство меланинсодержащих опухолей молочной железы представляют собой метастаз злокачественной меланомы происходящей экстрамамарных участков.Первичные меланомы могут возникать в любом месте кожи груди, однако происхождение из сосков ареолярного комплекса встречается крайне редко. Дифференциальная диагностика злокачественной меланомы происходящей из сосков ареолярной области должна включать болезнь Педжета, при которой клетки опухоли в некоторых случаях могут содержать меланин.
