Статус регионарных лимфатических узлов является важнейшим фактором прогноза, достоверно влияющим как на общую, так и на безрецидивную выживаемость. 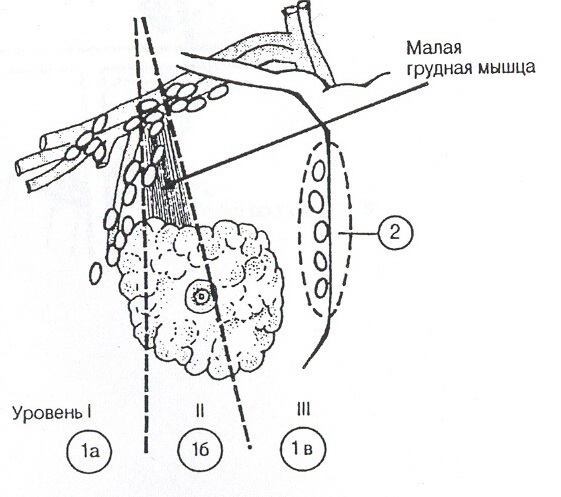
Регионарные лимфатические узлы
- В 20% случаев при неадекватной лимфодиссекции прогрессирование процесса связано с поражением этой зоны.
- Удаление зон регионарного лимфооттока – стандарт при хирургическом вмешательстве по поводу рака молочной железы.
- Поражение аксиллярных лимфатических узлов наблюдается:
- в 3-28% при диаметре опухоли ? 0,5см;
- в 15-25% при размере опухоли ? 1см.
- Факторами, влияющими на высокую вероятность поражения регионарных лимфатических узлов, являются:
- инвазия кровеносных и/или лимфатических сосудов;
- размер опухоли ? 15мм;
- степень злокачественности опухоли;
- пальпируемая опухоль.
- К факторам низкого риска локо-регионарного распространения относят:
- протоковый рак in situ;
- микроинвазивный рак;
- тубулярный или слизистый рак, размером 5см в диаметре; т.к. по мере увеличения первичного очага вероятность метастазирования в регионарные лимфоузлы возрастает:
DCIS – 7,3%
T1a, T1b 5см) – 75%Наиболее оптимально исследовать возможные изменения в регионарных лимфатических узлах с помощью иммуногистохимического исследования:
частота выявления микрометастазов возрастает на 5-10%.Таким образом:
биопсия сигнального лимфатического узла показана пациенткам ранним инвазивным и преинвазивным раком молочной железы;
в этих случаях она является как диагностической, так и лечебной процедурой;
при обнаружении позитивных при биопсии сентинальных лимфатических узлов необходимо выполнение стандартной лимфодиссекции I – III уровней
Опубликованы отдаленные результаты исследования 3 фазы IBCSG 23-01, из которых следует, что подмышечная лимфодиссекция у больных ранним раком молочной железы (РМЖ) при наличии микрометастазов в сторожевых лимфоузлах не увеличивает безрецидивную выживаемость (БВ).
В этом рандомизированном исследовании 3 фазы с дизайном non-inferiority приняли участие 27 центров в 9 странах. В него включали больных ранним РМЖ, максимальный размер опухоли которых составлял 5 см и менее. У пациенток были верифицированы микрометастазы в один или более сторожевых лимфоузлов, максимальный размер которых не превышал 2 мм и которые не нарушали целостность капсулы лимфоузлов. Пациенты были рандомизированы в группы 1:1, стратификацию проводили в зависимости от центра и менопаузального статуса. Первичной конечной точной была БВ.
В исследовании приняли участие 934 пациентки, которые были рандомизированы в группу подмышечной лимфодиссекции (N=465) или в группу наблюдения (N=469). Три пациентки вышли из протокола после рандомизации. БВ за 9,7 лет наблюдения составила 76,8% в группе, где не выполняли лимфодиссекцию, и 74,9% в группе лимфодиссекции (отношение рисков 0,85; p=0,0024 для non-inferiority). Отсроченные послеоперационные осложнения включали лимфедему любой степени тяжести у 16 (4%) из 453 пациенток в группе без лимфодиссекции и у 60 (13%) из 447 пациенток в группе лимфодиссекции. Сенсорная нейропатия любой степени встречалась у 57 (13%) против 85 (19%) пациенток соответственно. Моторная нейропатия любой степени встречалась у 14 (3%) и 40 (9%) пациенток соответственно.
В итоге результаты европейского исследования IBCSG 23-01 при медиане наблюдения 9,7 лет соответствуют данным, полученным в американском исследовании Z0011 после 10 лет наблюдения. Эти данные поддерживают общераспространенную практику, когда у больных ранним РМЖ при наличии микрометастазов в сторожевых лимфоузлах подмышечную лимфодиссекцию не проводят.
Анализируя новые данные, Henry M. Kuerer из MD Anderson Cancer Center (Хьюстон, США) отмечает, что хотя количество местных рецидивов было невелико, чаще они случались в группе, где лимфодиссекцию не проводили: 8 (2%) из 467 пациенток в группе без лимфодиссекции против 2 (
Американские ученые провели исследование, результаты которого указывают на возможность снижения риска развития рака молочной железы у пожилых женщин с избыточным весом или ожирением. Ощутимое снижение онкологической опасности наблюдается даже после уменьшения массы тела всего на 5%.
Согласно данным 3 фазы клинического исследования S-TRAC, сунитиниб после нефрэктомии на 24% увеличивает выживаемость без прогрессирования (ВБП) у больных почечно-клеточным раком (ПКР) высокого риска. В статье, недавно опубликованной в Annals of Oncology, исследователи оценили качество жизни пациентов.
Авторами проведен анализ результатов лечения больных раком молочной железы, которым выполнялось оперативное вмешательство в объеме секторальной или радикальной резекции. Установлено, что секторальная резекция может успешно применяться в лечении больных раком молочной железы, не влияя на результаты трех- и пятилетней выживаемости, способствуя более рациональному использованию коечного фонда.
Последние десятилетия ознаменовались широким внедрением в повседневную онкологическую практику органосохранного лечения рака молочной железы. Это в первую очередь связано с уменьшением объема удаляемых тканей самой молочной железы — от квадрантэктомии к секторальной резекции и далее к туморэктомии. Многочисленные рандомизированные исследования свидетельствуют о высокой эффективности подобных операций [7, 10, 12]. Вместе с тем, органосохраняющие операции позволяют пациентке избежать хронической психотравмирующей ситуации, обусловленной утратой женственности.
В работе Haffty и соавт. (1993) представлены данные о 337 больных с I и II стадией рака, у которых было выполнено только удаление пораженного сегмента без подмышечных лимфоузлов с последующей лучевой терапией на молочную железу и подмышечную область [8]. При 10-летнем наблюдении у 8 больных был диагностирован рецидив в регионарных лимфатических узлах. Таким образом, показатель безрецидивного течения в данной зоне составил 97%, что позволило авторам считать такой объем оперативного вмешательства адекватным для больных с отсутствием данных за метастатическое поражение регионарных лимфатических узлов. Достаточно интересная информация содержится в работе Louis-Sylvestre и соавт. (2004) [9]. В исследование было включено 658 больных раком молочной железы с опухолью менее 3 см и отсутствием клинических данных за метастатическое поражение подмышечных лимфатических узлов. Все пациентки были рандомизированы в 2 группы: в первую вошли больные, которым была выполнена лимфодиссекция (n=326), во вторую — пациентки, которым провели только лучевую терапию на подмышечную область в дозе 50 Гр(n=332). Обе группы были сопоставимы по возрасту, распространенности опухолевого процесса, рецепторному статусу. Как показали результаты исследования, пятилетняя выживаемость была выше в группе пациенток, которым выполнялась лимфодиссекция (96,6% вместо 92,4%; р=0,009). Вместе с тем, десяти- и пятнадцатилетняя выживаемость в обеих группах была практически одинаковой (86,6% против 83,6% и 75,5% против 73,8% соответственно). Справедливости ради необходимо отметить, что рецидив в подмышечной области регистрировался чаще в группе пациенток, которым лимфодиссекция не выполнялась (3% против 1%, р=0,04%). Рецидивы в надключичной области, а также отдаленные метастазы в обеих группах регистрировались приблизительно с одинаковой частотой.
Однако имеются и другие данные. Bland и соавт. (1999) представили результаты лечения 547847 больных раком молочной железы I-II cстадии, которым были выполнены органосохранные операции в клиниках США с 1985 по 1995 гг. [11]. За этот период количество радикальных резекций увеличилось с 17,6% до 36,6%, а число секторальных резекция без подмышечной лимфодиссекции возросло с 6,4% до 10,6%. Последний вид оперативных вмешательств в 2 раза чаще проводился пациенткам старше 70 лет, почти в 3 раза чаще применялся у больных с I стадией заболевания, а также I и II стадией злокачественности. При сравнительном анализе показателей десятилетней выживаемости оказалось, что более выгодно выглядят радикальные резекции молочной железы, чем секторальные резекции: 86% и 58%.
В виду высокой частоты тяжелых сопутствующих заболеваний, снижения функциональных и адаптационно-компенсаторных возможностей организма у больных пожилого и старческого возраста очень часто проведение радикальных операций противопоказано из-за длительности наркоза и опасности серьезных осложнений, поэтому выбор оперативного вмешательства у этих больных является чрезвычайно важным [4].
Материал и методы
Нами проанализированы результаты лечения 101 больной раком молочной железы, которым выполнялось оперативное вмешательство в объеме секторальной резекции в Ульяновском областном клиническом онкологическом диспансере в период с января 1988 по декабрь 2008 г. В контрольную группу вошла 141 больная раком молочной железы, которым было применено оперативное вмешательство Показаниями для выполнения секторальной резекции у больных раком молочной железы служили: отказ больной от радикальной операции; наличие тяжелой сопутствующей патологии, не позволяющей выполнить радикальную операцию; отсутствие клинических данных за метастатическое поражение подмышечных лимфатических узлов. Состояние регионарных лимфатических узлов оценивалось на основании данных клинического и инструментального методов обследования (УЗИ, МРТ, маммография в косой проекции). В сомнительных случаях выполнялась пункционная биопсия подмышечных лимфатических узлов с цитологическим исследованием.
Распределение больных по возрасту показало, что более 2/3 пациенток было старше 60 лет (83,1%), при этом средний возраст пациенток составил 68,6 + 2,1 лет. Подавляющая часть больных (82,2%) находилась в постменопаузе.
В зависимости от распространенности первичного процесса больные распределились следующим образом: 0 стадию имели 8 пациенток (7,9%), I стадию — 45 (44,5%), II a стадию — 48 больных (47,5%). У большинства пациенток (67,4%) размеры первичного очага находились в пределах от 1 до 3 см, при этом средний размер опухоли составил 2,4 + 0,2 см. Из числа исследуемых больных подавляющему большинству (75 человек — 74,3%) проведена оценка степени злокачественности опухоли. Наиболее многочисленной оказалась группа пациенток со II степенью злокачественности — 51 больная (68%). Реже регистрировались I и III степени злокачественности — у 20 (26,6%) и 4 (5,3%) пациенток соответственно. Иммуногистохимическое исследование было проведено 13 больным (12,9%), причем у 12 пациенток был отмечен положительный рецепторный статус по эстрогеновым и прогестероновым рецепторам, в одном случае опухоль была положительна только по эстрогеновым рецепторам. Гиперэкспрессии HER-2/neu выявлено не было.
Учитывая средний возраст пациенток, немаловажным является факт наличия сопутствующей патологии. Соматические заболевания были зарегистрированы у 64 больных (63,4%). У большинства пациенток имелось несколько сопутствующих заболеваний. Наиболее часто встречалась патология сердечно-сосудистой системы: гипертоническая болезнь, стенокардия, постинфарктный кардиосклероз, нарушение ритма, порок сердца, недостаточность кровообращения. Вышеперечисленные заболевания были диагностированы у 48 пациенток (47,5%). Сахарный диабет различной степени тяжести зарегистрирован у 9 больных. Реже встречались последствия острого нарушения мозгового кровообращения (3 больных), хроническая почечная недостаточность (3 больных), бронхиальная астма (3 больных) и цирроз печения (1 больная). Рак другой локализации был выявлен у 4 больных.
От общего числа исследуемых больных чисто хирургическое лечение проведено 25 пациенткам (24,7%). Сочетание оперативного вмешательства с лучевой терапией получили 26 больных (25,7%), а сочетание оперативного лечения с лекарственной терапией — 23 пациентки (22,8%). Комплексное лечение, включающее хирургическое, лекарственное и лучевое, проведено 27 пациенткам (26,8%). Оперативное вмешательство осуществлялось в объеме секторальной резекции под местным обезболиванием. У 52 больных (51,5%) операция выполнялась в стационаре, в то время как у 49 (48,5%) — в амбулаторных условиях. Послеоперационная лучевая терапия проводилась в режиме дробно-протяженного фракционирования (РОД=2 Гр, СОД=44-50 Гр). Из системных методов лечения адьювантную полихимиотерапию получила одна больная, гормонотерапию антиэстрогенами — 49 пациенток.
На основании полученных данных, общая трехлетняя выживаемость составила 89,9%, а пятилетняя — 81,9%. Причем эти показатели оказались практически одинаковыми во всех исследуемых группах и, таким образом, не зависели от метода лечения. Мало чем они отличались и от результатов лечения больных раком молочной железы с использованием радикальной резекции (табл. 1). Показатели трехлетней и пятилетней выживаемости в данном случае достигали 93,2% и 85,2%, соответственно (р + 2,4 койко-дней, в то время как после секторальной резекции среднее пребывание на койке сокращается практически вдвое (12,8 + 1,1 койко-дней).
Резюме
При соблюдении критериев отбора, секторальная резекция может успешно применяться в лечении больных раком молочной железы, не влияя на результаты трех- и пятилетней выживаемости. Использование секторальной резекции у больных раком молочной железы способствует более рациональному использованию коечного фонда и экономии денежных средств лечебными учреждениями.
В.В. Родионов, А.А. Мидленко, А.В. Суетин, Э.Т. Рахматуллина, В.В. Музяков
Ульяновский областной клинический онкологический диспансер
1. Вельдшер Л.З., Габуния З.Р., Праздников Э.Н., Лучшев А.И., Чочуа Г.А., Гвахария Н.В., Прилепо Ю.В. Пути оптимизации объема лимфодиссекции при раке молочной железы. Вестник Московского Онкологического Общества 2001; 1: 2-3.
2. Вельдшер Л.З., Решетов Д.Н., Габуния З.Р., Прилепо В.Н., Прилепо Ю.В. Сторожевые лимфатические узлы при раке молочной железы. Маммология 2007; 1: 23-25.
3. Зуррида С. Локализованные формы рака молочной железы: комбинированная органосохраняющая терапия. Материалы IV ежегодной Российской онкологической конференции. Москва. 82-84 с.
4. Иванов В.М., Ротобельская Л.Е., Высоцкая И.В., Легков А.А. Современные возможности лечения рака молочной железы у больных пожилого и старческого возраста. Маммология 1996; 1: 45-48.
6. Cady B., Stone M.D., Wayne J. New therapeutic possibilities in primary invasive breast cancer . Annals of Surgery. 1993; 218(3): 338-443.
7. Fisher B., Redmond C., Poisson R. et al. Eight-year results of randomized clinical trial comparing total mastectomy and lumpectomy with or without irradiation in treatment of breast cancer. N. Engl. J. Med 1989; 320: 822-828.
8. Haffy B.G., McKhann C., Beinfield M. et al. Breast conservation therapy with-out axillary dissection. A rational strategy in selected patients. Archives of Surgery.1993; 128(12): 1315-1319.
9. Louis-Sylvestre C., Clough K., Asselain B. et al. Axillary Treatment in Conservative Management of Operable Breast Cancer: Dissection of Radiotherapy? Results of a Randomized Study With15 Years of Follow-Up. J. Clin. Oncol. 2004; 1: 97-101.
10. van Dongen J., Voogd A., Fentiman I. et. al. Long-Term Results of a Randomized Trial Comparing Breast-Conserving Therapy With Mastectomy: European Organization for Research and Treatment of Cancer 10801 Trial. J. Nat. Cancer Inst. 2000; Vol. 92: 14.
11. Veronesi U., Paganelli G., Viale G. et al. Sentinel lymph node biopsy and axillary dissection in breast cancer: results in a large series. J. Natl. Cancer Inst.1999; 91(4): 368-373.
12. Veronesi U. , Volterrani F. , Luini A. et al. Breast conservation is a safe method in patients with small cancer of the breast. Long-term results of three randomized trials on 1,973 patients. Eur. J. Cancer 1995; 31A: 1547-1549.
Информация только для специалистов в сфере медицины, фармации и здравоохранения!

Авторы: П.В.Криворотько, В.В. Семиглазов, К.Ю. Зернов, А.С. Емельянов
Оперативные вмешательства в подмышечной области как часть лечебных мероприятий при раннем РМЖ значительно изменились за последние 20 лет. Десятилетиями аксиллярная лимфодиссекция (АЛД) была стандартным решением для определения стадии процесса. АЛД ассоциирована с кратко- и долгосрочной болезненностью верхней конечности. Исследование NSABP B-32 оказалось информативным в отношении безопасности биопсии сигнальных лимфоузлов (БСЛУ) при РМЖ, демонстрируя, что общая выживаемость (OS), безрецидивная выживаемость (DFS) и региональный контроль были статистически эквивалентными между пациентами, которые имели негативные сигнальные лимфоузлы (БСЛУ), и пациентами, подвергнутыми АЛД. Недавнее исследование ACOSOG Z0011 продемонстрировало, что у женщин с ранним РМЖ, подвергшихся органосохраняющим операциям с выявлением метастазов в 1–2 ЛУ, не увеличивался риск локальных или региональных рецидивов при выполнении одной БСЛУ в сравнении с АЛД.
Сегодня решения о системной адъювантной терапии основываются в меньшей мере на статусе подмышечных ЛУ, а скорее – на биологии опухоли. Исследование AMAROS продемонстрировало, что выбор системной адъювантной терапии не менялся в зависимости от того, переносили ли пациенты лучевую терапию на подмышечную зону или подвергались полной подмышечной лимфодиссекции для лечения метастатических сигнальных ЛУ.
Ваш браузер не поддерживает IFrame. Скачать главу в формате PDF
Другие главы из книги:

-
5 минут на чтение

Лимфодиссекция (лимфаденэктомия) – это хирургический вид вмешательства, подразумевающий частичное или полное иссечение лимфатических узлов. Применяется данная процедура не только в терапевтических, но также и в диагностических целях. Лимфодиссекция при раке останавливает распространение атипичных клеточных структур. Эффективность лечения таким методом еще не получила подтверждения, поэтому специалисты используют его в исключительных случаях. Вероятность осложнений довольно высокая.
Что такое
Лимфаденэктомия представляет собой вид операции, основная задача которого – удалить пораженные лимфоузлы и исследовать организм на присутствие онкологических клеток. Ограниченная лимфодиссекция подразумевает иссечение части узлов, окружающих опухолевое образование, а полная – все лимфоузлы, расположенные в месте очага поражения.
При каких заболеваниях проводится
Лимфаденэктомия применяется при онкозаболеваниях. В частности, назначается при диагностировании рака:
- гортани;
- ротовой полости;
- щитовидки;
- пищевода;
- молочных желез;
- желудка;
- легких.
Стоит отметить, что данная процедура назначается при выявлении первичных злокачественных очагов поражения.
Лимфодиссекция имеет различную классификацию.
Специалисты выделяют две разновидности проведения.
Это вид хирургического вмешательства, в ходе которого удалению подвергается группа лимфоузлов. Процедура не способна продлить жизнь больному, а также может спровоцировать развитие ряда последствий, например, расстройство метаболизма в тяжелой форме или лимфедему.
Иссекают лимфатические узлы, локализующиеся на пути, где происходит отток лимфы от органа, пораженного злокачественным новообразованием.
Благодаря данной форме сроки жизни больных в большинстве случаев значительно увеличиваются.
Также существует несколько форм хирургического вмешательства.
Если развивается рак языка или дна полости рта, то выявить метастазы методом томографического исследования сложно. В этих случаях применяется лимфодисекция шейного типа.
Данный вид оперативного вмешательства также способствует предотвращению дальнейшего распространения атипичных клеток по человеческому организму. Выделят два типа процедуры.
Удаляют дальние коллекторы, которые располагаются в области ключицы, подмышечных впадин и внутри грудной железы. Иссечению подвергается не менее десяти лимфатических узлов.
Применяется частичная субтотальная дистальная резекция или полная гастроэктомия. При диссекции удаляют узлы, которые локализуются вдоль артерии селезенки или печени, а также чревного ствола.
Медиастинальная операция подразделяется на три разновидности.
В ходе процедуры удаляют узлы, которые находятся между пищеводом, бронхами, перикардом и легочной веной.
Иссекается часть лимфосети, располагающейся в области очага поражения.
Это хирургическое вмешательство, подразумевающее двухстороннее иссечение поврежденных лимфатических узлов.
Лимфодиссекция имеет следующие виды.
Данная методика применяется в том случае, если необходимо провести биопсию. В результате извлекаются патологические ткани, направляемые в лабораторию. В частности, удаляют региональные лимфоузлы, которые располагаются около пораженного органа.
Лимфодиссекция Д2 проводится в отношении рядом расположенных узлов, а также тех, что идут за ними. Также принимаются во внимание лимфопротоки.
Иссекается обширный участок, который выходит достаточно далеко за границы пораженной анатомической структуры.
Показания
Лимфаденэктомия как диагностический метод применяется в том случае, когда нужно исключить или подтвердить развитие онкологической болезни. В некоторых ситуациях с помощью этого метода оценивают эффективность химиотерапевтического лечения.
Кроме того, процедура назначается для удаления пораженных лимфатических узлов при определенных типах рака.
При онкопатологии придатков или яичников метод применяется после химио-и радиотерапии.
Противопоказания
Лимфодиссекция категорически противопоказана при следующих патологических состояниях:
- нарушенное кровообращение;
- сердечная недостаточность;
- сбои в работе печени и почек;
- отдаленное метастазирование;
- обширная злокачественная опухоль, не поддающаяся хирургическому лечению.
Кроме того, заранее больной должен поставить специалиста о приеме медикаментозных препаратов накануне операции.
Подготовка
Прежде всего пациент должен посетить онколога, который соберет всю необходимую информацию относительно анамнеза жизни и имеющейся клинической картины онкоболезни. Далее врач назначает проведение диагностического обследования. Также в обязательном порядке делают тонкоигольную биопсию, что позволяет изучить содержимое лимфатического узла.
На основании полученных результатов анализов, если какие-либо противопоказания отсутствуют, принимается решение о проведении лимфаденэктомии и назначается день операции.
Также перед процедурой больной должен перестать употреблять ацетилсалициловую кислоту и другие медикаменты, в составе которых она присутствует. Кроме того, нельзя принимать Гепарин и Варфарин. Это объясняется тем, что подобные средства способствуют снижению свертываемости кровяной жидкости, в результате чего вероятность открытия кровотечения в ходе хирургического вмешательства увеличивается в несколько раз.
Аннотация научной статьи по клинической медицине, автор научной работы — Воротников Игорь Константинович, Чхиквадзе Нино Валерьяновна, Рябчиков Денис Анатольевич, Родионова Мария Валерьевна, Ошкина Елена Викторовна
На сегодняшний день одним из обсуждаемых вопросов хирургического лечения первично-операбельного рака молочной железы является целесообразность выполнения лимфаденэктомии в различных объемах. Проведение маммографического скрининга способствует увеличению доли пациенток с минимальным раком молочной железы , у которых стандартная лимфаденэктомия в подавляющем большинстве случаев является избыточной и калечащей процедурой. Нами проанализированы результаты нескольких многоцентровых исследований, которые, на наш взгляд, изменили отношение клиницистов к целесообразности и объему лимфаденэктомии .
Похожие темы научных работ по клинической медицине , автор научной работы — Воротников Игорь Константинович, Чхиквадзе Нино Валерьяновна, Рябчиков Денис Анатольевич, Родионова Мария Валерьевна, Ошкина Елена Викторовна
Lymphadenectomy in breast cancer: pros and cons
Today one of the discussed issues of surgical treatment of primary operable breast cancer is the appropriateness of performing lymphadenectomy in different volumes. Conducting mammographic screening increases the proportion of patients with minimal breast cancer in which a standard lymphadenectomy in the majority of cases is excessive and crippling procedure. We have analyzed the results of several multicenter studies, which in our opinion have changed the attitude of clinicians to the advisability and scope of lymphadenectomy.
ВОРОТНИКОВ И. К., ЧХИКВАДЗЕ Н. В., РЯБЧИКОВ Д. А., РОДИОНОВА М. В., ОШКИНА Е. В., ТИТОВ К. С. VOROTNIKOV I. K., CHKHIKVADZE N. V., RYABCHIKOV D. A., RODIONOVA M. V., OSKINA E. V., TITOV K. S.
Лимфаденэктомия при раке молочной железы: за и против
Lymphadenectomy in breast cancer: pros and cons
Цитирование: VOROTNIKOV I. K., CHKHIKVADZE N. V., RYABCHIKOV D. A., RODIONOVA M. V., OSKINA E. V. et al. Lymphadenectomy in breast cancer: pros and cons. Malignant Tumours 2016; 2: 37-42.
На сегодняшний день одним из обсуждаемых вопросов хирургического лечения первично-операбельного рака молочной железы является целесообразность выполнения лимфаденэктомии в различных объемах. Проведение маммографического скрининга способствует увеличению доли пациенток с минимальным раком молочной железы, у которых стандартная лимфаденэктомия в подавляющем большинстве случаев является избыточной и калечащей процедурой. Нами проанализированы результаты нескольких многоцентровых исследований, которые, на наш взгляд, изменили отношение клиницистов к целесообразности и объему лимфаденэктомии.
Воротников Игорь Константинович — д.м.н., профессор, зав. хиругическим отделением № 5 РОНЦ им. Н. Н. Блохина, e-mail: i.vorotnikov@mail.ru
Чхиквадзе Нино Валерьяновна — к.м.н., врач хирургического отделения № 5 РОНЦ им. Н. Н. Блохина, e-mail: ninochkhi@mail.ru
Рябчиков Денис Анатольевич — к.м.н., старший научный сотрудник хирургического отделения № 5 РОНЦ им. Н. Н. Блохина, e-mail: dr.densr@mail.ru
Today one of the discussed issues of surgical treatment of primary operable breast cancer is the appropriateness of performing lymphadenectomy in different volumes. Conducting mammographic screening increases the proportion of patients with minimal breast cancer in which a standard lymphadenectomy in the majority of cases is excessive and crippling procedure. We have analyzed the results of several multicenter studies, which in our opinion have changed the attitude of clinicians to the advisability and scope of lymphadenectomy.
Vorotnikov Igor Konstantinovich — MD, PhD, DSc, Professor, head.surgical Department No. 5 of Federal state institution Russian oncological scientific center named. N. N. Blokhin, e-mail: i.vorotnikov@mail.ru
Chkhikvadze Nino Valerianovna — MD, PhD, doctor of the surgical Department № 5 of Federal state institution Russian oncological scientific center named. N. N. Blokhin, e-mail: ninochkhi@mail.ru
Ryabchikov Denis Anatolevich — MD, PhD, senior researcher of the surgical Department № 5 of Federal state institution Russian oncological scientific center named. N. N. Blokhin, e-mail: dr.densr@mail.ru
КЛЮЧЕВЫЕ СЛОВА KEY WORDS
рак молочной железы, лимфаденэктомия, радикальная мастэктомия, сигнальный лимфоузел breast cancer, lymph node dissection, radical mastectomy, sentinel lymph node
Титов Константин Сергеевич — д.м.н., заведующий онкохирургическим отделением опухолей кожи и мягких тканей Московского клинического научного центра Департамента здравоохранения г. Москвы, доцент кафедры онкологии и лучевой терапии лечебного факультета Российского национального исследовательского медицинского университета им. Н. И. Пирогова Минздрава РФ, е-mail: ks-titov@mail.ru
Rodionova Maria Valer’evna — oncologist surgical Department of breast pathology fsbi scientific center for obstetrics, Minekologii and Perinatology academician V. I. Kulakov Ministry of health Russian Federation, e-mail: miss.rodionova@gmail.com
Oskina Elena Viktorovna — surgical oncologist Department of breast pathology fsbi scientific center for obstetrics, Minekologii and Perinatology academician V. I. Kulakov Ministry of health of the Russian Federation
Titov Konstantin Sergeevich — MD, RhD, DSc, head of the Oncosurgery Department tumors of skin and soft fabrics in Moscow Clinical Research Center, assistant professor of the Department of Oncology and Radiation Therapy Russian National Medical University, e-mail: ks-titov@mail.ru
Рис. 1. Выживаемость без прогрессирования NSABP B-04
B Overall Survival
Рис. 3. Общая выживаемость NSABP B-04
ние в клиническую практику органосохранных операций и системной терапии [8].
Нами проанализированы результаты нескольких многоцентровых исследований, которые, на наш взгляд, изменили отношение клиницистов к целесообразности и объемам лимфаденэктомии. Одно из первых исследований — анализ результатов 25-летнего наблюдения (NSABP B-04), включающий 1765 пациенток, получивших лечение с июля 1971 по сентябрь 1974 гг.
Трети больных с негативными л/узлами проводилась только РМЭ по Холстеду, 1/3 — мастэктомия без ЛД (МЭ) с облучением регионарных л/узлов и 1/3 — ПМЭ (если в этой группе диагностировались метастазы в регионарные л/узлы — проводилась ЛД). Половине пациенток с позитивными л/узлами проводилась РМЭ по Холсте-ду, другой половине — ПМЭ с облучением регионарных
Years of Follow-up
Рис. 2. Выживаемость без местного рецидива NSABP B-04
л/узлов. Следует отметить, что системная терапия пациенткам не проводилась. Около 70% пациенток в каждой группе были старше 50 лет. Конечно, выживаемость была разной в группе пациенток с клинически пораженными лимфоузлами и без их поражения. Но не было получено статистически достоверных различий в зависимости от метода лечения в каждой из групп.
В отношении местного рецидива отмечается аналогичная картина (р=0,46, р=0,40 соответственно рис. 2) Частота местных и регионарных рецидивов была выше в группе МЭ. Эффективность ЛТ заключалась в существенном снижении вероятности возникновения местного рецидива. Однако на общей выживаемости частота местных рецидивов не отразилась. Главным открытием этого исследования является тот факт, что у 40% пациенток с клинически N0 после РМЭ были диагностированы метастазы в аксиллярные л/узлы. Т.к. все пациентки в исследовании были рандомизированы в несколько групп, авторы предполагают, что у 40% пациенток, которым не выполнялась ЛД на момент выполнения хирургического вмешательства, также имелись метастазы в регионарные л/узлы. Но только приблизительно у У2 этих пациенток регионарные метастазы себя реализовали в качестве первого рецидива заболевания. При 25-летнем сроке наблюдения не было получено улучшения показателей выживаемости при дополнении ПМЭ лучевой терапией у пациенток с N0 [8]. В 1999 году Орр публикует в Anns Surg Onc метаанализ, в котором сравнивалась выживаемость больных РМЖ в зависимости от выполнения лимфодиссекции. В анализ вошли 6 рандомизированных исследований и примерно 3000 пациенток в течение 4-х десятилетий. Все 6 исследований показали, что аксиллярная лимфодиссекция улучшает общую выживаемость на 4-16%. Объединяя данные исследований, выполнение аксиллярной лимфодиссекции дает улучшение выживаемости на 5,4%. Следует отметить,
что в исследованиях почти не было пациенток с Т 1а, которые могли бы повлиять на результат. Также пациенты не получали адъювантного лечения и единственным на тот момент фактором, который мог бы оказать влияние на выживаемость, была лимфодиссекция [9]. В начале 2003 года было опубликовано американское рандомизированное мультицентровое исследование В32. В исследование вошли женщины Т 1-2 и N0 по клиническим и инструментальным данным. Стратификация проводилась по таким показателям, как возраст пациентки на момент включения в исследование (больше или меньше 50), размер опухолевого узла ( 4.1 ст) и вид предполагаемого хирургического лечения (лампэкто-мия/мастэктомия). Пациентки получали стандартную адъ-ювантную терапию, причем группы были хорошо сбалансированы как по системной терапии, так и по получаемой в дальнейшем лучевой терапии. Затем пациентки рандоми-зировались на группу БСЛУ+ЛД, причем лимфодиссекция выполнялась независимо от статуса сигнального лимфоузла. В анализ вошли только те пациентки этой группы, у которых отсутствовали метастазы в сигнальном лимфоузле. Вторая группа — группа биопсии сторожевого лимфоузла. В случае отсутствия метастаза в сигнальном лимфоузле, лимфодиссекция в этой группе не выполнялась. В анализ не вошли пациентки этой группы, у которых были метастазы в сигнальном лимфоузле (им выполнялась лимфо-диссекция). В итоге в анализ вошли результаты лечения пациенток, которым проводилась БСЛУ или БСЛУ+лим-фодиссеция при отсутствии метастатического поражения СЛУ. Следует отметить, что первоначально СЛУ исследовались только на наличие макрометастазов [10]. В 2010 году представлены результаты 8-летнего наблюдения и статистически достоверных результатов по всем показателям получено не было.
Годом позже, в 2011 году опубликованы результаты исследования по изучению влияния оккультных метастазов в сторожевом лимфоузле на выживаемость, проходившего также в рамках исследования В-32. Детальное исследование сторожевых л/у, в которых при стандартном исследовании (окраска G&E, толщина среза 2 мм) макрометастазы выявлены не были, позволило выявить оккультные метастазы в 15% случаев. Как мы знаем из дизайна исследования, дополнительную лимфодиссекцию эти пациентки не получали. Так как же влияют оккультные метастазы в сторожевом лимфоузле на выживаемость? Никак. Во всяком случае не ухудшают ни общую выживаемость, ни выживаемость без прогрессирования, ни выживаемость без отдаленных метастаз [11, 12].
Не менее революционным оказалось исследование Z0011. Исследование началось также в 1999 году, когда еще не было результатов исследования В-32 и не было еще твер-
При среднем сроке наблюдения 6,3 года показатели общей выживаемости и специфической выживаемости оказались практически одинаковыми, также как и выживаемость без регионарного рецидива. Лимфодиссекция не оказывает существенного влияния на общую и специфическую выживаемость пациентов РМЖ с Т 1-2 и позитивными сигнальными л/узлами, которым выполнялась лампэктомия, адъювантная системная терапия и ЛТ на молочную железу [11].
Результаты данного исследования легли в основу последних рекомендаций St. Gallen. Но следует подчеркнуть, что панель экспертов настоятельно не рекомендует ограничиваться только удалением сторожевых лимфоузлов в случае более чем 2-х пораженных СЛУ, если пациентке выполнена мастэктомия, не планируется проведение лучевой терапии, или пациентки получали неоадъювантную терапию вследствие отсутствия исследований, доказывающих обоснованность такого подхода [12]. Можно ли отказаться от лимфодиссекций, если да, то в каких случаях? Не менее трети больных РМЖ составляют пациентки старшей возрастной группы, страдающие сопутствующей патологией, для которых объем операции однозначно имеет значение. Вероятность развития РМЖ увеличивается с возрастом, достигая своего пика к 75-79 годам [13, 14]. Martelli G. и др. в 2011 году представили результаты 15-летнего наблюдения. Сравнивались две группы пациенток старше 70 лет с Т 1-4 и отсутствием клинических данных метастатического поражения лимфоузлов. Всем пациенткам была выполнена органосохранная операция. Одной группе пациенток выполнялась аксиллярная лимфодиссекция, второй — не выполнялась ни БСЛУ, ни лимфодиссекция. Вне зависимости от экспрессии ЭР, пациентки получали гормонотерапию в течение 2-х лет (гормонозависимые опухоли были у 91% пациенток). Послеоперационную
Crude cumulative incidence of death
Crude cumulative incidence of death
Рис. 4. Ма^еШ G. et а1. не получено статистически достоверных различий по показателю смертности
лучевую терапию получали треть пациенток (в зону облучения аксиллярные лимфоузлы не входили) [15]. Как показали результаты исследования, из 172 пациенток, которым была выполнена аксиллярная лимфодиссекция, у 58 (33,7%) были выявлены метастазы в аксиллярных лимфоузлах, в том числе при рТ1(29%). Соответственно, в таком же проценте случаев можно предположить наличие метастатического поражения лимфоузлов в группе без лимфаденэктомии. Но лишь у 6% пациентов (4% в группе рТ 1), которым аксиллярная лимфодиссекция не выполнялась, развился регионарный рецидив (средняя продолжительность безрецидивного периода составила 33 месяца). Соответственно, из 33% реализовали себя и потребовали обоснованной лимфодиссекции метастаз в л/узлах только в 6% случаев. Не получено статистически достоверных различий по показателю смертности от рака молочной железы в исследуемых группах рис. 4 [15]. Итак, можно ли отказаться от выполнения лимфодиссекции? Если да, то в каких случаях? В 2015 году на конференции в St.Gallen были даны следующие рекомендации: в случае отсутствия метастатического поражения сигнальных лимфоузлов от выполнения аксиллярной
1. Аксель Е. М. Злокачественные образования молочной железы: Состояние онкологической помощи, заболеваемость и смертность. Маммология. 2006; (1): 9-15.
Axel E. M. Malignant tumors of the breast: State of cancer care, morbidity and mortality. Mammalogy. 2006; (1): 9-15.
2. Давыдов М. И., Аксель Е. М. Статистика злокачественных новообразований в России и странах СНГ. Вестник РОНЦ им. Н. Н. Блохина РАМН. 2010: 21(2): (прил. 1).
Davydov M. I., Aksel E. M. Statistics of malignant neoplasms in Russia and CIS countries. Bulletin of ronts. N. N. Blokhin of the RAMS. 2010: 21(2): (ADJ. 1).
3. Кулигина Е. Ш. Эпидемиологические и молекулярные аспекты рака молочной железы. Практическая онкология. 2010; 11(4):203-216.
Kuligina, E. S. Epidemiological and molecular aspects of breast cancer. Practical Oncology. 2010; 11(4):203-216.
4. Семиглазов В. Ф. и др., Проблемы хирургического лечения рака молочной железы. Практическая онкология. 2010; 11(4):217-220.
Semiglazov V. F. and others, Problems of surgical treatment of breast cancer. Practical Oncology. 2010; 11(4):217-220.
5. Peitzsch C, Kurth I, Kunz-Schughart L, Baumann M, Dubrovska A. Discovery of the cancer stem cell related determinants of radioresistance. Radiother Oncol 2013;10(8):378-387.
6. Пролиферативные и иммунологические характеристики молекулярно-биологических подтипов рака молочной железы. Новикова И. А., Шатова Ю. С., Златник Е. Ю., Пржедецкий Ю. В., Ульянова Е. П., Черникова Е. Н. Международный журнал прикладных
и фундаментальных. 2014; 11:116-119.
Novikova I. A., Shatov S., E. J. Zlatnik, Przelecki Y. V., ul’yanova, E. P., Chernikova E. N. Proliferative and immunological characteristics of molecular-biological subtypes of breast cancer international journal of applied and fundamental. 2014; 11:116-119.
7. Halsted W. S. The results of radical operations for the cure of cancer of the breast. Ann.Surg 1907; 46:1-5.
8. B. Fisher, et al. Twenty-Five-Year Follow-up of a Randomized Trial Comparing Radical Mastectomy, Total Mastectomy, and Total Mastectomy Followed by Irradiation. N. Engl. Med., 2002; 347(8): 567-575.
9. Orr RK. The impact of prophylactic axillary node dissection on breast cancer survival: a Bayesian meta-analysis. Ann Surg Oncol. 1999; 6109: 116-27.
10. Rag et al. Ann of Surg Oncol. 2003; 10 (10): 1-8.
11. A.E. Giuliano et al., Axillary Dissection vs No Axillary Dissection in Women With Invasive Breast Cancer and Sentinel Node Metastasis. JAMA. 2011;305(6): 569-575.
12. Семиглазов В. Ф. и др. Общие рекомендации по лечению раннего рака молочной железы St. Gallen-2015, адаптированные экспертами Российского общества онкомаммологов. Oпухоли женской репродуктивной системы. 2015; 3: 43-60.
Semiglazov V. F., et al. General recommendations for treatment of early breast cancer St. Gallen-2015 adapted by experts of Russian society of oncomammology. Tumors of the female reproductive system. 2015; 3: 43-60.
13. Иванов В. М., Летягин В. П., Высоцкая И. В., Погодина Е. М., Абашин С. Ю., Перадзе Н. А. Лечение рака молочной железы у больных пожилого и старческого возраста. Монография. Москва 2001; 9-45.
Ivanov V. M, Letyagin V. P., Vysotskaya I. V., Pogodin, E. M., Abashin S. Yu., Peradze N.. The treatment of breast cancer patients of elderly and senile age. Monograph. Moscow 2001; 9-45.
14. Cuna G., Treatment of breast cancer in in elderly patients.
J. Surg.Oncol. 1993; 103(4):379-85.
15. Martelli G. et al. Axillary Dissection Versus No Axillary Dissection in Elderly Patients with Breast Cancer and No Palpable Axillary Nodes: Results After 15 Years of Follow-Up. Ann Surg Oncol. 2011; 18(1): 125-133.




