Клинические преимущества, предоставляемые с использованием комбинированных таксанов и антрациклинов в первой линии химиотерапии для метастатической карциномы молочной железы (MBC), остаются неопределенными. Этот метаанализ сравнивает преимущества использования комбинации антрациклинов наряду с таксанами в сравнении с использованием химиотерапевтических режимов на основе одного агента при лечении MBC.
Соответствующие клинические испытания, а также рефераты статей, представленных на крупных конференциях по борьбе с раком, проводились в различных базах данных, включая библиотеку PubMed, Embase и Cochrane. Соответствующие исследования имели первичную конечную точку общей выживаемости (ОС) и вторичные конечные точки, которые включали выживаемость без прогрессирования (ППС), отказ от времени лечения (ТТФ), время прогрессирования (ТТП), скорость объективного ответа (ОРР) уровень контроля заболеваемости (DCR) и безопасность. Соотношения рисков OS, PFS, TTF и TTP, коэффициенты шансов ORR и DCR и коэффициенты риска (RR) для токсичности 1-2 и 3-4 классов были извлечены из полученных исследований и проанализированы с использованием различных статистических методов , Метааналитические оценки были получены из модели случайного эффекта.
Пятнадцать испытаний были включены в окончательный метаанализ, и результаты показывают, что химиотерапия комбинированными антрациклинами и таксанами существенно не улучшает ОС пациентов с MBC по сравнению с ОС, достигнутой с использованием отдельных режимов таксана или антрациклина. По сравнению с режимами, основанными на таксане, комбинированный таксан вместе с схемами антрациклинов не смог значительно улучшить ТТП, ОРР или DCR, но значительно улучшил ТТП и ОРР по сравнению с режимами, основанными на антрациклине. Кроме того, как отдельные таксановые, так и антрациклиновые режимы вызывали меньше токсических реакций по сравнению с комбинированным таксаном наряду с режимами антрациклинов. В схемах на основе таксана были более низкие ОР для побочных эффектов нейтропении, инфекции / фебрильной нейтропении, тошноты и рвоты, тогда как у пациентов, получавших схемы на основе антрациклинов, были снижены RR для нейтропении, инфекции / фебрильной нейтропении, анорексии, воспаления стоматита / слизистой оболочки, диареи, и сенсорная невропатия. Напротив, пациенты, получающие схемы, основанные на таксане, находились в более высоких ОР для синдрома кисти и диареи, тогда как пациенты, получавшие схемы на основе антрациклинов, имели более высокие ОР для тошноты и рвоты.
Режим лечения, основанный на таксане, может быть лучшим вариантом, чем комбинированный режим таксана / антрациклина для лечения пациентов с распространенным раком молочной железы, поскольку он дает эквивалентные клинические результаты и имеет меньшую токсичность по сравнению с другими подобными режимами.
Рак молочной железы является второй по частоте причиной смерти от рака среди женщин в Китае. При лечении пациентов с метастатическим карциномой молочной железы (MBC) комбинированные схемы химиотерапии дают более высокую объективную частоту ответа (ORR) и более длительное среднее время до прогрессирования (ТТП) по сравнению с одноагентной химиотерапией. Антрациклины часто используются при лечении MBC, независимо от того, какие другие химиотерапевтические агенты вводятся. Кроме того, комбинированная терапия на основе антрациклина улучшает как ОРР, так и ТТП по сравнению с режимами лечения без антрациклина.1 В исследовании фазы II комбинированная терапия на основе антрациклина дала ОРС в пределах от 35% до 70% .2 С 1990-х годов таксаны были предложены в качестве стандартного варианта лечения для пациентов с MBC, и Китайское управление по контролю за продуктами и лекарствами одобрило их использование при лечении пациентов с MBC. Несколько рандомизированных клинических испытаний (РКИ) показали, что паклитаксел и доцетаксел являются 2 наиболее эффективными средствами для лечения MBC. При использовании в химиотерапии первой линии, терапия паклитакселом и доцетакселом дает ORR от 32% до 62% и от 40% до 68% соответственно.2 Однако гематологическая токсичность часто ограничивает использование комбинированной терапии антрациклином и таксаном.
Хотя недавние клинические испытания сравнивали эффективность комбинированного антрациклина наряду с режимами таксана (АТ) с аналогами схем на основе антрациклина (A-nonT) и на основе таксана (T-nonA), точные преимущества, реализованные с использованием комбинации таких наркотики остаются в значительной степени неопределенными из-за небольшого числа исследованных пациентов. Количественный анализ, такой как метаанализ, полезен для исследователей, поскольку он может помочь определить преимущества и риски использования комбинированного таксана наряду с схемами антрациклинов в качестве первой линии химиотерапии для пациентов с MBC.3,4
В современной медицине, основанной на фактических данных, большие РКИ или метаанализы прошлых исследований часто используются для получения рекомендаций при выборе методов лечения заболеваний. Это особенно актуально, когда существующие РКИ включают лишь небольшое число пациентов, не достигают своих определенных конечных точек или дают противоречивые результаты.5,6 Мы провели этот метаанализ РКИ и презентаций на крупных совещаниях, чтобы определить, следует ли использовать комбинацию антрациклины и таксаны превосходят использование антрациклинов или таксанов сами по себе при лечении MBC. Нашими первичными результатами были сравнения общих показателей выживаемости (ОС), достигаемых с использованием A-T против A-nonT, а также схем A-T против T-nonA chemotherapy. Наши вторичные результаты включали ТТП, выживаемость без прогрессирования (ППС), отказ от времени лечения (ТТФ), ОРР, скорость борьбы с болезнями (DCR) и основные токсические эффекты.
Все исследования, включенные в наш метаанализ, должны были удовлетворять следующим критериям: в исследовании сообщалось о диагнозе прогрессирующего рака молочной железы или метастатического заболевания, а также о демографических характеристиках исследуемой популяции (возраст, пол и статус работы).
Таксаны или антрациклины использовались либо отдельно, либо в комбинации в качестве терапии первой линии в случаях рака молочной железы с продвинутой стадией.
У включенных пациентов не было серьезных сопутствующих заболеваний или вторичных опухолей (за исключением рака кожи немеланомы или локализованных опухолей шейки матки).
Пациенты в контрольной группе получали либо схему лечения антрациклином, либо таксаном, тогда как пациенты в экспериментальной группе лечились комбинацией таксанов и антрациклинов.
Сообщалось о постановке опухоли и последующих результатах наблюдения.
Из нашего метаанализа были исключены следующие типы исследований: несравнимые исследования и непроспективные исследования; исследования, в которых таксаны и (или) антрациклины использовались в отличие от терапии первой линии; исследования с несравнимыми конечными точками; и исследования, в которых химиотерапевтические агенты получали несистемным или пероральным способом введения (например, внутриартериальной или внутрибрюшинной инфузией).
Отобранные исследования были независимо исследованы 2 исследователями (R.Z. и S.W.) для скрининга на гомогенность. Были извлечены и оценены различные переменные из выбранных исследований (например, количество зарегистрированных пациентов, год публикации, график лечения и клиническая эффективность). Данные о частоте токсичности были получены из профиля безопасности каждого исследования. Разногласия относительно выбора исследования были разрешены арбитром (P.T.). Первичной конечной точкой была ОС, а вторичными конечными точками были PFS, TTF, TTP, ORR, DCR и безопасность.
Выбранные исследования оценивались по их качеству на основе следующих 4 факторов, описанных в Справочнике Кокрановских рецензентов: метод рандомизации, маскировка распределения, слепота и адекватность последующих действий.11,12 В шести исследованиях был получен показатель A (низкий риск от уклона), 5 получили оценку B (промежуточный риск предвзятости), а 4 были забиты как C (высокий риск предвзятости).
С.А. Тюляндин
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
Две публикации в недавних номерах Journal of Clinical Oncology посвящены выбору адъювантной химиотерапии у больных операбельным раком молочной железы [1,2]. В работе Giordano et al. [1] анализируется частота назначения антрациклин-содержащих и таксан-содержащих (безантрациклиновых) комбинаций для проведения адъювантной терапии с 1998 по 2009 год по базам данных страховки Medicare и частных страховых компаний США (около 35 000 больных). Авторы отмечают, что в анализируемой когорте начиная со второй половины 2005 года происходит снижение частоты назначения антрациклин-содержащих комбинаций и значительно растет частота назначения таксан-содержащих (см. рис.1).
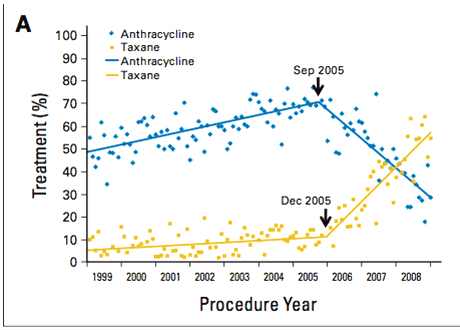
Рисунок 1. Частота назначения антрациклин-содержащих и таксан-содержащих комбинаций для проведения адъювантной терапии больных раком молочной железы (Giordano SH et al., JCO 2012, 30:2232).
Это снижение наблюдается во всех возрастных группах, при всех фенотипах заболевания и не зависит от географии проведения лечения. Несмотря на падение, антрациклин-содержащие комбинации все еще чаще назначаются женщинам моложе 65 лет с HER2-негативным раком молочной железы, в то время как пожилым и больным любого возраста с HER2-позитивным раком чаще назначают безантрациклиновые комбинации на основе таксанов. Это связано с публикацией и представлением на международных конгрессах в 2005 году предварительных результатов исследований US Oncology trial 9735 и BCIRG 006 [3,4]. Окончательные результаты этих исследований были опубликованы позднее [5,6].
В исследовании 9735 проведено сравнение эффективности и токсичности назначения 4 курсов комбинации доцетаксел и циклофосфан (ТС) в сравнении с 4 курсами химиотерапии доксорубицин и циклофосфан (АС) [5]. Комбинации ТС достоверно улучшили результаты безрецидивной (7-летняя безрецидивная выживаемость составила 81% для ТС и 75% для АС, р.=0,033, снижение относительное риска прогрессирования на 26%) и общей (7-летняя общая выживаемость 87% и 82% соответственно, р=0,032, снижение относительного риска смерти составило 31%) выживаемости (см. рис. 2). Улучшение результатов лечения наблюдалось независимо от возраста, статуса гормональных рецепторов и HER2.
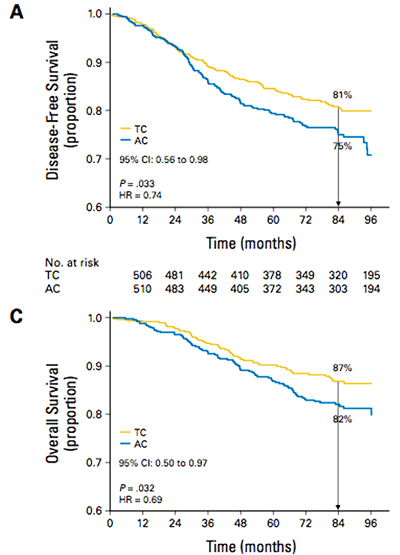
Рисунок 2. Кривые безрецидивной и общей выживаемости больных раком молочной железы,
получавших адъювантную химиотерапию комбинациями ТС и АС в рамках исследования US Oncology trial 9735
(Jones SE et al. J Clin Oncol 2009 27:1177-1183).
Это улучшение результатов лечения было достигнуто при умеренном усилении гематологической токсичности в группе ТС (частота фебрильной нейтропении 5% для ТС и 2,5% для АС) и равной кардиотоксичности (или скорее ее отсутствии, ибо клинически значимая сердечная недостаточность была зарегистрирована только у одной больной в группе АС). Полученные результаты дали основание рекомендовать назначение безантрациклиновой комбинации ТС для проведения адъювантной терапии больным раком молочной железы.
В исследовании BCIRG 006 проведена оценка эффективности добавления трастузумаба к различным режимам адъювантной химиотерапии: антрациклиновый ACTH (доксорубицин, циклофосфан, доцетаксел, трастузумаб) и безантрациклиновый TCH (доцетаксел, циклофосфан, трастузумаб) [6]. В контрольной группе использовали назначение режима ACT (доксорубицин, циклофосфан, доцетаксел). Добавление трастузумаба достоверно уменьшило частоту рецидивов (снижение относительного риска прогрессирования заболевания на 36% и 25% при использовании ACTH и TCH соответственно по сравнению с химиотерапией АСТ только) и обусловило тенденцию к уменьшению числа умерших от прогрессирования опухолевого процесса (снижение относительного риска смерти на 37% и 23% соответственно). В результате 5-летняя безрецидивная выживаемость составила 75% для АСТ, 81% для ТСН и 84% для АСТН.
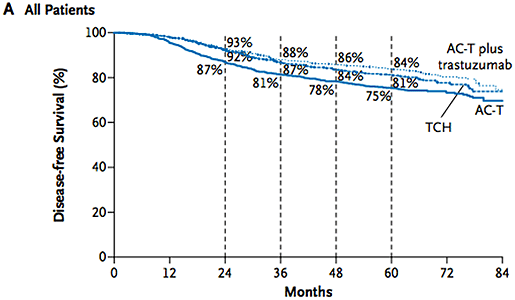
Рисунок 3. Кривые выживаемости больных HER2-позитивным раком молочной железы после адъювантной терапии в рамках исследования BCIRG 006 (Slamon D et al. N Engl J Med 2011, 365:1273-1283).
Хотя дизайн исследования не предполагал сравнение групп больных, получавших АСТН и ТСН, результаты исследования были восприняты как свидетельство равной эффективности антрациклиновых и безантрациклиновых комбинаций в сочетании с трастузумабом у больных HER2-позитивным раком молочной железы. С учетом меньшего риска возникновения кардиомиопатий авторы исследования сделали вывод о преимуществе назначения комбинации ТСН, обладающей равной эффективностью и меньшей токсичностью по сравнению с антрациклиновой комбинацией.
Результаты этих двух исследований обусловили снижение частоты назначения антрациклиновых и увеличение частоты назначения безантрациклиновых комбинаций отдельно или в сочетании с трастузумабом в качестве адъювантной терапии у больных операбельным раком молочной железы. Остается неизвестным, как эти изменения повлияли на отдаленные результаты лечения.
В июньском номере журнала Journal of Clinical Oncology опубликован комментарий, посвященный выбору режима адъювантной химиотерапии у больных HER2-позитивным раком молочной железы [2]. Добавление трастузумаба к адъювантной химиотерапии достоверно и существенно улучшает результаты лечения операбельным раком молочной железы по данным нескольких рандомизированных исследований 6. Во всех этих исследованиях, ставивших первоочередную задачу по оценке эффективности трастузумаба, в качестве режимов химиотерапии использовались антрациклин-содержащие комбинации. Авторы комментария подробно и критично рассматривают цели, дизайн и результаты исследования BCIRG 006 и подчеркивают ошибочность отказа от антрациклиновых комбинаций при проведении адъювантной терапии больным HER2-позитивным раком молочной железы.
Во-первых, как уже говорилось, дизайном исследования не предполагалось сравнение двух групп больных, получавших трастузумаб, с целью определения наилучшего режима химиотерапии. Дизайн исследования предполагал лишь сравнение контрольной группы с каждой в отдельности группой химиотерапии и трастузумаба. Результаты безрецидивной выживаемости несколько лучше (на 3%) при назначении АСТН в сравнении с TCH. Это не позволяет исключить вероятность большей эффективности антрациклиновой комбинации.
Во-вторых, хотя в литературе отсутствуют данные о сравнении двух режимов химиотерапии АСТН и ТСН в качестве адъювантной химиотерапии, результаты рандомизированного исследования свидетельствуют о большей непосредственной эффективности и лучших отдаленных результатах антрациклиновых комбинаций в сочетании с трастузумабом и еженедельного паклитаксела в сочетании с трастузумабом по сравнению с ТСН в качестве предоперационной системой терапии [12].
В-третьих, предклинические и клинические данные свидетельствуют о синергизме адъювантного назначения антрациклинов и таксанов у больных HER2-позитивным раком молочной железы [13,14]. Значение карбоплатина в этой популяции больных не определено. Создание комбинации ТСН базируется на предклинических данных о синергизме производных платины и трастузумаба. Между тем, в клиническом исследовании у больных метастатическим HER2-позитивным раком молочной железы получены одинаковая эффективность комбинаций ТН и ТСН, что ставит под сомнения целесообразность добавления карбоплатина к доцетакселу [15].
В-четвертых, комбинация ACTH, возможно, не лучшая по эффективности антрациклиновая комбинация для проведения адъювантной терапии у больных HER2-позитивным раком молочной железы. Известно, что назначение антрациклинов и таксанов каждые 2 недели превосходит по эффективности 3-недельное введение этих препаратов в качестве адъювантной терапии [16]. Показано, что еженедельное введение паклитаксела является наиболее эффективным режимом назначения таксанов, особенно при совместном назначении с трастузумабом после антрациклинов при проведении адъювантной терапии [17]. Таким образом, режим АСТН может быть модифицирован на основании имеющегося клинического опыта с целью повышения эффективности и снижения токсичности.
В-пятых, основной причиной отказа от антрациклинов при проведении адъювантной химиотерапии является потенциальная кардиотоксичность препарата, которая усиливается при одновременном назначении с трастузумабом, и риск развития вторичных острых лейкозов. Частота развития вторичных лейкозов у больных в исследовании ВСIRG была одинаковой в обеих группах (по одному случаю в каждой группе за 5 лет наблюдения) [6]. Кардиомиопатии 3-4 степени отмечены у 21 больного в группе ACTH и у 4 больных в группе TCH. Однако за время наблюдения ни один больной с кардиомиопатией не умер от этого осложнения. У большинства больных со временем на фоне адекватной терапии происходит улучшение или даже нормализация сократительной способности миокарда. Разработаны критерии риска возникновения кардиомиопатии при проведении терапии трастузумабом (возраст старше 65 лет, фракция выброса левого желудочка в диапазоне 50-55%, наличие артериальной гипертензии), позволяющие снизить риск этого осложнения до 1% при назначении антрациклиновых режимов в сочетании с трастузумабом [18].
В заключение, антрациклин-содержащая адъювантная химиотерапия теряет популярность и активно замещается безантрациклиновыми комбинациями на основе таксанов. Без сомнения, выигрывают от перехода на безантрациклиновые комбинации больные с повышенным риском развития кардиомиопатии. Для остальных больных отдаленные последствия такого перехода неизвестны. Однако для больных с HER2-позитивным раком молочной железы отказ от антрациклинов выглядит преждевременным. До тех пор, пока нет свидетельств о преимуществе безантрациклиновых комбинаций, полученных при проведении правильно спланированных рандомизированных исследований, комбинации с включением антрациклинов и таксанов в сочетании с трастузумабом должны оставаться основой адъювантной терапии больных HER2-позитивным раком молочной железы.
- Giordano SH, Lin Y-L, Kuo YF, Hortobagui GH, Goodwin JS. Decline in the use of anthracyclines for breast cancer. J Clin Oncol 2012, 30:2232-2239.
- Burstein HJ, Piccart-Gebhart MJ, Perez EA, et al. Choosing the best trastuzumab-based adjuvant chemotherapy regimen: Should we abandon anthracyclines. J. Clin Oncol 2012, 30:2179-2182.
- Jones SE, Savin MA, Holmes FA, et al. Phase III trial comparing doxorubicin plus cyclophosphamide with docetaxel plus cyclophosphamide as adjuvant therapy for operable breast cancer. J Clin Oncol 2006, 24:5381-5387.
- Slamon DJ, Eiermann W, Robert N, et al. Phase III randomized trial comparing doxorubicin and cyclophosphamide followed by docetaxel with doxorubicin and cyclophosphamide followed by docetaxel and trastuzumab with docetaxel, carboplatin, and trastuzumab in HER2 positive early breast cancer patients: BCIRG006 Study. Breast Cancer Res Treat 2005, 94(suppl):s5.
- Jones S, Holmes FH, O’Shaughnessy J, et al. Docetaxel with cyclophosphamide is associated with an overall survival benefit compared with doxorubicin and cyclophosphamide: 7-year follow-Up of US Oncology research trial 9735. J Clin Oncol 2009, 27:1177-1183.
- Slamon D, Eiermann W, Robert N, et al. Adjuvant trastuzumab in HER2-positive breast cancer. N Engl J Med 2011, 365:1273-1283.
- Perez EA, Romond EH, Suman VJ, et al. Four-year follow-up of trastuzumab plus adjuvant chemotherapy for operable human epidermal growth factor receptor 2-positive breast cancer: Joint analysis of data from NCCTG N9831 and NSABP B-31. J Clin Oncol 2011, 29:3366-3373.
- Gianni L, Dafni U, Gelber RD, et al. Treatment with trastuzumab for 1 year after adjuvant chemotherapy in patients with HER2-positive early breast cancer: A 4-year follow-up of a randomised controlled trial. Lancet Oncol 2011, 12:236–244.
- Joensuu H, Kellokumpu-Lehtinen PL, Bono P, et al. Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer. N Engl J Med 2006, 354:809-820.
- Gianni L, Eiermann W, Semiglazov V, et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): A randomized controlled superiority trial with a parallel HER2-negative cohort. Lancet 2010, 375:377-384.
- Perez EA, Suman VJ, Davidson NE, et al. Sequential versus concurrent trastuzumab in adjuvant chemotherapy for breast cancer. J Clin Oncol 2011, 29:4491-4497.
- Bayraktar S, Gonzalez-Angulo AM, Lei X, et al. Efficacy of neoadjuvant therapy with trastuzumab concurrent with anthracycline- and nonanthracycline-based regimens for HER2-positive breast cancer. Cancer 2012, 118:2385-2393.
- Gennari A, Sormani MP, Pronzato P, et al. HER2 status and efficacy of adjuvant anthracyclines in early breast cancer: A pooled analysis of randomized trials. J Natl Cancer Inst 2008, 100:14-20.
- Hayes DF, Thor AD, Dressler LG, et al. HER2 and response to paclitaxel in node-positive breast cancer. N Engl J Med 2007, 357:1496-1506.
- Valero V, Forbes J, Pegram MD, et al. Multicenter phase III randomized trial comparing docetaxel and trastuzumab with docetaxel, carboplatin, and trastuzumab as first-line chemotherapy for patients with HER2-gene-amplified metastatic breast cancer (BCIRG 007 study): Two highly active therapeutic regimens. J Clin Oncol 2011, 29:146-156.
- Citron ML, Berry DA, Cirincione C, et al. Randomized trial of dose-dense versus conventionally scheduled and sequential versus concurrent combination chemotherapy as postoperative adjuvant treatment of node-positive primary breast cancer: First report of Intergroup Trial C9741/Cancer and Leukemia Group B Trial 9741. J Clin Oncol 2003, 21:431-439.
- Sparano JA, Wang M, Martino S, et al. Weekly paclitaxel in the adjuvant treatment of breast cancer. N Engl J Med 2008, 358:1663-1671.
- Tan-Chiu E, Yothers G, Romond E, et al. Assessment of cardiac dysfunction in a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel, with or without trastuzumab as adjuvant therapy in node-positive, human epidermal growth factor receptor 2–overexpressing breast cancer: NSABP B-31. J Clin Oncol 2005, 23:7811-7819.
Поделиться |
Антрациклины и таксаны являются активными классами химиотерапевтических средств, используемых до или после хирургического лечения раннего рака молочной железы.
Какова цель этого обзора?
Нашей целью было выяснить, изменятся ли исходы заболевания у лиц с ранним раком молочной железы (при котором рак не распространился за пределы лимфатических узлов вблизи молочной железы) при проведении химиотерапии таксанами перед терапией антрациклинами (а не после нее).
Хотя польза добавления таксанов к терапии антрациклинами хорошо установлена, неизвестно, влияет ли последовательность химиотерапии таксанами (до или после химиотерапии антрациклинами) на продолжительность жизни людей, длительность периода ремиссии рака молочной железы, завершение ими лечения, побочные эффекты и качество жизни пациентов.
Ключевые сообщения обзора
Последовательность, в которой назначается химиотерапия таксанами и антрациклинами, может иметь слабое влияние или не оказывать его вовсе на:
– продолжительность жизни пациентов;
– длительность периода ремиссии рака молочной железы;
– завершение лечения и
– побочные эффекты лечения.
Ни одно из исследований не сообщало данные относительно качества жизни. Во многих исследованиях не было информации о важных исходах, таких как продолжительность жизни людей или длительность периода ремиссии рака молочной железы. Мы ожидаем публикации одного соответствующего исследования с участием 112 человек, получавших химиотерапию до хирургического лечения рака молочной железы, для включения в обновленный вариант этого обзора.
В целом, результаты обзора не обнаружили достаточных доказательств пользы или вреда, в зависимости от последовательности назначения таксанов и антрациклинов. В большинстве учреждений стандартной практикой является применение антрациклинов с последующим назначением таксанов. На основании этого обзора доказательств, доступные в настоящее время данные не поддерживают изменения этой практики.
Что было изучено в этом обзоре?
Женщинам с ранним раком молочной железы, имеющим более высокий риск рецидива рака, часто назначают комбинированную химиотерапию антрациклинами и таксанами до или после хирургического лечения для снижения риска рецидива рака и увеличения продолжительности жизни. Традиционно в первую очередь применяют антрациклины с последующим назначением таксанов, но убедительных доказательств в пользу этой последовательности нет. Мы сравнили возможность применения таксанов перед назначением антрациклинов со стандартным лечением, начинающимся с применения антрациклинов.
Каковы главные результаты этого обзора?
Все участники исследований были женщинами. Мы нашли пять исследований с участием 1415 человек, в которых химиотерапия проводилась до операции. В трех из этих исследований лекарственным препаратом из группы таксанов был паклитаксел, тогда как в остальных двух исследованиях использовался доцетаксел. В двух исследованиях использовался один препарат из группы антрациклинов (эпирубицин), в то время как в трех исследованиях применялась комбинация эпирубицина, циклофосфамида и фторурацила. Было также четыре исследования с участием 280 человек, в которых сравнивали последовательность применения таксанов и антрациклинов среди участников, которые получали химиотерапию после хирургического лечения рака молочной железы. Таксаном, использованным во всех четырех исследованиях, был доцетаксел, в то время как используемые антрациклины представляли собой комбинацию эпирубицина или адриамицина с либо циклофосфамидом, либо фторурацилом (или и тем, и другим).
Основными результатами было то, что последовательность, в которой назначается химиотерапия таксанами:
– вероятно, приводила к небольшим различиям (либо они полностью отсутствовали) в выживаемости или вероятности рецидива рака среди участников, получавших химиотерапию до операции;
– вероятно, приводила к небольшим различиям (или различия отсутствовали) в степени уменьшения размеров опухоли в ответ на химиотерапию среди участников, получавших лечение до операции;
– могла привести к небольшим различиям (либо они отсутствовали) в появлении побочных эффектов среди участников, получавших химиотерапию до операции; однако, предварительное применение таксанов приводило к снижению риска нейтропении (уменьшение числа лейкоцитов) у пациентов, получавших химиотерапию после операции. Побочными эффектами, которые были изучены, были нейтропения и нейротоксичность (повреждение нервных волокон);
– вероятно, приводила к небольшим различиям (либо они полностью отсутствовали) в соотношении участников, получавших химиотерапию после хирургического лечения рака молочной железы, и испытывавших задержки курса химиотерапии.
Во многих исследованиях не собирали или не сообщали данные о выживаемости, риске рецидива рака или общем благополучии (качестве жизни). В некоторых случаях в исследованиях не предоставили данных, которые могли быть использованы в этом обзоре, и мы ожидаем ответа от исследователей, проводивших испытания.
Насколько актуален данный обзор?
Авторы обзора искали исследования, опубликованные до февраля 2018 года.
Выбор лечения после операции – очень важный и ответственный момент. Операция является первичным лечением у многих женщин с ранней стадией рака молочной железы. После этого они получают курс адъювантной терапии в виде химиотерапии и гормонального лечения с целью полностью уничтожить все оставшиеся после операции раковые клетки.
.jpg)
Химиотерапия и гормональный препарат тамоксифен у женщин с ранней формой рака молочной железы может снизить риск развития рецидива и улучшить выживаемость через 15 лет.
В приведенном в этой статье исследовании участвовало очень большое число женщин, которые прошли разные методы после операции по поводу рака молочной железы.
Некоторые из них прошли курс химиотерапии, некоторые – курс тамоксифена, а некоторые – сочетание этих методов. Небольшое число пациенток прошло другой вид гормонального лечения – подавление функции яичников.
Химиотерапия и гормональное лечение представляют собой системные методы лечения, то есть они действуют на весь организм.
Группа исследователей проанализировала данные о 145000 женщин с ранними стадиями рака молочной железы. Все эти женщины участвовали в 194 рандомизированных исследованиях адъювантной химиотерапии и гормональной терапии, которые начались в 1995 году.
В рандомизированных исследованиях участники разделяются случайным образом на группы, которые отличаются применяемыми методами лечения. Все эти исследования отличались некоторыми параметрами, но среди них были и сходства.
Многие исследования включали:
Курс химиотерапии ЦМФ (циклофосфамид, метотрексат, фторурацил),
Химиотерапию с антрациклиновыми препаратами, например ФАЦ (фторурацил, адриамицин и циклофосфамид) или ФЭЦ (фторурацил, эпирубицин, циклофосфамид),
Подавление функции яичников (оперативным, медикаментозным путем или с помощью облучения).
Ни в одном из этих исследований не применялись: Таксаны (таксол, таксотер), Герцептин, Ралоксифен (эвиста), Ингибиторы ароматазы (аримидекс, фемара, аромазин).

Исследователи проанализировали все исследования, которые длились более месяца и сравнили результаты:
Курса применения одного химиопрепарата с курсом лечения без химиотерапии;
Курса применения двух и более химиопрепаратов с курсом лечения без химиотерапии;
Химиотерапию с антрациклиновыми препаратами и химиопрепаратами других групп с химиотерапией ЦМФ;
Курса тамоксифена с курсом лечения без тамоксифена;
Длительного курса тамоксифена и короткого курса;
Подавления функции яичников (у женщин старше 50 лет) с другими методами.
Исследователи собирали данные о пациентках в каждом исследовании:
Вид лечения, которое получала женщина,
Дата начала участия в исследовании,
Состояние менструального цикла,
Вовлеченность в процесс лимфоузлов,
Гормональный статус опухоли,
Был ли рецидив опухоли в том же месте,
Были ли отдаленные метастазы,
Был ли выявлен рак в другой молочной железе,
Был ли обнаружен другой тип опухоли,
РЕЗУЛЬТАТЫ: Исследователи пришли к выводу, что химиотерапия и гормональное лечение после операции у женщин с ранней стадией рака молочной железы были эффективны.
В частности: 6 месяцев химиотерапии антрациклинами улучшало степень выживаемости на 38 % у женщин моложе 50 лет и на 20 % у женщин в возрасте 50 – 69 лет по сравнению с теми, кто не получал химиотерапию. Данный положительный эффект химиотерапии не был связан с гормональным статусом опухоли, состоянием лимфоузлов, либо применением тамоксифена.
Химиотерапия антрациклинами была значительно эффективнее, чем курс ЦМФ.
У пациенток с гормонально-зависимым раком молочной железы пятилетний курс тамоксифена улучшал выживаемость на 31%, независимо от возраста пациентки или применения химиотерапии, по сравнению с теми, кто не получал тамоксифен при наличии показаний к нему.
Пятилетний прием тамоксифена у пациенток с гормонально-позитивным раком молочной железы значительно улучшал выживаемость и сокращал риск рецидивирования по сравнению с теми, кто принимал его всего один или два года.
Подавление функции яичников улучшало выживаемость только когда применялись другие системные методы лечения.
У пациенток моложе 50 лет с ранней стадией гормонально-зависимого рака молочной железы, получавших в течение 6 месяцев химиотерапию антрациклиновыми препаратами и тамоксифен в течение 5 лет выживаемость улучшалась на 50% по сравнению с теми пациентками, которые не получали химиотерапии или тамоксифен.
У пациенток в возрасте 50 – 69 лет с ранней стадией гормонально-зависимого рака молочной железы, получавших в течение 6 месяцев химиотерапию антрациклиновыми препаратами и тамоксифен в течение 5 лет выживаемость улучшалась на 40% по сравнению с теми пациентками, которые не получали химиотерапии или тамоксифен.
ЗАКЛЮЧЕНИЕ: исследователи пришли к выводу, что применение антрациклиновых химиопрепаратов в течение 6 месяцев и последующий прием тамоксифена в течение 5 лет улучшает выживаемость пациенток моложе 50 лет с ранней стадией гормонально-зависимого рака молочной железы на 50%. У женщин более старшего возраста этот показатель улучшался на 40%.
