Достигнутые в последние годы успехи в лечении рака молочной железы относятся главным образом к ранним формам заболевания. Почти у половины оперированных больных раньше или позже появляются отдаленные метастазы, местные или регионарные рецидивы. Если диссеминация в организме и перенос опухолевых клеток и их комплексов в отдаленные органы и ткани может происходить уже в самых ранних фазах развития новообразования (безусловно до начала лечения), то причина местных и регионарных рецидивов кроется в невозможности удаления во всех случаях опухолевых змболов, пораженных лимфангитом кожных и субфасциальных лимфатических сосудов, а также лимфатических узлов. Опухолевая инвазия регионарных лимфатических узлов, по данным Института онкологии, установлена у 58,3%, по наблюдениям МНИОИ им. П. А. Герцена, — у 54,8% поступивших в стационар больных (Баженова А. П., Барвитенко П. Г., 1978).
Таким образом, лечение больных раком молочной железы в меньшей степени связано с решением хирургической проблемы, а представляет собой сложные и пока еще твердо не установленные сочетания, комбинации и комплексы хирургических, лучевых, химиогормональных и в последнее время иммунологических воздействий.
Прежде чем перейти к конкретным обоснованиям методов лечения, остановимся на самих понятиях сочетанного, комбинированного и комплексного лечения.
Под сочетанным методом лечения в Институте онкологии, как и в других лечебных учреждениях (Петерсон Б. Е. и др., 1978), понимается применение нескольких одинаковых методов воздействия, взаимно усиливающих друг друга или действующих параллельно. Примером сочетанного лечения могут служить одновременное использование при предоперационном лучевом лечении гамма- и электронотерапии, а при лечении метастазов — нескольких химиотерапевтических препаратов разнонаправленного действия (например, алкилирующих агентов и антиметаболитов и пр.).
В понятие комбинированного лечения вкладывается представление о различных, но принципиально одинаковых по направленности методах, используемых как последовательно, так и одновременно. Примером комбинированного лечения могут быть предоперационная лучевая терапия и последующая мастэктомия, направленные на разрушение и удаление первичного очага и регионарных метастазов. Одновременное применение химио- и гормональной терапии при лечении больных с отдаленными метастазами, появившимися в разные сроки после мастэктомии, обусловлено комбинированным воздействием на обменные процессы в опухоли и организме, изменение которых на разных уровнях может препятствовать росту отдаленных метастазов.
Наконец, в последние годы появилось представление о комплексном лечении. Под ним, как справедливо отмечают Б. Е. Петерсон и соавт. (1978), понимают использование всех видов воздействия как на первичную опухоль и регионарные лимфатические узлы, так и на метастатические очаги в отдаленных органах. С этой целью могут быть предложены комплексы мероприятий, состоящие из местнорегионарных оперативно-лучевых воздействий (их сочетаний и комбинаций) и общих — химиогормональных и иммунотерапевтических методов.
Поскольку исторически сложилось мнение о главенствующем месте в лечении рака молочной железы оперативного удаления первичного очага и регионарных коллекторов, все остальные методы, входящие в комплексное лечение, принято называть дополнительными.
Нельзя не указать, что, по мнению авторитетных специалистов, приведенные группировки разных методов лечения в принципе лишены практического смысла, поскольку в каждом конкретном случае все равно перечисляются все компоненты, составляющие комбинацию или комплекс. В связи с тем что большинство специалистов все же пользуются указанными группировками, нередко вкладывая в них различные понятия, мы считаем целесообразным, чтобы практический врач имел представление не только об основополагающих принципах лечения, но и о существующей терминологии.

Рак молочной железы занимает первое место в структуре заболеваемости женщин, а частота его неуклонно растет особенно в пожилом возрасте. Статистические данные последних лет свидетельствуют о неуклонном, интенсивном росте заболеваемости и смертности от рака молочной железы в различных странах.
Усилия онкологов, направленные на борьбу с раком молочной железы, еще не дают ожидаемого эффекта. В связи с тем, что более 50 % больных злокачественными новообразованиями обращаются в медицинские учреждения при распространенном процессе, а общепринятые методы лечения недостаточно эффективны, в структуре смертности населения Казахстана, как впрочем, и в других странах мира, онкологические заболевания продолжают занимать второе место после сердечно-сосудистых заболеваний. Это обусловливает актуальность разработки новых и совершенствование существующих методов диагностики и лечения рака молочной железы.
Чрезвычайная сложность канцерогенеза и трудности ранней диагностики рака молочной железы ставят задачу первостепенной важности – выбор оптимального варианта лечения рака молочной железы у каждой больной. Это трудная задача, так как при лечении рака молочной железы применяются все современные методы онкологии: хирургический, лучевой, цитостатический, гормональный, иммунологический и различные способы коррекции функции отдельных органов и систем.
При раке молочной существуют различные варианты хирургического, комбинированного и комплексного лечения. Однако результаты современных методов лечения остаются неудовлетворительными. Пятилетняя относительная выживаемость колеблется в пределах 55–61 % (Березкин Д.П., Литягин В.П., Есенкулов А.Е.). Больные наиболее часто погибают в первые два года от генерализации процесса. Большие перспективы возлагаются на проведение послеоперационной химиотерапии (Павлов А.С., Доценко В.С., Давыдов М.И. и др.). При применении комплексной терапии, операция остается важнейшим звеном при лечении РМЖ.
Поиски путей улучшения выживаемости больных при РМЖ с учетом вышеизложенного приобретают научную значимость в области онкологии и являются актуальными на современном этапе. В программе лечения злокачественных новообразований (в частности молочной железы), в последние 10–15 лет наметились новые подходы. Связаны они в основном с пересмотром хирургических принципов в сторону уменьшения объема оперативного вмешательства без нарушения принципов радикализма.
Целью проведенной работы является улучшение ближайших и отдаленных результатов лечения больных РМЖ путем ступенчатого рассечения грудной мышцы и удаления малой грудной мышцы с фасцией, единым блоком, лимфодессекция подключичных, подлопаточных, подмышечных, сторожевых и не сторожевых лимфоузлов при экономном хирургическом вмешательстве, и в процессе комбинированного лечения. Лимфодессекция проводились на основании данных анализа наиболее распространенных путей лимфагенного метастазирования рака молочной железы после хирургического лечения различными методами и проведение химиолучевой терапии. После хирургического лечения различными методами и проведения химиолучевой терапии осуществлен анализ пятилетней выживаемости больных РМЖ.
На протяжении пяти лет мы наблюдали и анализировали результаты комбинированного лечения больных с локализованными формами РМЖ II А стадии, лечившихся в Талдыкорганском Областном онкологическом диспансере. Больные в количестве 77 человек были распределены на 2 группы:
1 группа (27 человек) – получившие широкую секторальную резекцию с лимфодисекцией аксилярной зоны.
При широкой секторальной резекции удаляются только лимфатические узлы аксилярной зоны. Однако некоторые авторы говорят о необходимости удаления не только лимфатических узлов, но и клетчатки подключичной зоны. Мы нисколько не умоляем достоинства данной методики, но считаем, что удаление клетчатки подключичной зоны представляется не выполнимым при сохранении малой грудной мышцы, так как лимфатические узлы настолько малы, что через мышцу их определить не удается.
Преимущество нашей методики заключается в свободном доступе к подключичной вене, и абластичной лимфодессекции с медиальных концов ключицы не разрывая лимфатический аппарат, тем самым не открывая путь к выходу опухолевых клеток в операционном поле, и не нарушая принцип абластичности.
2 группа (50 человек). Эти больные получили радикально -секторальную резекцию РМЖ со ступенчатым рассечением большой грудной мышцы, удалением единым блоком с фасцией и лимфодисекцией подключичных, подлопаточных, подмышечных зон.
Послеоперационное облучение было проведено всем больным 1 и 2 группы. В зону лучевого воздействия включалась молочная железа с подлежащей грудной стенкой и 2–3 см легочной ткани, СОД 20 гр.
Пациенты были распределены не только по стадиям заболевания, но и по видам рака молочной железы. Процентное соотношение видов РМЖ отражено в рис. 1.
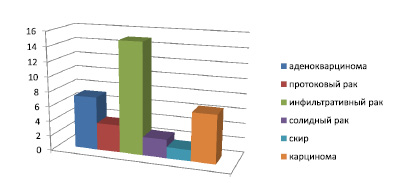
Рис. 1. Процентное соотношение видов РМЖ у экспериментальных больных
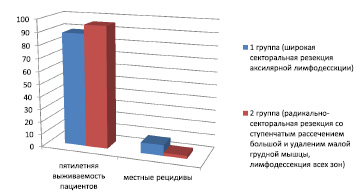
Рис. 2. Пятилетняя выживаемость больных после хирургического лечения рака молочной железы – I–II стадии
Из рис. 1 один видно, что у 7,2 % пациентов был поставлен диагноз аденокварцинома; у 3,7 % – протоковый рак; инфильтративный рак у 15 % пациентов; солидный рак – у 2,5 % пациентов; скир – у 1,5 % и кварцинома – у 6,5 % пациентов с раком молочной железы.
К первой группе, были отнесены больные, к которым был применен вид хирургического лечения под названием широкая секторальная резекция аксилярной лимфодессекции. Таких больных было 27 человек (1стадия РМЖ – 12 человек; 2 стадия РМЖ – 15 человек). Пятилетняя выживаемость у 24 женщин из 27.
Ко второй группе был применен метод под названием радикально-секторальная резекция со ступенчатым рассечением и удалением малой грудной мышцы, лимфодессекцией всех зон. Таких больных было 50 человек (1 стадия РМЖ – 20 человек; 2 стадия РМЖ – 30 человек). Пятилетняя выживаемость у 48 женщин.
Местные рецидивы у данной категории пациентов незначительные.
Результаты лечения РМЖ отражены в рис. 2.
Как видно из рис. 2 пятилетняя выживаемость в 1 группе I–II А стадии составляет 88,7 %. Местные рецидивы в послеоперационный период проявились у 8,4 % пациентов с РМЖ.
Во второй группе I-II А стадии пятилетняя выживаемость составляет 95,6 %. Местные рецидивы в послеоперационный период проявились у 2,4 % пациентов с РМЖ.
Общая пятилетняя выживаемость составила 90,2 %.
Таким образом, мы видим преимущество ступенчатого рассечения большой грудной мышцы, в стадии выживаемости пациентов и проявлении местных рецидивов в послеоперационный период.
Втрое преимущество заключается в том, что в данном виде хирургического лечения осуществляется свободный доступ к подключичной вене и абластичной лимфодессекции всех зон.
Мы считаем, что именно этот технический прием и обусловил улучшение результатов лечения у наших пациентов с различными стадиями рака молочной железы.
Апробация изложенных в статье положений проводилась на научно-практических и научно-методических республиканских и международных конференциях, посвященных вопросам онкологии. Статья является логическим продолжением опубликованных статей в международных научных журналах [3] и сборниках международных и республиканских научных конференций [1; 2].

Финские ученые предложили комбинированное лечение рака груди, направленное против онкопротеина MYC и усиленную анти-PD1 иммунотерапией.
Лечение, нацеленное на MYC, индуцирует самоуничтожение опухолевых клеток, а иммунотерапия дополнительно подстегивает иммунную систему, чтобы обеспечить выраженный и продолжительный терапевтический эффект.
Результаты проведенных опытов на мышах открывают путь для создания новых схем комбинированной терапии, которые могут превосходить все современные протоколы.
MYC — это ген, связанный с развитием злокачественных опухолей.
Повышенная экспрессия этого гена отмечается более чем в 40% случаев рака молочной железы.
Хотя MYC программирует клетки рака на создание новых макромолекул (анаболический метаболизм), он же обуславливает метаболическую уязвимость, делая их более чувствительными к запрограммированной клеточной смерти — апоптозу.
Руководитель исследования доктор Юха Клефстром (Juha Klefstrom) из Хельсинкского университета долгое время работал над использованием этого сенсибилизирующего к апоптозу эффекта MYC в борьбе против рака.
Ученые начали поиски подходящей комбинации с венетоклакса, добавив к нему метформин для усиления апоптоз-индуцирующего действия.
Напомним, что в США препарат венетоклакс (Venclexta) одобрен для лечения некоторых лейкозов, но не для лечения рака молочной железы.
Новая комбинация остановит рак груди на поздней стадии?
Но ликование после первых успешных экспериментов продолжалось недолго. Вскоре исследователи обнаружили, что комбинация метформин + венетоклакс дает краткосрочные результаты. Как только терапию прекращают, опухоли у мышей снова увеличиваются. Разгадка стала неприятным сюрпризом. Оказалось, что изначально опухоли были обильно инфильтрированы лимфоцитами, которые пытались сдерживать болезнь. Однако после инновационной терапии почти все лимфоциты исчезли, а оставшиеся клетки-киллеры экспрессировали PD-1, маркер истощения иммунных клеток.
Чтобы помочь иммунной системе бороться с опухолью, исследователи предложили дополнительный компонент для новой терапии — анти-PD1 иммунотерапию.
На первом этапе они поражают опухоль с помощью комбинации препаратов, вызывающих апоптоз, метформина и венетоклакса. Это позволяет уменьшить размеры новообразования и активизировать Т-киллеры. После того как первичные опухоли были удалены хирургическим путем, мышей затем лечили тройной комбинацией: метформином, венетоклаксом и моноклональными антителами, нацеленными на PD-1 (ингибиторы иммунных контрольных точек).
Такая терапия должна продолжаться длительно, а при поздних стадиях заболевания — максимально долго, пока опухоль продолжает отвечать на препараты.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
Бесплатная консультация Вконтакте. ЖМИ на ссылку!

Комбинированные методы лечения рака груди (молочной железы)
Комбинированные методы лечения рака груди (молочной железы)
Лечение рака молочной железы — сложная и окончательно не решенная проблема. Комбинированное лечение применяют при наличии первичной опухоли небольших размеров с одиночными метастазами в аксиллярной области или более крупной опухоли без региональных метастазов.
Перед любым применением препаратов консультация с ВРАЧОМ обязательная! Основным компонентом комбинированного и комплексного лечения является хирургический метод. Операцию при раке молочной железы начинают с проведения разреза кожи на расстоянии не менее 4—5 см от пальпируемых краев опухоли. В настоящее время чаще применяют поперечный овальный разрез кожи по Ченну — Кохеру, который удобен почти при всех локализациях опухоли в молочной железе и позволяет свободно, без натяжения ушить рану. Лечебная тактика при раке молочной железы должна быть строго индивидуальной. В основе выбора метода лечения лежит стадия опухолевого процесса. При лечении больных с неинфильтрирующим внутрипротоковым и внутридольковым раком (in situ) или болезнью Педжета соска без определяемой опухоли используют только хирургический метод. В отсутствие мультицентрического роста производят радикальную резекцию молочной железы. При множественности зачатков carcinoma in situ показана подкожная мастэктомия с удалением нижней группы подмышечных лимфатических узлов. У подавляющего большинства больных раком молочной железы I стадии проводят хирургическое лечение. У некоторых больных опухоль расположена в наружных отделах железы, у которых может быть выполнено комбинированное лечение, состоящее из органосохраняюшей операции—радикальной резекции железы, с последующей лучевой терапией. Радикальная резекция при I стадии рака молочной железы с удалением малой грудной мышцы и клетчатки подключичной, подмышечной и подлопаточной области и последующей лучевой терапией все еще находится в стадии научного исследования. Если более 20—30 лет назад экономные операции производили крайне редко, то после накопления значительного опыта, свидетельствующего о том, что при экономных вмешательствах прогноз не хуже, чем при операции Холстеда, их стали выполнять значительно чаще в плановом порядке. Пятилетняя выживаемость после экономных операций у больных не только с I, но и IIa стадией заболевания колеблется, по данным разных авторов, от 70 до 98% [Киселева Е. С. и др., 1982; Taylor H. et al., 1971; Mustakallio S„ 1972; Dana M„ 1978; Cole J., 1985; Tobias J. С., 1986]. Показанием к выполнению радикальной резекции являются опухоль небольших размеров, не более 2—3 см в диаметре, т. е. не только I, но и IIa стадии процесса, расположение ее в наружных отделах молочной железы, отсутствие определяемых до или во время операции (гистологически) метастазов в подмышечных лимфатических узлах. При радикальной резекции иссекают не менее ‘/4 или ‘/з молочной железы, отступя 4—5 см от пальпируемого края опухоли. Удаление подключичной и подмышечной клетчатки производят так же, как при операции Пэйти. Экономные операции противопоказаны при инвазивном дольковом и инвазивном протоковом раке с преобладанием внутрипротокового компонента, так как первый часто бывает мультицентричен, а при втором трудно определить границы опухоли. Через 2—3 нед после экономной операции проводят дистанционную гамма-терапию, осуществляя воздействие на оставшуюся часть молочной железы с двух полей по 2 Гр на поле/ ежедневно, суммарная доза 45—50 Гр. Выполнение экономных операций возможно в условиях крупных онкологических учреждений, в которых работают высококвалифицированные врачи и имеется возможность провести учет морфологических прогностических критериев, а также осуществить дальнейшее динамическое наблюдение за больными в случае необходимости своевременно выполнить дополнительное лечение. У большинства больных раком молочной железы Па стадии проводят только хирургическое лечение—модифицированную радикальную мастэктомию по Пэйти—Дисону или радикальную мастэктомию по Холстеду. Отдельным больным, у которых имеется первичный очаг небольших размеров, до 3 см в диаметре, расположенный в латеральной части молочной железы, и отсутствует дольковый и внутрипротоковый рак, показана радикальная резекция с последующей лучевой терапией (традиционное облучение по 2 Гр до суммарной дозы 45—50 Гр). Помимо “радикальной” резекции при Па, а также I стадии рака молочной железы может быть произведена мастэктомия с подмышечной лимфаденэктомией, дополненная дистанционной гамма-терапией, предусматривающей воздействие на все зоны регионарного лимфооттока в суммарной дозе 44—46 Гр за 4—5 нед. Опыт МНИОИ им. П. А. Герцена [Киселева Е. С., 1982] свидетельствует о том, что из 323 больных раком молочной железы I и Па стадии при 5-летнем наблюдении локально-регионарные рецидивы опухолевого процесса после экономных операций и лучевой терапии отмечены лишь у 3%, а отдаленные—у 9%. Таким образом, сохранные операции с подмышечной лимфаденэктомией и дополнительной лучевой терапией могут быть методом выбора при лечении рака в ранних стадиях. При расположении опухоли в медиальных отделах или центральной части молочной железы выполняют расширенную подмышечно-грудинную мастэктомию или проводят комбинированное лечение (радикальная мастэктомия и лучевая терапия). Расширенная операция предусматривает удаление одним блоком молочной железы вместе с грудными мышцами, подключич-но-подмышечной и подлопаточной клетчаткой, участком грудной стенки с парастернальными лимфатическими узлами и внутри-грудными сосудами. Вмешательство осуществляют экстраплев-рально. Дефект грудной стенки закрывают частью большой грудной мышцы, зубчатыми мышцами или широчайшей мышцей спины. Травматичность подобной операции может быть уменьшена путем применения щадящего доступа к парастернальному лимфатическому коллектору. Для этого после радикальной мастэктомии в первом межреберье выделяют и перевязывают внутригрудные артерию и вену, пересекают II—III и IV ребра у края грудины, приподнимают крючками медиальные края переусеченных реберных хрящей, экстраплеврально иссекают внутригрудные сосуды с цепочкой лимфатических узлов, после чего пересеченные ребра фиксируют к грудине [Баженова А. П., 1963; Dahl-Iversen E. et al., 1963]. Такой вариант операции называют “радикальная мастэктомия с удалением парастернальных лимфатических узлов”. Радикальная мастэктомия с парастернальной лимфаденэктомией может быть выполнена при медиальной локализации опухоли в молочной железе у больных с I, IIа и IIб стадиями рака. При выявлении в процессе мастэктомии множественных подмышечных метастазов (IIIb стадия) иссечение парастернальных лимфатических узлов нецелесообразно, так как не улучшает прогноз у таких больных. Целесообразность выполнения расширенной мастэктомии обусловлена высокой частотой метастатического поражения парастернальных лимфатических узлов, которое при медиальной и центральной локализации опухоли в молочной железе, без учета стадии рака, выявляют, по данным ряда авторов, у каждой третьей больной [Холдин С. А., Дымарскbй Л. Ю., 1975; Urban J., 1963], по данным МНИОИ им. П. А. Герцена, этот показатель ниже 18%, а изолированное поражение парастернальных узлов диагностировано у 7,3% больных. Если при IIа стадии заболевания с медиальным расположением опухоли в молочной железе расширенную мастэктомию по каким-либо причинам не производят, то в таких случаях целесообразно провести послеоперационное лучевое воздействие на парастернальную область—зону первого регионарного лимфатического барьера, а также на надключичные лимфатические узлы, которые в такой ситуации являются вторым лимфатическим барьером. Доза облучения 40—15 Гр за 4—4,5 нед. При IIб стадии рака молочной железы целесообразно проводить предоперационную лучевую терапию и радикальную мастэктомию по Холстеду или мастэктомию по Пэйти. Модифицированная радикальная мастэктомия по Пэйти—Дисону отличается от мастэктомии по Холстеду тем, что при ней сохраняется большая грудная мышца. Основанием для ее сохранения явилось то обстоятельство, что эту мышцу редко прорастает опухоль в начальных стадиях заболевания, чаще инвазия мышцы наблюдается при распространенной форме рака. При сохранении мышцы мастэктомия менее травматична, ее выполняют с меньшей кровопотерей. Сохранение мышцы способствует лучшему заживлению раны, приводит к лучшим косметическим и функциональным результатам. Показанием к операции по Пэйти—Дисону являются не только начальная стадия рака, но и пожилой возраст больных, тяжелые сопутствующие заболевания, а также двусторонний, синхронный рак молочных желез, когда необходимо выполнить одномоментную двустороннюю радикальную мастэктомию с меньшей травмой для больного. Посредством лучевой терапии, которую проводят перед оперативным вмешательством, добиваются снижения биологического потенциала опухоли за счет гибели наиболее анаплазированных клеток, которые, как правило, наиболее ранимы. Гибель анаплазированных, а также хорошо оксигенированных клеток обеспечивает снижение степени злокачественности опухоли. В связи с этим отрыв клеток во время операции и попадание их в лимфатические пути и кровеносные сосуды становится менее опасным в плане имплантации и дальнейшего развития рецидива и метастазов. В задачи предоперационного облучения входят поврежден не до полной регрессии микродиссеминантов и микрометастазоа рака в зонах возможного субклинического распространения, девитализация наименее дифференцированных, наиболее аyаплазированных и агрессивных опухолевых клеток и инактивация радиорезистентных опухолевых клеток. Для решения этих задач достаточными являются дозы 40—46 Гр, подведенные за 4—5 нед. В настоящее время изучается возможность облучения укрупненными фракциями с соответствующим уменьшением продолжительности лечения. С учетом биологической эффективности ионизирующего излучения предложено несколько вариантов облучения укрупненными фракциями: 1) однократное облучение молочной железы и подмышечного лимфогенного коллектора в дозе 10 Гр; 2) молочную железу облучают по 6 Гр через день, суммарная доза 24 Гр за четыре фракции. Доза на подмышечную область 18 Гр за три фракции; 3) молочную железу облучают по 5 Гр, ежедневно суммарная доза 25 Гр, подмышечно-подключичную зону — по 4 Гр ежедневно за шесть фракций, суммарная доза 24 Гр. В отличие от других схем ежедневная доза на молочную железу и подмышечно-подключичную зону подводится за 2 раза с интервалом между облучением 4—5 ч; 4) молочную железу и все зоны регионарного метастазирования облучают по 4 Гр ежедневно до суммарной дозы 20 Гр; 5) методика облучения та же, что и в варианте № 4, не дополнительно опухоль в молочной железе облучают в тот же день пучком электронов в дозе 2 Гр. При применении крупных фракций облучения суммарные дозы по биологическому эффекту соответствуют 44—46 Гр классического фракционирования. Использование крупных фракций предусматривает уменьшение интервала между лучевой терапией и оперативным вмешательством на молочной железе до 24— 72 ч. Преимущества предоперационного облучения крупными фракциями заключаются в уменьшении продолжительности облучения и интервала между облучением и операцией, снижении частоты рецидивов и отдаленных метастазов, повышении 5-летней выживаемости больных, особенно при III6 стадии заболевания. По данным Г. В. Голдобенко и соавт. (1979), при использовании методики укрупненного фракционирования дозы значительно уменьшается продолжительность радикального лечения. В наблюдениях В. С. Даценко (1984) над большой группой больных (1362 человека) показано преимущество крупнофракционного метода облучения по сравнению с обычным на основании данных о 10-летней выживаемости больных при всех стадиях заболевания. Так, при крупном фракционировании более 10 лет жили 61,7% больных раком 116 стадии, а при обычном фракционировании—53,5%. У больных с заболеванием IIIa стадии эти показатели составляли соответственно 58 и 53,1%, при IIIb — 41,3 и 31,8%. Сравнительные данные об эффективности пред- и послеоперационного облучения в комбинированном лечении операбельного рака молочной железы представлены во многих работах онкологических учреждений. По данным МНИОИ им. П.А.Герцена, местные рецидивы при предоперационном облучении возникали значительно реже, чем при послеоперационном—соответственно у 3,3 и 10,5% больных. Пятилетняя выживаемость больных при предоперационном облучении была выше, чем при послеоперационном: во 116 стадии соответственно 81,2 и 68,9%, в Ilia 67,3 и 60%, в 1116—31,4 и 25%. В настоящее время наиболее часто используют следующую методику предоперационной гамма-терапии: ежедневно облучают всю молочную железу и зоны регионарного лимфооттока. Используют четыре поля: два тангенциальных на молочную железу (внутреннее и наружное), одно фигурное на над-, подключичную и подмышечную области и парастернальное. Разовая поглощенная доза в каждой зоне 2 Гр, сумарная доза 40—45 Гр .за 4—5 нед. Сложная конфигурация облучаемых поверхностей при раке молочной железы требует тщательного выбора полей облучения, точного соблюдения границ, адекватного направления пучка, соблюдения ритма и доз облучения. В связи с этим до начала лучевого лечения необходимо сделать эскиз поперечного среза на уровне четвертого межреберья — ТVIII и разметку полей. Разметку полей производят в строго горизонтальном положении больной на спине с отведенной под углом 90° верхней конечностью, согнутой в локтевом суставе. Наносят четыре основные линии, определяющие границы полей: 1) по средней линии грудины от яремной вырезки до мечевидного отростка; 2) по верхнему краю II ребра до нижнего края подмышечной впадины; 3) по средней подкрыльцовой линии; 4) на 2 см ниже маммарной складки (рис. 22). Молочную железу облучают с двух тангенциальных полей. Размеры их соответствуют размерам молочной железы, а углы наклонов определяют по срезу. Границы полей: внутренняя — на 5 см кнаружи от средней линии, наружная — средняя подмышечная линия, верхняя — верхний край II ребра (или нижняя граница надключично-подмышечного поля), нижняя — на 1—2 см ниже маммарной складки. Внутреннее и наружное поле разделены срединно-ключичной линией. Для облучения регионарных зон применяют надключично-подключично — подмышечное поле с наклоном пучка под углом 10° от горизонтальной и сагиттальной плоскостей. Границы: внутренняя— на 1 см кнаружи от средней линии выше тиреокриковидного хряща, наружная — верхняя часть плеча при отведенной руке, нижняя — верхний край II ребра с включением первого межреберья, верхняя — кривизна плеча с экранированием головки плеча, вся надключичная область до середины шеи, верхушка подмышечной области. Парастернальное поле: верхняя граница — нижний край надключично — подмышечного поля, нижняя — область мечевидного отростка, внутренняя — средняя линия грудины, наружная — на 4—5 см кнаружи от средней линии грудины. При использовании классического режима фракционирования дозы из-за длительного облучения и послелучевого периода, необходимого для стихания местных лучевых реакций и восстановления общего состояния больных, увеличивается опасность прогрессирования процесса, так как откладывается выполнение основного этапа лечения — хирургического вмешательства. В связи с этим в последние годы в литературе появились сообщения о применении других методик предоперационной лучевой терапии. Если при предполагаемой I или Па стадии лечение начато с мастэктомии, а при гистологическом исследовании операционного препарата выявляют метастазы в одном или двух регионарных лимфатических узлах, что соответствует 116 стадии процесса (Tl, 2N1MO), а при трех и более пораженных узлах — IIIб стадии, то в послеоперационном периоде следует дополнительно проводить гамма-терапию. Методика и принципы послеоперационной гамма-терапии и разметка полей облучения аналогичны таковым при предоперационном облучении. Грудную стенку облучают лишь в случаях сомнительной абластики во время операции и при множественных зачатках опухоли. Облучение тангенциальное, проводят его ежедневно. Разовая очаговая доза 2 Гр, в неделю 10Гр, суммарная доза 40—44 Гр. Послеоперационное облучение грудной стенки осуществляют по стихании воспалительных явлений примерно через 2—3 нед после операции, так как облучение при наличии воспалительных явлений чревато лучевыми повреждениями. detector |
