Хорошо исследованные соединения, активно применяющиеся в косметике и солнцезащитных средствах, продемонстрировали негативные эффекты на культуре клеток с эстрогеновыми рецепторами
При использовании нового подхода по изучению эффектов двух веществ, широко применяемых в косметике и солнцезащитных средствах, были обнаружены токсические свойства этих агентов. В достаточно низких концентрациях они могут повреждать ДНК в клетках молочной железы, в то же время они не наносят никакого урона клеткам без эстрогеновых рецепторов.
Работа опубликована в журнале Environmental Health Perspectives. В описанных экспериментах обнаружен новый механизм работы эстрогенов и ксеноэстрогенов (встречаемых в природе веществ, действие которых на человека схоже с эстрогенами), в том числе канцерогенное в контексте рака молочной железы действие.
Авторы исследования сообщают, что использованные в работе методы обладают значительно большей чувствительностью, чем стандартные методики, а также тот факт, что обычно FDA оценивает токсичность этих соединений на линиях клеток, не имеющих эстрогеновых рецепторов.
Одно из исследованных веществ, бензофенон-3 (BP-3), также известное как оксибензон, является ультрафиолетовым фильтром. Другое соединение, пропилпарабен, используется в качестве антимикробного консерванта в косметике и других средствах личной гигиены. Эти вещества способны наносить повреждение ДНК клеткам с эстрогеновыми рецепторами в количестве 1/10 до 1/30 от минимальных значений концентраций, наносящих вред обычным клеткам.
Это исследование носит предварительный характер и требует дополнительной верификации данных. Несмотря на полученные данные, бензофенон остается крайне важным компонентом солнцезащитных средств, которое эффективно предотвращает воздействие ультрафиолетовой радиации. Но опубликованные данные могут оказаться принципиально важными для людей, находящися в группе высокого онкологического риска по заболеваемости раком молочной железы.
Конкурирующие интересы: авторы заявили, что конкурирующих интересов не существует.
Задуманные и разработанные эксперименты: JC GA SK. Выполняли эксперименты: JC. Проанализированы данные: JC GA SK. Используемые реагенты / материалы / инструменты анализа: JC GA SK. Написал документ: JC GA SK.
Рак молочной железы, продукт многочисленных редких мутационных событий, которые происходят в течение длительного периода времени, представляет многочисленные проблемы исследователям, заинтересованным в изучении трансформации из нормального грудного эпителия в злокачественные опухоли с использованием традиционных лабораторных методов, особенно в отношении характеристик переходных и пред-злокачественных состояний , Динамическое вычислительное моделирование может дать представление об этой патофизиологической динамике, и поэтому мы используем ранее проверенную на основе агентов вычислительную модель эпителия молочной железы (DEABM) для исследования вероятностных механизмов, с помощью которых нормальные популяции протоковых клеток могли бы трансформироваться в состояния, воспроизводящие особенности как до злокачественных поражений молочной железы, так и разнообразных подтипов рака молочной железы.
DEABM состоит из имитированных клеточных популяций, управляемых алгоритмами на основе принятых и ранее опубликованных клеточных механизмов. Клетки реагируют на гормоны, подвергаются митозу, апоптозу и клеточной дифференцировке. Наследственные мутации до 12 генов, заметно замеченных в раке молочной железы, приобретаются с помощью вероятностного механизма. 3000 симуляций 40-летнего периода менструального цикла выполнялись в группах с диким типом (WT) и BRCA1-мутантом. Моделирование анализировалось путем развития гиперпластических состояний, частоты возникновения злокачественных новообразований, гормонального рецептора и статуса HER-2, частоты мутации для конкретных генов и были ли мутации ранними событиями в канцерогенезе.
Опасное заболевание всегда начинается с одной клетки. Канцерогенез – это многоступенчатый процесс формирования опухолевого новообразования, возникающего под действием внутренних и внешних факторов: кажется, что рак – это неожиданная болезнь, но в большинстве случаев до выявления типичных признаков у человека имеются малозаметные симптомы, указывающие на риск малигнизации.
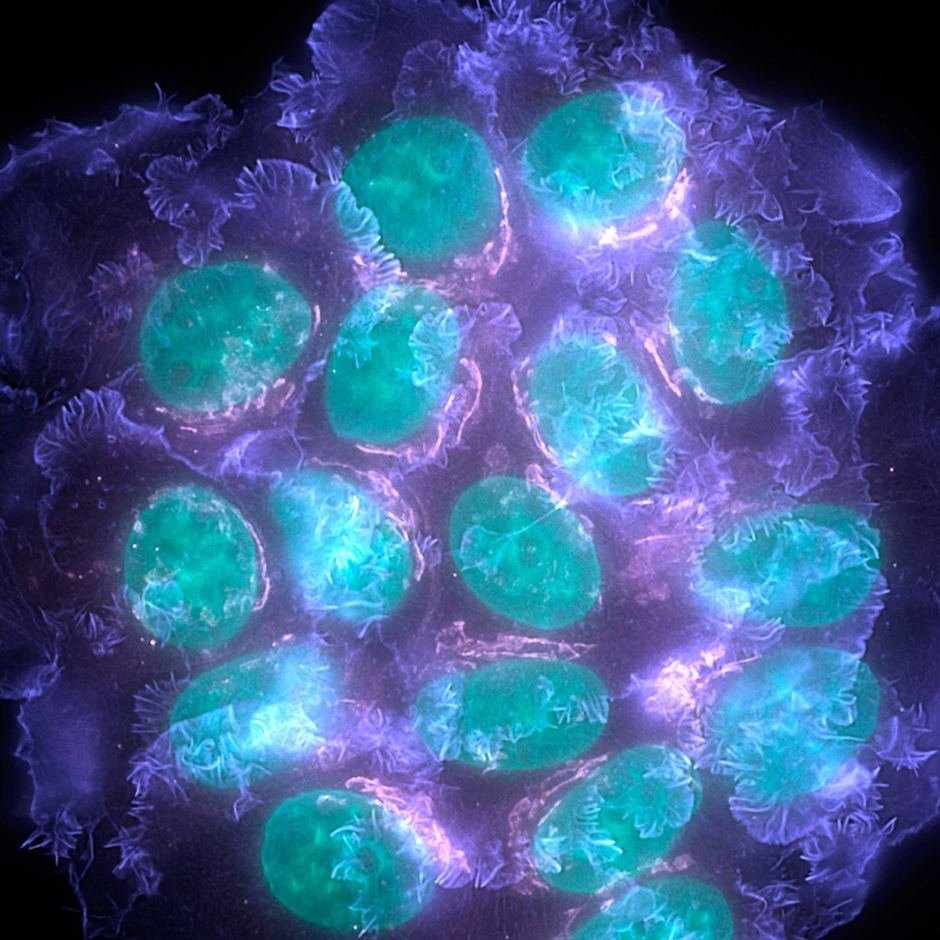
Из скопления мутантных клеток формируется опухоль
Канцерогенез – основные виды
Онкологический диагноз способен напугать любого человека. Но канцерогенез относится к медленным процессам: злокачественное перерождение в тканях и органах происходит на протяжении нескольких лет. При внимательном отношении к собственному организму и регулярных визитах к доктору можно своевременно обнаружить серьезные проблемы. В большинстве случаев на первом этапе болезни возникают предраковые изменения, которые можно и нужно заметить. К значимым факторам, запускающим рак, относятся различные внешние и внутренние воздействия. В зависимости от причин выделяют следующие варианты канцерогенеза:
- Наследственный (генетически обусловленный);
- Физический (ультрафиолет, тепловое воздействие);
- Химический (канцерогены химического происхождения);
- Гормональный (эндокринные факторы);
- Вирусный (микробное инфицирование).
Канцерогенез в тотальном большинстве случаев является многофакторным процессом – рак развивается на фоне длительного и негативного влияния нескольких факторов при снижении противоопухолевой защиты. Зачастую сложно выделить основную причину, запустившую злокачественное перерождение в тканях. Важно понимать – каков бы ни был канцерогенный фактор, гораздо важнее состояние иммунного надзора и наличие защитных механизмов, препятствующих раку.
Процесс злокачественного перерождения
Это похоже на цепную реакцию: активация онкогенов стимулирует формирование онкобелков, которые провоцируют точечные мутации в клетках. Генные дефекты нарушают внутриклеточные процессы, став основой для появления мутантных клеток. Если на этом этапе не сработает противоопухолевый иммунитет (разрушение чужеродной структуры), то у зачатка опухоли появится шанс на выживание. Именно с этого момента начинается рост злокачественного новообразования – из одной клетки постепенно и медленно создается раковая опухоль. Канцерогенный процесс может быть быстрым (за 1-3 года) или медленным (десятилетия), но – главное, что нужно знать: рак неумолим, скрытен и агрессивен.
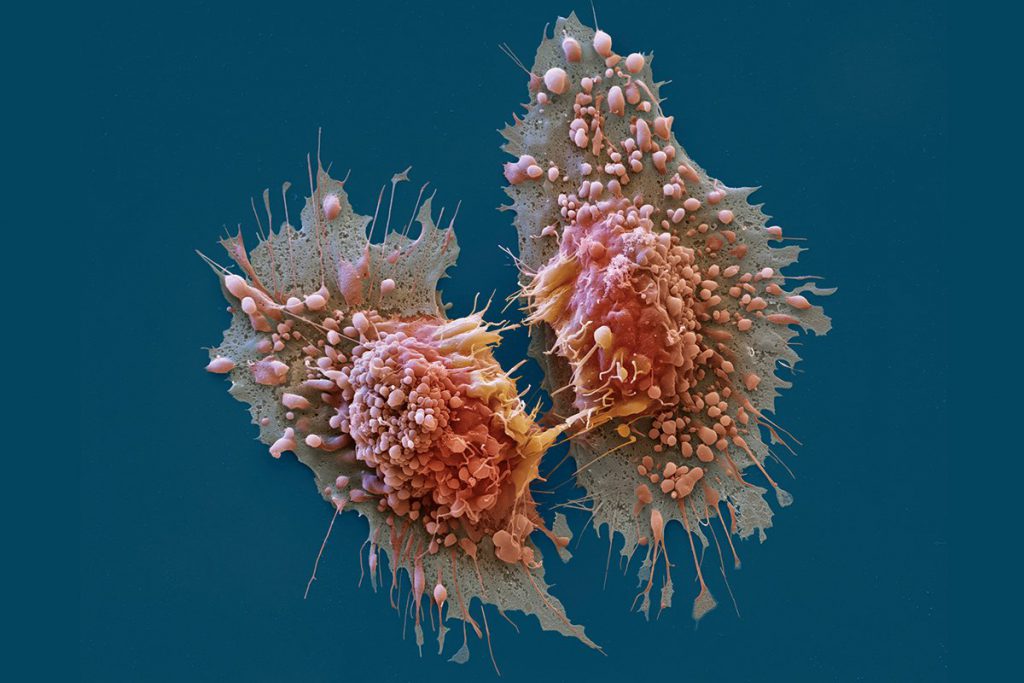
Канцерогенный процесс непрерывен и неумолим
Предраковые признаки
Большинство людей даже не допускают мысли, что у них может быть рак, поэтому для них диагноз, как холодный душ: неожиданно и страшно. Выявление злокачественной опухоли, как приговор, гарантирующий негативный исход. Но – канцерогенез является многоступенчатым процессом, поэтому первые признаки будущей онкологии можно выявить на полпути к грозному диагнозу. Надо всего лишь обращать внимание на собственное здоровье (например, женщинам правильно оценивать вагинальное кровотечение или замечать нерегулярность цикла, мужчинам – реагировать на кровь в кале или на нарушение мочеиспускания). Вовремя выявив начавшийся канцерогенез, можно предотвратить печальный исход болезни – радикальная терапия при предраковой неоплазии и 1 стадии онкологии гарантирует полное избавление от злокачественной опухоли.
Имеется много теорий, объясняющих механизм канцерогенеза. Здесь мы рассмотрим некоторые из них. Согласно одной из теорий «естественная история роста» начинается от первой гипотетической клетки и завершается гибелью организма после 40 удвоений объема.
При этом опухолевая масса достигает 1 кг (предполагается, что опухоль растет с постоянной скоростью) и более 3/4 ее развития происходит на доклинической стадии <не определяется).
Не более 1/4 всей жизни раковой клетки разворачивается перед глазами больного и врача, Этим подтверждается первичная распространенность опухолевого процесса. Однако скорость роста опухолей зависит от различных факторов и у разных пациентов может быть различной — от бурного роста (1,75 года) до медленного (18,35 года).
Современная теория канцерогенеза
Под воздействием различных физических, химических, вирусных агентов происходит повреждение ДНК клетки и обычные клетки превращаются в онкогены, которые являются стимуляторами роста других клеток.
Например, клетки рака молочной железы продуцируют избыток стимулирующих факторов роста, которые подстегивают рост опухоли через определенные рецепторы. Однако для развития рака недостаточно повышенного выделения стимулирующих факторов. В ядре каждой клетки имеются регулирующие белки, которые могут останавливать безудержный рост. Это так называемые супрессорные гены.
Мутация или даже небольшое изменение формы молекулы этого гена приводит к утрате супрессорных свойств и стимуляции опухолевого процесса.
В настоящее время установлено: прежде чем завершится процесс становления рака, должно произойти множество сложных повреждений и изменений генетического аппарата, которые не успевают ликвидировать восстановительные клеточные механизмы.
Считается, что в среднем для превращения нормальной клетки в опухолевую требуется от трех до семи независимых случайных событий. Эстрогены принимают участие в канцерогенезе и являются обязательным элементом развития рака молочной железы, они обеспечивают развитие и рост поврежденной клетки.
Выявление рецепторов эстрогенов и прогестерона на поверхностной мембране клеток рака молочной железы открыло большие перспективы для гормонотерапии.
Таким образом, в настоящее время общепризнанной является модель многоступенчатого канцерогенеза. Возможно, уже в скором времени знания по генетическим, биохимическим и другим аспектам проблемы рака груди будут широко использоваться при лечении этого заболевания.
В группу химических канцерогенов включены и гормоны.
По химической структуре гормоны подразделяются на несколько классов.
Их вовлечение в процессы канцерогенеза не одинаково, что объясняется изначальными различиями отдельных гормонов в обеспечении нормальных физиологических функций.
Гормонозависимые, гормонообразующие и гормоночувствительные опухоли давно известны в практике онкологии. Если развитие опухоли требует действия гормонов или может быть заторможено гормонами, она называется гормонозависимой или гормоночувствительной. Некоторые опухоли развиваются при онкогенной трансформации ткани, претерпевающей гормонозависимую хроническую гиперплазию.
Механизмы гормонального канцерогенеза
С точки зрения понимания механизмов гормонального канцерогенеза (ГК) стероиды, и прежде всего эстрогены, привлекли наибольшее внимание. Интерес к эстрогенам объясняется также широким применением их в качестве лекарственных препаратов и несомненным стимулирующим влиянием этих гормонов на процесс клеточного размножения во многих тканях.
Накопившиеся данные позволили сформировать современную концепцию механизма ГК. Она в кратком виде сводится к следующему. Эндогенные и экзогенные эстрогены способствуют развитию рака, стимулируя размножение нормальных эпителиальных клеток-мишеней благодаря наличию в них рецепторов эстрогенов.
Увеличение числа клеточных делений повышает вероятность случайных генетических повреждений и при определенном стечении обстоятельств возникающие мутации приводят к формированию условий для инициации и последующего прогрессирования опухолевого процесса, что, в свою очередь, дополнительно поддерживается сохраняющейся избыточной гормональной стимуляцией.
В этом процессе участвуют также онкогены и гены-супрессоры. Среди последних важная роль принадлежит р53 и BRCA1, поскольку эстрогены являются ингибиторами апоптоза.
В целом, в соответствии с этой концепцией формула механизма гормонального канцерогенеза относительно проста: происходит гормонально-стимулированное усиление пролиферации в сочетании с последующим случайным повреждением генов. Вполне очевидно, что в отличие, например, от химического канцерогенеза в данном случае элемент случайности в развитии рака играет довольно значительную роль.
Важным практическим аспектом такой концепции является установленный факт возможности предупреждения (или, по крайней мере, замедления) развития гормонозависимых опухолей у человека путем ограничения эстрогенной стимуляции пролиферации с помощью антиэстрогенов (тамоксифена).
Более того, антиэстрогенные лекарства, а также овариэктомия могут тормозить рост эстрогензависимых опухолей молочной железы, а беременность — стимулировать рост прогестерончувствительных клеточных клонов.
Выше уже говорилось, что гормоны относятся к негенотоксическим (эпигенетическим) канцерогенам. В то же время проведенные в последние годы исследования показали, что изложенный выше промоторный механизм ГК не является единственно возможным и существует также генотоксические, связанный с действием метаболитов эстрогенов.
Действительно, эстрогены подвергаются в организме метаболическим реакциям. Образующиеся при этом метаболиты, в частности катехолестрогены и их производные, могут оказывать генотоксическое действие, т.е. способны ковалентно связывать ДНК с образованием аддуктов. Возникающие в результате этого мутации индуцируют неопластическую трансформацию в эстрогензависимых тканях.
Помимо накопления в тканях катехолэстрогенов и их метаболитов, не меньшее значение для процесса гормонального канцерогенеза имеет повышение внутритканевой концентрации эстрогенов за счет их эндогенного (внегонадного) образования при участии фермента ароматазы. Такая способность к эстрогенобразованию присуща изначально молочной железе, а в эндометрии она приобретается в процессе малигнизации.
Считается, что экстрагонадные эстрогены, образующиеся в ткани-мишени, имеют больше шансов индуцировать генотоксические повреждения, чем эстрогены, циркулирующие в крови.
Таким образом, в механизмах канцерогенного действия эстрогенов присутствует два представленных в разной степени компонента — промоторный и генотоксический.
Промоторный, или физиологический, сводится к длительной гормональной стимуляции клеточной пролиферации в органе-мишени и генотоксический — возникновение мутаций под влиянием образующихся, хотя и в незначительном количестве, метаболитов эстрогенов. Вышеописанные элементы ГК — стимуляция пролиферации и генотоксические повреждения — способны комбинироваться между собой.
Эндогенные и экзогенные эстрогены
Гормональный статус является фактором риска многих злокачественных опухолей и прежде всего рака тела матки, яичников, молочной железы, простаты и яичка. Злокачественная опухоль развивается в результате повышенной (чрезмерной) гормональной стимуляции органа, нормальный рост, развитие и функция которого находятся под контролем того или иного гормона.
У женщин суммарный уровень эстрогенной стимуляции в течение жизни зависит от возраста менархе и менопаузы, количества овуляций, которое в свою очередь зависит от числа беременностей.
Беременность, как и оральные контрацептивы, содержащие прогестерон, приводят к уменьшению овуляций и, соответственно снижению эстрогенной стимуляции гормонозависимых органов.
В мире отмечается значительное отличие в гормональном статусе разных групп населения, что выражается в возрастных особенностях наступления менархе и менопаузы, роста и массы тела и других конституциональных особенностях организма.
Это отличие обусловлено как наследственными, так и приобретенными особенностями организма. Последние в значительной степени зависят от особенностей образа жизни (прежде всего питания), а также социальных, климатических и экологических факторов.
С другой стороны, факторы репродуктивного анамнеза, такие как возраст первых родов и их количество, применение пероральных контрацептивов и других гормональных препаратов, влияют на гормональный статус и в первую очередь на суммарный уровень эстрогенной стимуляции в течение жизни Таким образом, уровень гормонов в организме женщины представлен количеством образующихся (эндогенных) и поступающих извне (экзогенных) эстрогенов.
Синтез и метаболизм стероидных поповых гормонов, как указывалось выше, в значительной степени определяются типом питания, в частности потреблением жира. Показано, что у женщин детородного возраста снижение потребления жира приводит к снижению концентрации в крови эстрона и эстрадиола.
Высокие уровни эндогенных половых гормонов в крови повышают риск рака тела матки и яичников. Потребление жиров ведет к увеличению концентрации в крови также тестостерона.
Роды снижают риск рака молочной железы. По сравнению с никогда не рожавшей, у женщины, которая родила одного ребенка, относительный риск снижен на 50%. Более того, с увеличением количества беременностей, завершившихся родами, риск рака молочной железы продолжает снижаться, и у женщины, родившей трех детей и более, риск на 65% ниже, чем у нерожавших.
Ранние роды также являются фактором снижения риска рака молочной железы. Так, у женщин, которые родили первого ребенка до 25 лет, относительный риск рака молочной железы на 35% ниже, чем у женщин, у которых первые роды были после 35 лет.
С точки зрения возможного канцерогенного риска наибольший интерес представляют ксеноэстрогены и получившие значительное распространение фармакологические гормональные препараты — оральные контрацептивы и гормонозаместительные препараты при менопаузе.
Меньшее беспокойство вызывают препараты, которые применяются для профилактики выкидышей, так как их использование в современной медицинской практике весьма ограничено. Тем не менее, первые данные о канцерогенности гормонов получены для диэтилстильбэстрола, нестероидного эстрогена, который широко применялся в 40-е годы XX века для профилактики выкидышей у беременных женщин.
Было показано, что дочери женщин, которые получали на ранних стадиях беременности диэтилстильбэстрол, часто заболевали светлоклеточным раком вагины. Частота этого заболевания достигала максимума в 20 лет. Имеются также данные о повышенном риске опухолей яичка у мальчиков, матери которых получали этот препарат.
На основании эпидемиологических данных МАИР признало диэтилстильбэстрол канцерогенным для человека и отнесло его в группу 1.
Соединения с эстрогеноподобным действием — ксеноэстрогены — это группа химических соединений среды обитания человека, имеющих структурное сходство (в частности, пестицид ДДТ и его метаболиты) с эстрогенами. В группу ксеноэстрогенов входят также диоксины, полихлорбифенилы и др.
Так, имеются сообщения о более высоком, чем в норме, содержании метаболитов ДДТ в жировой ткани молочных желез женщин, страдающих раком молочной железы. Так как одним из источников попадания ксеноэстрогенов в организм является промышленная деятельность человека, то становятся очевидными возможные подходы к профилакшке их неблагоприятных эффектов.
Исследованию канцерогенного потенциала разных типов оральных противозачаточных средств, состав которых менялся в течение всей истории их применения, посвящено огромное количество работ.
Так называемые последовательные противозачаточные препараты, поставляющие в организм в течение 14-16 дней достаточно высокие дозы эстрогенов, а в следующие 5-6 дней комбинацию эстрогенов и прогестинов, были изъяты из продажи в конце 70-х годов прошлого века, поскольку они достоверно повышали риск развития рака эндометрия.
Разработанные в последующие годы комбинированные оральные контрацептивы с относительно низкими дозами эстрогенов и прогестинов являются в настоящее время наиболее распространенной формой противозачаточных средств в мире.
В отличие от последовательных оральных контрацептивов комбинированные препараты не только не повышают риск рака тела матки, но и обладают протективным эффектом.
Эпидемиологические исследования свидетельствуют, что у женщин, которые применяли комбинированные противозачаточные препараты, на 50% снижен риск рака тела матки.
Результаты многочисленных эпидемиологических исследований показали также, что применение комбинированных контрацептивов снижает на 40% риск эпителиальных опухолей яичника. Влияние применения комбинированных оральных контрацептивов на риск рака молочной железы до сих пор, несмотря на большое количество работ, остается неясным.
Показано, что применение оральных контрацептивов в пременопаузальный период не связано с риском развития рака молочной железы. И все же, как полагают, прием оральных контрацептивов в раннем возрасте (с 16-18 лет) и до первых родов и/или на протяжении многих лет, скорее всего, повышает риск рака молочной железы.
При этом женщины, получавшие препараты, содержащие высокие дозы прогестинов, имеют наиболее высокий риск. Опубликованы результаты эпидемиологических исследований по изучению связи между применением оральных контрацептивов и разными стадиями процесса канцерогенеза в шейке матки — дисплазией, интраэпителиальным (in situ) и инвазивным раком.
Во всех исследованиях выявлено повышение риска интраэпителиального и инвазивного рака и аденокарциномы цервикального канала у женщин, применявших оральные контрацептивы.
Риск возрастал с увеличением длительности их применения. Необходимо также указать, что длительное применение оральных контрацептивов, скорее всего, повышает риск гепатоцеллюлярного рака и аденомы печени, а также рака щитовидной железы и меланомы кожи.
Резюмируя вышеизложенное, можно сделать вывод, что при нынешней тенденции к снижению абсолютного содержания эстрогенов в контрацептивах не следует ожидать какого-то серьезного изменения оценки ситуации в этой области даже в случае увеличения числа женщин, применяющих такие препараты.
Под гормонозаместительной терапией понимают многолетний прием эстрогенсодержащих препаратов в менопаузе для профилактики ряда заболеваний (сердечно-сосудистые, остеопороз и др.), связанных с изменениями гормонального статуса. Она получила широкое распространение в США в 70-х годах XX века. Однако выяснилось, что женщины, получавшие это лечение, часто заболевали раком тела матки и в меньшей степени — молочной железы.
В 80-х годах на смену препаратам, содержащим только эстрогены, пришли так называемые циклические препараты, которые содержат эстрогены и прогестерон. В настоящее время интерес с точки зрения возможного канцерогенного риска представляют именно они.
Добавление прогестерона к эстрогенсодержащим препаратам привело к снижению связанной с эстрогенами митотической активности эндометрия и соответственно риску рака эндометрия. Тем не менее, у женщин, получающих в течение длительного времени (более 8-10 лет) современную гормонозаместительную терапию, отмечается небольшое повышение риска рака эндометрия.
В связи с этим продолжаются исследования в области создания препаратов с оптимальными дозами эстрогенов и прогестинов, которые снижали бы риск остеопороза и сердечно-сосудистых заболеваний и в то же время не вызывали повышения онкологического риска.
Современная гормонозаместительная терапия повышает также риск рака молочной железы на 35%, который, однако, через 5 лет после прекращения приема этих препаратов снижается до нормального. Данных, указывающих на связь между приемом циклических гормонозаместительных препаратов и риском рака яичников, в настоящее время нет.
Таким образом, с учетом того факта, что длительное применение гормонозаместительной терапии несколько снижает частоту колоректального рака, сдерживает развитие ряда заболеваний сердечно-сосудистой системы и остеопороза, суммарный эффект назначения подобной терапии в менопаузе расценивается скорее как благоприятный.
Этому способствует и то, что спустя 5 лет и более после прекращения данной терапии риск возникновения злокачественных новообразований практически не отличается от такового в соответствующей контрольной группе.
Механизмы неэстрогенного гормонального канцерогенеза
Среди других стероидных гормонов можно указать на самостоятельную (или синергическую с эстрогенами) роль андрогенов как фактора риска развития рака молочной и предстательной желез, эндометрия, яичников и ряда других.
Помимо известной способности андрогенов превращаться в эстрогены, отмечается, что они могут непосредственно активировать рецепторы эстрогенов, стимулировать продукцию пролактина.
Рак простаты формируется при наличии определенных дериватов андрогенов, в частности, дигидротестостерона, являющегося тройным и митогенным фактором для функций и роста простаты.
Поэтому блокаторы образования дигидротестостерона, а также кастрация и эстрогенизация, приводят к регрессу рака простаты и препятствуют развитию гиперплазии простаты и ее аденомы. Ч. Хаггинс в 1966 г. был награжден Нобелевской премией по медицине именно за разработку эстрогенотерапии рака простаты.
Ряд белковых и полипептидных гормонов (прежде всего гипофизарных) может быть вовлечено в процесс усиленной стимуляции клеточного размножения в тканях-мишенях и как следствие — в развитие промоторного варианта гормонального канцерогенеза. В таком аспекте гормоны рассматриваются как промоторы опухолевого роста.
Избыточная секреция этих гормонов может возникать в результате частичного или полного удаления соответствующего периферического эндокринного органа (гонад, щитовидной железы и т.д.), или при определенных возрастных изменениях (см. ниже), или воздействии веществ, снижающих выработку гормонов.
Например, удаление большей части щитовидной железы или воздействие на ее некоторых пестицидов может вызвать снижение в крови уровня тиреоидных гормонов. Это ведет к усиленной продукции тиреотропного гормона гипофиза, который стимулирует пролиферацию тиреоидного эпителия с вытекающими последствиями.
Так, не образуя тиреоидных гормонов, клетки карциномы щитовидной железы, при относительно выраженных признаках дифференцировки, могут быть, по-прежнему, чувствительны к митогенному действию тиреотропина (ТТГ), что делает блокаду образования ТТГ у больных тиреоидным раком важным методом лечения.
Кроме того, влияние некоторых гормонов на канцерогенез может осуществляться через медиаторы пептидной природы. Так, посредником действия на многие ткани гормона роста (считается, что он индуцирует колоректальный рак) является инсулинолодобный фактор роста (ИФР-1), ранее называвшийся соматомедином С.
Необходимо также указать на возможность наложения действия гормонов и канцерогенов на одну и ту же ткань, что значительно усилит возможности канцерогенеза.
Гормональный канцерогенез и старение
Известно, что для большинства солидных новообразований (например, коло-ректального рака) типично неуклонное увеличение частоты заболеваемости по мере старения. В случае опухолей гормонозависимых органов (рак эндометрия, яичников и молочной железы) в возрасте старше 50 лет заболеваемость, как правило, начинает постепенно снижаться.
Это связывают с эффектом очевидного ослабления эстрогенной стимуляции тканей-мишеней вследствие уменьшения продукции эстрогенов, а также снижения восприимчивости самих тканей.
Выражением подобных нарушений являются: избыточная продукция гонадотропинов; относительный гиперкортицизм (с преобладанием глюкокортикоидов над надпочечниковыми андрогенами); снижение тиреоидной и эпифизарной функции (мелатонин), что ослабляет систему эндогенной противоопухолевой защиты; отклонения энергетического гомеостата, для которого характерны гиперлипидемия, накопление жира в теле, наклонность к центральному (верхнему) типу жироотложения; недостаточная секреция гормона роста (одна из причин возрастного снижения клеточного иммунитета); гиперинсупинемия и инсулинорезистентность.
Отмеченные нарушения в сочетании с менопаузой или андропаузой представляют собой достаточно характерный комплекс (синдром канкрофилии), на фоне которого создается предрасположенность к развитию значительного числа новообразований.
Резюмируя изложенное выданном разделе, можно отметить, что для гормонального канцерогенеза характерны тканеспецифичность по отношению к гормону-индуктору, необходимость постоянной и длительной стимуляции ткани-мишени, продолжительный латентный период, сравнительно высокая степень обратимости процесса.
Все эти качества свойственны негенотоксическому (промоторному) канцерогенезу. В то же время должна учитываться возможность ДНК-повреждающего (генотоксического) эффекта гормонов на канцерогенез.
Понимание значения сочетанного воздействия гормональных (эндо- и экзогенных) и генетических факторов, способствующих развитию гормонально-зависимых опухолей, приведет в конечном итоге и к лучшему пониманию механизмов гормонального канцерогенеза, и к разработке практических мер по его более эффективному предупреждению.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
