Дружков М.О., Гатауллин И.Г., Дружков О.Б.
В статье рассмотрены принципы лечения локальных рецидивов рака молочной железы.
Материалы и методы. Нами проведен ретроспективный анализ историй болезней больных, прошедших лечение в республиканском онкологическом диспансере за период с 2000 по 2011 гг. Отобранные 130 клинических случаев возникновения локального рецидива были проанализированы по следующим параметрам: иммуногистохимическое исследование гормональных рецепторов, опухолевого тканевого маркера HER2/neu и индекса пролиферативной активности Ki67. Полученные результаты подлежали сравнению с соответствующими показателями первичных опухолей у данных пациентов.
Результаты. По нашим наблюдениям фенотип (молекулярно-генетический подтип) рака молочной железы меняется в 31,9% случаев.
Изменения в опухолях люминального А фенотипа произошли у 10% пациентов (p
Изучением проблемы локальных рецидивов рака молочной железы занимаются крупные мировые онкологические институты, проведены многочисленные исследования, наиболее значимые из них: Milan1, Milan2, NSABP, DBGC, SPORE, PP [1]. В вышеперечисленных исследованиях изучались сроки возникновения локальных рецидивов в зависимости от объема оперативного лечения, различных схем комплексного лечения, молекулярно-генетических подтипов рака молочной железы [2]. По результатам данных исследований разработаны практические рекомендации Американского Общества Онкологов (NCCN), Европейского общества онкологов (EORTC) [3]. Благодаря внедрению разработанных стандартов лечения рака молочной железы удалось снизить показатели смертности и увеличить выживаемость пациентов, страдающих данным заболеванием [4]. Но, несмотря на успехи комплексного лечения рака молочной железы, частота возникновения локальных рецидивов остается достаточно высокой [5]. По различным данным, частота локального рецидивирования рака молочной железы зависит от стадии заболевания и локорегионарного распространения и достигает от 4% до 22%. Перечисленные выше клинические исследования не учитывали изменения иммунофенотипа рака молочной железы. Однако иммуногистохимические показатели определяют во многом тактику лечения данной болезни. Известно, что раковая опухоль гетерогенна по клеточному составу, кроме того, геном злокачественной опухоли неустойчив и подвержен влиянию многочисленных мутационных процессов, приводящих к изменению ее фенотипических признаков [6].
Цель исследования: разработка тактики комплексного лечения локальных рецидивов с учетом изменения иммунофенотипов первичной опухоли и локального рецидива рака молочной железы.
Материалы и методы исследования
Нами проведен ретроспективный анализ историй болезней больных, прошедших лечение в республиканском онкологическом диспансере за период 10 лет. Отобранные 130 клинических случаев возникновения локального рецидива были проанализированы по следующим параметрам: результаты клинических, лабораторных методов диагностики, иммуногистохимического исследования гормональных рецепторов опухолевого тканевого маркера HER2/neu и индекса пролиферативной активности Ki67. Полученные результаты подлежали сравнению с соответствующими показателями первичных опухолей у данных пациентов. Данные историй болезней и амбулаторных карт были закодированы для обработки в статистической программе SPSS 12.0. Всего были проанализированы 20 признаков с их градациями – клинические данные, морфологические факторы и тактика лечения опухолей. После мастэктомии рецидивы возникли у 76 пациентов (1,4%), после органосохранной операции – у 54 пациентов (5,7%). Объем хирургического вмешательства при локальном рецидиве зависел от объема предшествующего хирургического лечения, размеров рецидивной опухоли и был представлен несколькими вариантами. Широкое иссечение рецидива в области послеоперационного рубца или на передней грудной стенке проведено 77 больным (59,3%), ампутация остатка молочной железы (простая мастэктомия) после органосохранной операции – 37 пациентам (28,3%), повторная органосохранная операция (в сочетании с пластической коррекцией и без) – 16 человек (12,4%).
Результаты исследования и их обсуждение
На основании исследования мы подтвердили, что раковая опухоль на фоне проводимого лечения часто меняет свои молекулярно-биологические свойства. По нашим наблюдениям, изменения произошли у 45,7% пациентов. Все возможные изменения иммунофенотипа рака молочной железы отражены на рисунке 1.
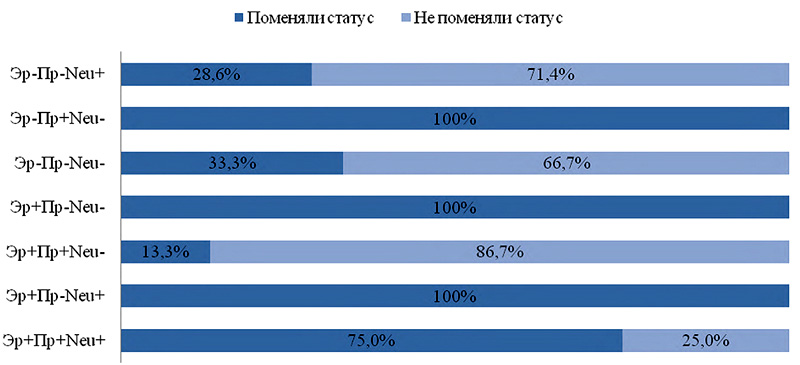
Рисунок 1. Динамика иммунофенотипа первичной опухоли РМЖ.
На рисунке представлены сочетания ИГХ-показателей рака молочной железы. В отношении каждого из них показаны изменения в процентном соотношении. Мы подтвердили большую предрасположенность к изменениям некоторых иммунофенотипов первичной опухоли по сравнению с другими. Первичные опухоли с иммунофенотипом ER+PR-Neu+, ER+PR-Neu-, ER-PR+Neu- более предрасположены к изменениям (100%, p<0,005) при возникновении локального рецидива. Опухоли с иммунофенотипом ER+PR+Neu- значительно реже меняли свой иммунофенотип (20,0%).
Для анализа клинического значения обнаруженных изменений иммуногистохимических показателей рака молочной железы полученные результаты были объединены согласно общепринятой молекулярно-генетической классификации. По нашим наблюдениям, фенотип (молекулярно-генетический подтип) рака молочной железы меняется в 31,9% случаев. Результаты распределения пациентов по иммуногистохимическим показателям первичной опухоли и локального рецидива представлены на рисунке 2.
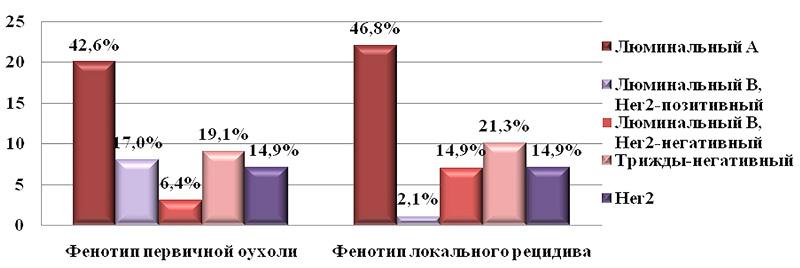
Рисунок 2. Распределение пациентов с первичной опухолью и локальными рецидивами
по молекулярно-генетическим подтипам, чел.
По нашим наблюдениям, отраженные на схеме (рис.4) изменения фенотипа рака молочной железы имеют общие принципы. По мере увеличения числа исследованных опухолей менялись только количественные (рис.3), но не качественные характеристики динамики фенотипа РМЖ. То есть можно говорить о том, что изменения иммунофенотипа рака молочной железы имеют закономерный характер.
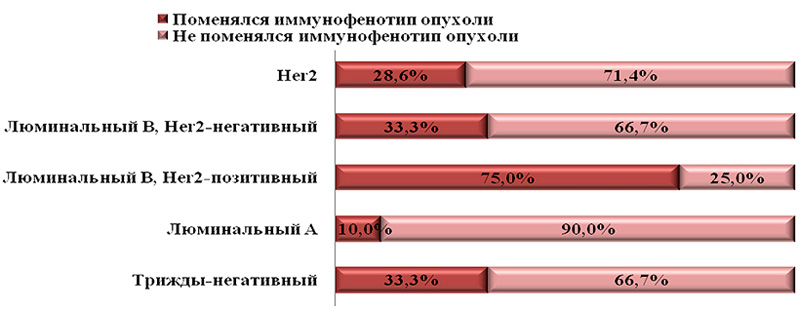
Рисунок 3. Динамика иммунофенотипа РМЖ.
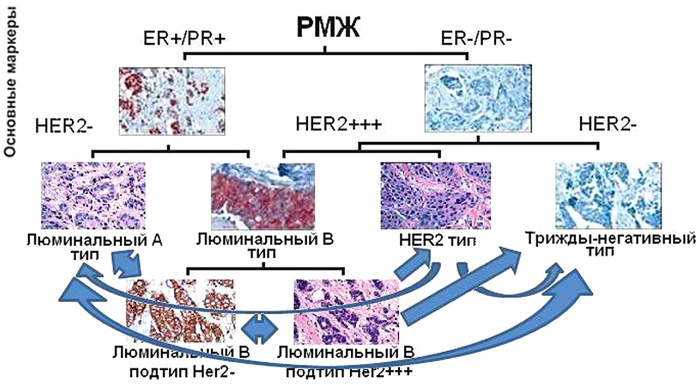
Рисунок 4. Сводная схема динамики иммунофенотипа РМЖ.
Опираясь на общие принципы лечения рака молочной железы, но с учетом изменения иммуногистохимических свойств раковой опухоли, нами разработан алгоритм комплексной терапии локальных рецидивов рака молочной железы (рис.5). Внедрение в клиническую практику разработанного алгоритма, по нашему мнению, позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
В основу алгоритма положено деление локальных рецидивов на первично-резектабельные и первично-нерезектабельные формы, ключевым является иммунодиагностика локального рецидива рака молочной железы (рис.5).
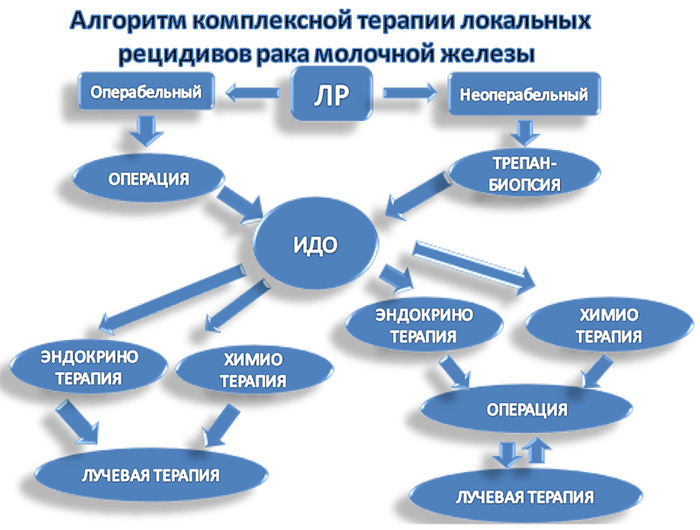
Рисунок 5. Алгоритм комплексной терапии локальных рецидивов (ЛР) РМЖ
(ИДО – иммунодиагностика опухоли).
В случае, если неоперабельная форма локального рецидива сопровождается отдаленным метастазированием, рецидивная опухоль на фоне системного лечения будет являться своеобразным маркером прогрессирования заболевания и показателем ее эффективности. Данным пациентам дальнейшее оперативное лечение целесообразнее всего проводить только в случае стабилизации заболевания и его длительной ремиссии. Местное воздействие является следующим этапом комплексной терапии осложненных (неоперабельных) форм ЛР. К оперативному лечению рецидивной опухоли следует приступать только в случае регресса опухоли под воздействием системной терапии. В том случае, если достигнуть положительного эффекта от лекарственного лечения не удалось и опухоль по-прежнему хирургически нерезектабельна, целесообразно проведение лучевой терапии.
К лечению локальных рецидивов рака молочной железы необходимо подходить комплексно. В тактике лечения должны учитываться молекулярно-биологические свойства локального рецидива. Внедрение в клиническую практику разработанного алгоритма позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
- Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomized trials. Lancet 2005; 366(9503): 2087-106.
- Smid M, Wang Y, Zhang Y, et al. Subtypes of breast cancer show preferential site of relapse. Cancer Res. 2008; 68: 3108-3114.
- Elkhuizen PHM, van Slooten H, Clahsen PC, et.al. High Local Recurrence Risk Breast-Conserving Therapy in Node-Negative Premenopausal Breast Cancer Patients Is Greatly Reduced by One Course of Perioperative Chemotherapy: A European Organization for Research and Treatment of Cancer Breast Cancer Cooperative Group Study. J.Clin.Oncol. 2000; 18: 1075-1083.
- Paridaens R, Piccart M. First line hormonal treatment for metastatic breast cancer with exemestane or tamoxifen in postmenopausal patients – A randomized phase III trial of the EORTC Breast Group. Proceeding of ASCO 40 Annual Meeting. New Orleans, 2004; 23: 6.abs.515.
- Колядина И.В., Поддубная И.В., Комов Д.В. и соавт. Срок наступления локальных рецидивов у больных первично-операбельным раком молочной железы при различной лечебной тактике. Сибирский онкологический журнал 2008; 6(30): 17-20.
- Iorio MV, Croce CM. MicroRNAs in cancer: small molecules with a huge impact. J. Clin. Oncol 2009; 27: 5848-5856.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Иммунофенотип трижды негативного подтипа рака молочной железы
Здравствуйте! Мне 56 лет, в декабре 2016г обнаружила шишку в левой МЖ глубоко внутри. В марте сделала маммографию, сказали мастопатия, ничего страшного. К июлю 2017г. опухоль увеличилась до 5см, прошла обследования, которые показали:
Экспрессия эстрогеновых рецепторов (SP1, YENTANA): 0;
Экспрессия прогестероновых рецепторов (1Е2, VENTANA): 0;
Отсутствие экспрессии белка Her2/neu (кроличье моноклональное антитело 4В5, VENTANA): 0;
Ki-67 (30-9, VENTANA) = 80%.
Патологогистологическое заключение (диагноз)
Инвазивный неспецифический рак молочной железы, Grade 3.
Иммунофенотип трижды негативного подтипа рака молочной железы.
С-r левой молочной железы IIB(T2N1M0).
Прошла 4химии: Доксорубицин + Эндоксан. Узи показало, что до химии опухоль была 2.8см в диаметре, стала 1.7см. Врач назначил еще 3 химии (Доцетаксела) до операции и одну после.
Врач хочет сделать только частичную резекцию, смысла в мастэктомии не видит.
Вопрос: обязательно делать столько ХТ? И делать резекцию или всё таки мастэктомию?
Может кто-то из форумчан поделится опытом.
Всем огромное спасибо! И скорейшего выздоровления!
Я не врач, я пациентка в ремиссии после лечения гормонозависимого РМЖ T3N1M0. У меня была химиотерапия (6 курсов паклитаксел+доксорубицин), потом мастэктомия, потом облучение, и четвертый год живу на гормонотерапии. У меня вопрос о сохранении молочной железы не стоял, потому что опухоль была большая, 6 см, ее уменьшали до операции химией, но тем не менее оставлять оказалось особо нечего. Таксаны (к которым относятся паклитаксел и доцетаксел) — препараты эффективные, при РМЖ обычно хорошо работают. А 4 курсов химии в вашей ситуации, думаю, мало, ведь при трижды негативном РМЖ не работают ни гормонотерапия, ни таргетная терапия, так что только химия и остается.
Насчет того, рискованно или нет оставлять грудь в вашей ситуации — не знаю. Врачам виднее.
Удачи большой-большой-большой и хорошей переносимости ХТ!
Здравствуйте!
В случае с предоперационной химиотерапией речь идёт о понижении стадии заболевания из-за уменьшения размера опухоли. Поэтому возможно выполнение органосохраняющей операции с последующей лучевой терапией. До операции стандартно проводится 6 курсов ХТ. Возможны варианты. Все будет зависеть от гистологии.
QUOTE=DocDruzhkov; здравствуйте! Подскажите пожалуйста, врач ничего не говорил о ПЭТ/КТ и про онкомаркеры. Необходимо ли это проходить? Делали только остеосцинтиграфию, по результатам которой, всё хорошо
ПЭТ Вам не показано (в Вашем случае не проводится)
КТ необходимо для уточнения характера изменений при стандартных исследованиях — УЗИ и рентген.
Реферат. Исследование доказывает положение о том, что для выбора тактики комплексного лечения локальных рецидивов рака молочной железы недостаточно только гистологического исследования, необходимо проводить иммуногистохимическое исследование экспрессии рецепторов стероидных гормонов, а также онкобелка HER2/neu. Разработан алгоритм комплексной терапии локальных рецидивов рака молочной железы в зависимости от изменения иммунофенотипа первичной опухоли.
Ключевые слова: локальный рецидив, рак молочной железы, динамика иммунофенотипа.
В структуре заболеваемости рак молочной железы занимает лидирующее положение. В настоящее время ежегодно регистрируется более 50 тыс. новых случаев рака молочной железы и более 22 тыс. смертей. Рост заболеваемости раком молочной железы отмечается как в целом по России, так и в отдельных регионах.
Современная онкологическая практика требует не только верификации гистологического диагноза, но и обязательной оценки прогноза течения болезни и предсказания ответа на терапию. В этом отношении чрезвычайно важен иммуногистохимический (ИГХ) профиль злокачественного новообразования, его морфофункциональная характеристика. В настоящее время для выбора оптимальной лечебной тактики, адекватного лекарственного лечения следует установить не только стадию опухоли, гистологический вариант и степень злокачественности, но и обязательно фенотип.
Выбор метода лечения рака молочной железы определяется стадией заболевания, клинической формой опухоли, возрастом и общим состоянием больной, а также дополнительными данными, которые характеризуют отдельные свойства опухоли и организма (гормональные, иммунные и др.) [3]. Для лечения рака молочной железы эффективны все известные в настоящее время в онкологии методы специфического воздействия на злокачественную опухоль: хирургический, лучевой и медикаментозный (химиотерапия, гормонотерапия, таргентная терапия) [2]. Успехи лечения относятся главным образом к ранним стадиям заболевания, когда опухоль развивается на ограниченном участке железы и не выходит за пределы ближайшего этапа лимфогенного метастазирования [1]. У большинства остальных больных рано или поздно наступает рецидив заболевания (возникновение локальных рецидивов или генерализация заболевания за счет клинического проявления гематогенного ме-тастазирования) [6]. В отличие от доброкачественных опухолей РМЖ, также как и рак любой другой локализации, имеет способность как к лимфогенному или гематогенному метастазированию, так и к местному рецидивированию [7]. Локальный рецидив (Ipsilateral breast cancer recurrence) — опухоль, аналогичная по морфологическому строению первичной, возникшая после радикальной операции в оставшейся части молочной железы (после органосохраняющего лечения), в области послеоперационного рубца или мягких тканях вне рубца на одноименной поверхности грудной клетки (после мастэктомии) и не ассоциированная с поражением регионарных лимфатических узлов [3].
Известно, что раковая опухоль молочной железы, являясь гетерогенной по клеточному составу, характеризуется различными скоростью роста, кариотипом, иммуногенностью, экспрессией рецепторов, чувствительностью к лекарственной терапии субпопуляций клеток (Имянитов Е.Н., Хансон К.П., 2007). Опухоль, взаимодействуя с окружающими тканями и условиями среды, испытывая влияние гипоксии, диспепсии, токсическое, лекарственное воздействие, а также гормональное и множество других факторов, претерпевает генетические изменения (Croix et al., 2000). Геномная неустойчивость (Sorlie T., 2004) неизбежно затрагивает и иммунофенотип рецидивной опухоли, нередко отличающийся от такового от первичной опухоли рака молочной железы. На протяжении жизни, а также в процессе лечения раковая опухоль изменяется по клеточному составу, а значит должна меняться тактика лечения локальных рецидивов. Для выбора тактики комплексного лечения локальных рецидивов рака молочной железы недостаточно только гистологического исследования, необходимо проводить иммуноги-стохимическое исследование экспрессии рецепторов стероидных гормонов, а также онкобелка HER2/neu.
Цель исследования — разработка тактики комплексного лечения локальных рецидивов с учетом изменения иммунофенотипов первичной опухоли и локального рецидива рака молочной железы.
Материал и методы исследования
Все больные с резектабельными формами локальных рецидивов подвергались оперативному лечению. Объем хирургического вмешательства зависел от размеров рецидивной опухоли и был представлен несколькими вариантами: иссечение рецидива в области послеоперационного рубца или на передней грудной стенке (55,2%), ампутация остатка молочной железы (простая мастэктомия) после органосохраняющей операции (30,5%), повторная органосохраняющая операция в сочетании с пластической коррекцией и без (11,4%), иссечение локорегионарного рецидива в 2,9% случаев.
Все препараты подвергались гистологическому и иммуногистохимическому исследованию, проводимому с использованием моноклональных антител к эстрогеновым и прогестероновым рецепторам, белку онкогена HER2/neu. Полученные результаты подлежали сравнению с соответствующими показателями первичных опухолей у данных пациентов.
Результаты исследования и их обсуждение
Изменения иммунофенотипов локальных рецидивов рака молочной железы произошли не только за счет увеличения или уменьшения экспрессии рецепторов стероидных гормонов, но и за счет изменения экспрессии онкогена HER2/neu (рис. 1).

Таким образом, установлено, что фенотипические признаки первичной опухоли и локального рецидива по основным ИГХ-показателям отличаются в 57,69% случаев. Согласно нашим наблюдениям, изменения от гормононегативных опухолей к гормонопозитивным наблюдали в 46,7% случаев. Фенотип гормоно-негативных опухолей поменялся в 40% наблюдений. Изменения экспрессии онкогена HER2/neu наблюдали в 13,3% случаев. Опухоли с фенотипом ЭР-, Пр-, neu+++ (HER2-™^ не изменили своих молекулярно-генетических свойств. Трижды негативные опухоли поменяли молекулярно-генетические свойства у трети пациентов. У подавляющего большинства опухолей с иммунофенотипом Эр+, Пр-, neu- (75%) снизилась экспрессия рецепторов стероидных гормонов, в результате чего они стали трижды негативными. То же произошло и с опухолями с более выраженной экспрессией рецепторов стероидных гормонов (фенотип Эр+, Пр+, neu-). Но только небольшое количество таких опухолей (25%) ввиду высокой экспрессии успели поменять свой статус в процессе лечения. У опухолей с люминальным В-молекулярно-генетическим подтипом (Эр+, Эр-, neu+++ и Эр+, Пр+, neu+++) поменялся фенотип не только за счет снижения или увеличения экспрессии рецепторов стероидных гормонов, но и за счет снижения экспрессии белка онкогена HER/2neu.
Нами разработан алгоритм комплексной терапии локальных рецидивов рака молочной железы. В основу алгоритма положено деление локальных рецидивов на местно-операбельные и первично-неоперабельные формы (рис. 2).

Комплексное лечение пациенток с операбельной формой локального рецидива начинают с хирургического удаления рецидивной опухоли. Объем хирургического вмешательства зависит от размеров рецидивной опухоли, предшествующей операции и представлен несколькими вариантами. После радикальных мастэктомий проводится иссечение рецидива в области послеоперационного рубца или на передней грудной стенке. После предшествующей органосохраняющей операции проводится ампутация остатка молочной железы (простая мастэктомия), если размер рецидивной опухоли превышает 2 см в наибольшем измерении. В случае когда размер рецидивной опухоли не превышает 2 см, проводится повторная органосохраняющая операция (в сочетании с пластической коррекцией и без), отступя от краев опухоли не менее 2 см, с гистологическим исследованием резекционных линий на степень их чистоты. Все удаленные опухоли подвергаются гистологическому и иммуногистохимическому исследованию. В зависимости от результатов назначается лекарственная терапия. Если опухоль оказывается гормонозависи-мой с высокой экспрессией рецепторов стероидных гормонов (7—8 баллов), то целесообразнее всего проведение гормонотерапии II—III линии. В случае низкой экспрессии стероидных гормонов в рецидивной опухоли или ее отсутствия проводится ПХТ с последующей эндокринотерапией.
В случае если неоперабельная форма локального рецидива сопровождается отдаленным метастазирова-нием, рецидивная опухоль на фоне системного лечения будет являться своеобразным маркером прогрессиро-вания заболевания и показателем ее эффективности. Данным пациентам дальнейшее оперативное лечение целесообразнее всего проводить только в случае стабилизации заболевания и его длительной ремиссии. Местное воздействие является следующим этапом комплексной терапии осложненных (неоперабельных) форм локальных рецидивов. К оперативному лечению рецидивной опухоли следует приступать только в случае регресса опухоли под воздействием системной терапии. В том случае, если достигнуть положительного эффекта от лекарственного лечения не удалось и опухоль по-прежнему хирургически неудаляема, целесообразно проведение лучевой терапии. Необходимо учитывать срок с момента последней лучевой терапии — должно пройти не менее трех лет.
В результате многочисленных международных многоцентровых рандомизированных исследований разработаны единые стандарты лечения пациенток с первичным раком молочной железы, которым должны придерживаться онкологи, планируя тактику лечения. Что касается локальных рецидивов рака молочной железы, тактика лечения должна быть строго индивидуальна для каждой пациентки, должна обязательно иметь комплексный подход к лечению, включающий в себя химиотерапию, эндокринотерапию, хирургическое и лучевое лечение.
Перед началом системного лечения требуется обязательная верификация рецидивной опухоли.
Резектабельные опухоли должны быть исследованы после повторного оперативного вмешательства, нерезектабельные должны подвергаться трепано-биопсии или эксцизионной биопсии с последующим гистологическим, а также иммуногистохимическим исследованием рецидивной опухоли.
Внедрение в клиническую практику разработанного алгоритма позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
1. Аничков,Н.М. Биологические и клинико-морфологические аспекты учения о метастазировании злокачественных опухолей / Н.М. Аничков // Медицинский академический журнал. — 2003. —№ 1. — С. 5—10.
2. Чебнэр, Б.Э. Руководство по онкологии / Б.Э. Чебнэр, Т.Дж. Лич, Д.Л. Лонго; пер. с англ.; под общ. ред. акад. РАЕН, проф. В.А. Хайленко. — М.: МЕДпресс-информ, 2011. — 656 с.
3. Колядина, И.В. Локальные рецидивы первично-операбельного рака молочной железы: дис. . канд. мед. наук / И.В. Колядина. — М., 2002. — С. 4—5.
4. Семиглазов, В.Ф. Опухоли молочной железы (лечение и профилактика) / В.Ф. Семиглазов, К.Ш. Нургазиев, A. С. Арзуманов. — Алматы, 2001. — 345 с.
5. Чисов, В.И. Злокачественные заболевания в России в 2009 г. (заболеваемость и смертность) / В.И. Чисов, B. В. Старинский, Г.В. Петрова. — М., 2011. — 260 с.
6. Bhandari, T. Clinical characteristics of women presenting with skin only recurrence of breast cancer / T. Bhandari, D.S. Dizion, C. Taneja // Am. J. Surg. — 2007. —Vol. 194 (4). — P. 494—496.
7. Yamashita, S. Survive in expression predict of early recurrence in early stage of the breast cancer / S. Yamashita, Y. Masuda, T. Kurizaki // Anticancer Res. — 2007. — Vol. 27 (4c). — P. 2803—2808.

Наука: Медицина
Секция: Онкология
- Условия публикаций
- Все статьи конференции

ДИНАМИКА ИММУНОФЕНОТИПА РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В ПРОЦЕССЕ ЛЕЧЕНИЯ
Бондаренко Игорь Николаевич
профессор, д-р мед. наук, зав. кафедрой онкологии
Завизион Виктор Федорович
Куник Анна Владимировна
магистрант кафедры онкологии и медицинской радиологии
Асеев Алексей Игоревич
канд. мед. наук, ассистент кафедры онкологии
Рак молочной железы в структуре заболеваемости и смертности от злокачественных заболеваний у женщин в Украине, а также странах Европы и Америки занимает первое место [7]. Статистические данные последних лет свидетельствуют о том, что в экономически развитых странах ежегодно наблюдается рост заболеваемости и смертности от рака этой локализации [12, 1], за последние тридцать лет частота случаев рака молочной железы увеличилась более чем на 20 % [10].
Рак молочной железы — это группа гетерогенных опухолей разных биологических подтипов, которые различаются по ответу на терапию и по прогнозу, что усложняет адекватное лечение. В наше время для выбора оптимальной лечебной тактики и адекватной медикаментозной терапии обязательным является установление фенотипа опухоли. По рекомендациям American Society of Clinical Oncology для определения опухолевых маркеров для рака молочной железы от 2007 года необходимым считается исследование уровня экспрессии эстрогеновых, прогестероновых рецепторов и Her-2/neu [17].
На практике стандартом является иммуногистохимическое исследование опухоли до начала лечения. Но нередко фенотип опухоли на разных стадиях ее генеза отличается.
Изменение уровня экспрессии рецепторов опухоли может быть настоящим биологическим феноменом или результатом ошибочного выполнения исследований. Биологическими причинами называют дрейф генов, селекцию клонов клеток, гетерогенность опухоли и повреждение генного аппарата клетки внешними агентами, например, химиопрепаратами, гормонотерапией или таргетными телами [5].
По данным Американской ассоциации клинических патологов карцинома молочной железы имеет значительную гетерогенность, особенно это касается опухолей с уровнем экспрессии Her-2/neu 2+ (для ИФА метода). Около 68 % случав имеют отличающийся уровень эпидермального фактора роста при исследовании другого среза опухоли или ее метастаза (регионального или отдаленного) [8].
Разница между ИГХ статусом первичной опухоли и рецидивных очагов составляет от 15 до 40 % [2]; в 7—26 % изменяется статус Her-2/neu рецепторов [4]. Кроме того, некоторые авторы описывают, что фенотип первичной опухоли и пораженных лимфатических узлов отличается почти в 75 % случаев [15].
Изменение Her-2/neu статуса в процессе лечения может быть причиной резистентности к терапии трастузумабом [6].
Научно значимым является вопрос, как влияет неоадъювантная химиотерапия на статус эпидермального фактора роста. Согласно одному из исследований в 30 % случаев определялось минимальное изменение экспрессии Her-2/neu, а в 10 % — полное изменение статуса с положительного на отрицательный [14]. В 2006 году были опубликованы данные научного поиска влияния неоадъювантной терапии на стероидные рецепторы рака. По результатам исследования изменения были выявлены в 25 % срезов, из них приблизительно в 48 % случаев была выявлена реверсия ER и PR с положительных на отрицательные. Такая тенденция приводила к увеличению общей выживаемости, но не влияла на безрецидивную выживаемость [16].
Потеря рецепторов наблюдается чаще, чем их появление. Изменение уровня экспрессии гормональных рецепторов и HER-2 не зависит от размера, стадии и гистологической структуры первичной опухоли. Изменение экспрессии эпидермального фактора рота зависит от места метастазирования (кости, висцеральные органы или мягкие ткани). Положительная экспрессия хотя бы одного из гормональных рецепторов коррелирует с лучшим прогнозом, как и изменение рецепторов эпидермального фактора роста. Пациенты, у которых тройной негативный тип опухоли изменяется на другой тип, имеют худший прогноз [3].
Повторное определение рецепторного статуса рецидивных очагов опухоли в 20 % изменяет дальнейшую лечебную тактику [13].
Итальянские ученые исследовали влияние отличия рецепторного статуса между первичной опухолью и рецидивной на прогноз пациентов. Больные с конкордантным тройным негативным раком имеют лучший прогноз (медиана выживаемости 43,0 месяца, 95 % интервал доверия 31,2—52 месяца) по сравнению с пациентами с дискордантным triple-negative раком (медиана 15,6 месяцев, интервал доверия 95 % 11,6—30,5 месяцев). Пациенты с рецептор-положительными типами опухолей, не имеющие изменений, также имели лучший прогноз (медиана виживаемости 45,1 месяц, 95 % интервал доверия 37,1—53,9 месяцев) [9].
Мы ретроспективно проанализировали истории болезни 67 пациентов с раком молочной железы. Во всех 67 случаях были проведены первичные и повторные иммуногистохимические исследования опухолей. Все больные — женщины в возрасте от 29 до 73 лет на момент первых анамнестических проявлений болезни. Средний возраст составил 52 (±11,26) года.
63 пациентки (94,03 %) получали лечение, у 4 пациенток лечение отсутствовало. В 63 случаях больные получали химиотерапевтическое лечение. У 9 пациенток (13,43 %) в этапы лечения входила гормонотерапия, у 3 (4,48 %) — таргетная терапия (герцептином), в 6 (8,96 %) — лучевая терапия. 65 пациенток (97 %) имели в анамнезе оперативное лечение.
Согласно молекулярно-генетической классификации рака молочной железы 2005 года редакции (St. Gallen breas cancer classification — 2005), мы выделили 4 гистогенетических типа рака молочной железы: люминальный А подтип (ЕR и/или PR положительный и Her-2/neu отрицательный), люминальный В подтип (ЕR и/или PR положительный и Her-2/neu положительный), подтип с гиперэкспрессией Her-2/neu (ЕR и PR отрицательный, Her-2/neu положительный) и тройной негативный подтип (ЕR, PR и Her-2/neu отрицательный) [11]. Использование молекулярно-генетической классификации 2011 года редакции было невозможным в связи с отсутствием у подавляющего большинства пациентов статуса Ki-67.
В 30 случаях (44,78 %) определялись изменения иммуногистохимического статуса.
Первично люминальный А подтип определялся у 32 пациентов, в процессе лечения в 1 наблюдении он изменился на люминальный В подтип, в 5 случаях мы установили полную потерю экспрессии стероидных рецепторов (изменение на тройной негативный тип), в 2 клинических случаях — потерю рецепторов эстрогена и прогестерона и появление рецепторов эпидермального фактора роста (подтип с гиперэкспрессией Her-2/neu).
Люминальный В подтип на этапе первичной диагностики был установлен у 17 женщин с раком молочной железы. При повторном исследовании наблюдалась такая динамика: у 8 пациентов выявили потерю рецепторов Her-2/neu (конверсия в люминальный А подтип) и в 2 случаях потерю стероидных рецепторов (Her-2/neu positive рак молочной железы).
Для больных с базальным типом рака ( 7 женщин) тенденции были такие: в 2 наблюдениях конверсия в люминальный А подтип, в 1 — в люминальный В и 1 случае в тройной негативный тип.
У женщин с гиперэкспрессией Her-2/neu мы выявили в 3 случаях потерю экспрессии рецептора эпидермального фактора роста и появление стероидных рецепторов (конверсия в люминальный А подтип), в 2 случаях — переход в молекулярный В подтип и в 1 наблюдении изменение на тройной негативный тип опухоли.
В нашем регионе статистически достоверной является тенденция к изменению фенотипа опухоли у пациентов, которые на момент диагностики имели люминальный В подтип рака молочной железы.
В результате тщательного анализа с помощью методов математической статистики мы выявили ряд факторов, которые влияют на изменение уровня экспрессии маркеров биологической агрессивности опухоли. Из-за небольшого количества пациентов в группе наблюдения мы называем эти корреляции тенденциями.
Первичный фенотип опухоли (значение критерия Мана-Уитни 0,004) имеет достоверное влияние на возможности дискордантности молекулярного типа рака молочной железы при повторном иммуногистохимическом исследовании. Как было сказано выше, наибольшую тенденцию к изменению имеет люминальный В тип опухоли.
Наличие таргетной терапии в анамнезе статистически достоверно влияло на реверсию фенотипа рака. В 2 случаях зафиксирована потеря экспрессии эпидермального фактора роста, в 1 случае — стероидных рецепторов.
Лучевая терапия в 4 случаях коррелировала с изменение экспрессии Her-2/neu, в 2 наблюдения — стероидных рецепторов.
Наблюдалась тенденция к изменению молекулярного типа рака в случае изменения места взятия биопсии (например, в метастатическом очаге).
Статистически с изменением фенотипа опухоли коррелирует репродуктивный статус женщины на момент первичной диагностики заболевания (репродуктивный возраст или менопауза). Большинство случаев изменения статуса опухоли наблюдается в репродуктивном возрасте. Также опухоли с более низкой степенью дифференцировки имели тенденцию к изменению фенотипа в процессе лечения.
Нами были проанализированы и другие факторы, но их влияние на возможность изменения молекулярного подтипа рака молочной железы не было математически доказано. Они представлены: 1) периодом между проведением иммуногистохимических исследований, 2) типом рака молочной железы (первичный или рецидивный), 3) возрастом больной на момент диагностики заболевания, 4) наличием химиотерапии, гормонотерапии или оперативного лечения в анамнезе, 5) гистологическим типом рака, 6) степенью терапевтического повреждения по Лавниковой Г.О., 7) стадией заболевания, 8) первичным размером опухоли, наличием пораженных регионарных лимфоузлов или отдаленных метастазов на момент диагностики (TNМ-классификация).
Полученные нами результаты совпадают с мировыми данными.
Таким образом, послеоперационный материал больных, которые имели неоадъювантное лечение, первичная или метастатическая опухоли могут иметь разные показатели биологической активности. Клиническое значение такого феномена обусловлено возможным его влиянием на дальнейшую тактику ведения пациентов благодаря широкому внедрению в клинике современных медикаментозных методов лечения (химиотерапии, гормонотерапии и терапии таргетными телами). Все больше данных говорят о том, что каждый новый виток развития опухолевой ткани следует исследовать с помощью иммуногистохимических методов.
