Ежегодно в мире регистрируется более 165 тысяч новых случаев рака яичников (РЯ) и более 100 тысяч смертей от злокачественных опухолей яичников (данные Международного агентства по изучению рака). Наиболее высокие стандартизованные показатели заболеваемости в северной части Европы и в Северной Америке — более 12 на 100 тыс.. В России ежегодно рак яичников выявляют более чем у 11 тыс. женщин (10,17 на 100 тыс.). Прирост заболеваемости в России за последние 10 лет составил 8,5%.
В большинстве индустриальных стран РЯ имеет наиболее высокие показатели смертности среди всех гинекологических опухолей. Это прежде всего связано с бессимптомным течением заболевания на ранних стадиях и поздней диагностикой. Летальность больных раком яичников на 1-м году после установления диагноза — 35%. По сводным данным популяционных раковых регистров стран Европы, 1-летняя выживаемость больных раком яичников составляет 63%, 3-летняя – 41%, 5-летняя – 35%. За последнее десятилетие в Европе отмечается увеличение 5-летней выживаемости на 3% (с 32 до 35%), в США — на 4% (с 36 до 39%). Но прогресс связан не столько с улучшением диагностики, сколько с совершенствованием химиотерапии (появлением новых лекарственных препаратов, улучшением комбинаций для лечения, снижением побочных эффектов) и хирургической техники.
Среди этиологических факторов развития РЯ выделяют: внешние, наследственные факторы и эндокринные нарушения (роль овуляции, как провоцирующего момента).
При спорадическом РЯ риск заболевания равен 0,1%, а при наличии мутации гена BRCA 1 возрастает до 40 — 60%; при мутации гена BRCA 2 — до 20%. Эти повреждения генома встречаются у 10 — 20% женщин из всей популяции. До сих пор механизм канцерогенеза рака яичников до конца не ясен: пути передачи “сигналов” трансформации клеток раскрыты, но лишь частично, выявлены некоторые рецепторы факторов роста (RAS, АКТ-2, Р13-киназы, EGF-R, ERB-B2), выделены гены супрессоры (P53,DAB2, NOEY2, LOT1).
ВВЕДЕНИЕ
Проблема диагностики и лечения новообразований яичников является одной из самых трудных разделов онкогинекологии. У большинства больных злокачественными опухолями яичников заболевание выявляется на поздних стадиях, а результаты их лечения остаются неутешительными. Несмотря на высокую чувствительность многих современных методов диагностики, их специфичность недостаточна для дифференциации доброкачественного и злокачественного процессов в яичниках, что не может обеспечить эффективный скрининг для раннего выявления злокачественных опухолей. Общая пятилетняя выживаемость больных раком яичников не превышает 35-40%.
1.1. ЗАБОЛЕВАЕМОСТЬ, СМЕРТНОСТЬ И ВЫЖИВАЕМОСТЬ
Большинство опухолей яичников являются эпителиальными. Все опухоли могут быть разделены на доброкачественные и злокачественные. Статистические сведения о частоте опухолей яичников в женской популяции касаются только их злокачественных форм. Среди злокачественных опухолей женских половых органов опухоли яичников (карциномы, стромальноклеточные и герминогенные опухоли) занимают третье место после рака шейки и тела матки, их доля достигает 30%. Среди всех злокачественных новообразований у женщин рак яичников занимает седьмое место по частоте, составляя 4-6%. По данным Международного агентства по изучению рака (МАИР) ежегодно в мире регистрируется более 165 000 новых случаев рака яичников, и более 100 тыс. женщин погибают от злокачественных новообразования яичников. Если удельный вес (%) рака яичников в онкологической заболеваемости женщин во всех странах мира примерно одинаков, то частота заболеваемости на 100000 женского населения (%ооо) значительно варьирует. В Европе, особенно в Северных странах и Великобритании, а также в Северной Америке, стандартизованные показатели заболеваемости наиболее высокие (10 и более на 100 000). В Центральной и Южной Америке, Африке и Азии, включая индустриальные страны, такие как Япония, но исключая Израиль, эти показатели значительно ниже (7 и менее на 100 000). За последние 20 лет уровни заболеваемости раком яичников в большинстве стран с высоким риском (Скандинавия, Великобритания, США, Канада) остаются стабильными и даже несколько снижаются. В то же время отмечено повышение заболеваемости в странах с низким риском, таких как Япония, Индия, Сингапур, а также в некоторых странах Южной и Восточной Европы (Португалия, Испания, Югославия, Польша). В России ежегодно рак яичников выявляется более чем у 11 000 женщин (10, 17 на 100 000), занимая седьмое место в структуре общей онкологической заболеваемости (5%) и третье — среди гинекологических опухолей после рака тела и шейки матки [2]. За последние 10 лет в стране произошел прирост заболевания на 8, 5%.
По показателям смертности рак яичника опережает рак тела и шейки матки, занимая 5-е место среди причин смерти от всех опухолей у женщин. В большинстве индустриальных стран мира рак яичников имеет самые высокие показатели смертности среди всех гинекологических опухолей, что связано с поздней диагностикой заболевания. Летальность больных раком яичников на первом году после установления диагноза составляет 35%. По сводным данным популяционных раковых регистров стран Европы, однолетняя выживаемость больных раком яичников составляет 63%, трехлетняя — 41%, пятилетняя — 35%. За последнее десятилетие отмеченное в Европе увеличение пятилетней выживаемости больных злокачественными опухолями яичников на 3% (с 32% до 35%), а в США — на 4% (с 36% до 39%) объясняется не столько улучшением диагностики, сколько эффективным применением платиновой химиотерапии в лечении диссеминированных форм рака яичников и герминогенных опухолей. Риск заболеть раком яичника на протяжении жизни составляет 1,5%, и 1 из 100 женщин может умереть от этого заболевания [92].
1.2. ЭТИОЛОГИЯ
Причины возникновения большинства опухолей яичников остаются неизвестны. Обзоры эпидемиологических исследований указывают на высокую частоту рака яичника в индустриальных странах, за исключением Японии. Возможно, это обусловлено диетическими факторами, а именно, высоким потреблением животных жиров [34, 60], хотя последние исследования [71] не подтверждают связи развития рака яичников ни с высококалорийной пищей, ни с употреблением алкоголя, кофеина и никотина [60]. Нет и убедительных доказательств возможного канцерогенного эффекта радиации, применяемой в диагностических и терапевтических целях, в развитии рака яичников, хотя в эксперименте модели опухолей яичников создавали путем облучения грызунов рентгеновскими лучами или при помощи пересадки ткани яичника в селезенку или другие органы портальной системы. В нескольких исследованиях развитие карцином яичников связывают с использованием талька в гигиенических целях [45].
Наследственный фактор является одним из важных факторов риска в развитии рака яичников, хотя большинство карцином яичника (95%) являются спорадическими по своей природе и их риск развития в популяции не превышает 1,5%, т. е. заболевает 1 из 100 женщин. Тогда как к наследственным формам могут быть отнесены только 5% случаев рака яичника, риск развития заболевания может возрастать до 50%, т. е. заболевает каждая вторая [6]. В настоящее время описаны три синдрома наследственной предрасположенности к возникновению рака яичника: семейный рак яичников, семейный рак молочной железы/яичников, синдром Линча II.
Семейный рак яичников. Риск развития заболевания зависит от числа ближайших родственников, заболевших ранее раком яичников. В семьях, в которых зарегистрирован один случай рака яичников у родственницы 1 степени родства (у матери, дочери или родной сестры), риск заболеть в 2-3 раза выше, чем в популяции, и составляет 4-5%. В семьях, где выявлен рак яичника у одной родственницы 1 степени родства и одной родственницы 2 степени родства (у бабушки, внучки, двоюродной сестры, тети или племянницы), риск возрастает в 4-5 раз по сравнению с популяционным и равняется 7%. В семьях, где две родственницы 1 степени родства заболевают раком яичника, рискует заболеть каждая вторая, т. е. риск равен 50% [23]. Поэтому при медико-генетическом консультировании крайне важен тщательный сбор семейного анамнеза.
Семейный рак молочной железы /яичников. В таких семьях ближайшие родственницы заболевают раком молочной железы в молодом возрасте (до 50 лет) и раком яичников. Степень риска заболеть раком этих локализаций также определяется числом заболевших родственниц различной степени родства. Кроме того, как уже упоминалось, у женщин, ранее заболевших раком молочной железы или яичников, риск развития второй опухоли в 2-4 раза выше, чем в популяции.
Синдром Линча II. При этом синдроме в семьях среди ближайших родственников прослеживается заболеваемость аденокарциномами различных локализаций, преимущественно колоректальным раком, раком молочной железы и эндометрия, раком яичников. Риск возникновения аденокарциномы среди членов семьи также зависит от числа заболевших родственников, и он в любом случае выше в 2 раза, чем в популяции [46].
Недавно были идентифицированы гены BRCA1 в хромосоме 17 ql2-21 и BRCA2 в хромосоме 13 ql2, которые оказались ответственными за возникновение наследственных форм рака молочной железы и рака яичников. Выявление при описанных семейных синдромах мутаций в этих генах свидетельствует о наследственной передаче злокачественной опухоли. Однако рутинное генетическое тестирование ограничено по нескольким причинам. Во-первых, определение возможной точечной мутации на протяжении более 100 000 основании гена у больной и ее родственников при выявленном семейном синдроме остается весьма трудоемким, дорогостоящим и не всегда эффективным даже в современных генетических лабораториях. Во-вторых, генетическое тестирование наследственных форм рака яичников и молочной железы несет в себе этические и социальные проблемы. Отсутствие мутации генов BRCA1 и BRCA2 у обследуемой пациентки не исключает развития спорадических форм этих злокачественных опухолей. Выявление же мутаций генов BRCA1 и BRCA2 у здоровых носительниц ставит вопрос о рекомендациях по ранней диагностике и профилактике заболевания, которые во многом не решены в отношении скрининга рака яичника.
В табл. 1 определены критерии умеренного риска возникновения наследственного рака яичника [6].
1. Две родственницы 1* степени родства с наличием рака яичников в анамнезе
2. Одна родственница 1 степени родства с диагнозом рака яичников и одна родственница 1 степени с диагнозом рака молочной железы в возрасте моложе 50 лет
3. Одна родственница 1 степени родства с диагнозом рака яичников и две родственницы 1 и/или 2** степени с диагнозом рака молочной железы в возрасте моложе 60 лет
4. Наличие мутации гена BRCA1 или BRCA2, ответственных за возникновение рака яичников
5. Три родственницы 1 и/или 2 степени родства с диагнозом рака толстой кишки и один случай рака яичников
* Родственницы 1 степени родства — мать, дочь, родная сестра
** Родственницы 2 степени родства — бабушка, внучка, двоюродная сестра, тетя, племянница
Представленные эпидемиологические данные касаются эпителиальных злокачественных опухолей, т. е. рака яичников. В происхождении неэпителиальных опухолей (стромально клеточных и герминогенных), поражающих женщин преимущественно молодого возраста и детей, основная роль отводится неблагоприятным факторам в период эмбриогенеза. В развитии гранулезоклеточных опухолей также отмечена связь с гиперстимуляцией яичников кломифенцитратом или гонадотропинами при лечении бесплодия. По мнению Wiliemsen [S8], гиперстимуляция, возможно, способствует росту уже существующей опухоли или же возросший уровень фолликулостимулирующего гормона индуцирует канцерогенез в гранулезоклеточной ткани, хотя не исключается и случайное совпадение.
1.3. ПАТОГЕНЕЗ
Эпителиальные опухоли составляют 60% всех новообразований яичников и 80-90% их злокачественных форм. Остальные опухоли возникают из зародышевых и стромальных клеток. Эпителиальные опухоли развиваются из покровного эпителия яичников, т. е. из серозы. В течение эмбриогенеза выстилка целомической полости состоит из мезотелиальных клеток мезодермального происхождения, при этом гонадный валик покрыт серозным эпителием. Мюллеровы протоки, которые дают начало фаллопиевым трубам, матке и влагалищу, являются результатом инвагинации мезотелиальной выстилки. Клетки эпителиальных опухолей могут напоминать различные варианты дифференцировки мюллеровского типа. Серозные опухоли могут иметь сходство с фаллопиевой трубой, муцинозные — с эндоцервиксом, эндометриоидные — с эндометрием. Клетки герминогенных (эмбриональных) опухолей развиваются из зародышевых клеток, мигрирующих в гонады. Мезенхима является источником развития стромы яичника, и стромально клеточные опухоли развиваются из этих клеток.
Согласно овуляторной гипотезе возникновения эпителиальных опухолей, циклическая пролиферация покровного эпителия при непрерывных овуляторных циклах ведет к формированию кист включения. В дальнейшем под влиянием различных гормонов, вырабатываемых в строме яичника, пролиферирующие эпителиальные клетки могут формировать аденомы. Высокий уровень гонадотропинов также может обладать стимулирующим эффектом на пролиферирующий эпителий. Однако остается спорным, что цистаденомы являются предшественниками опухолей с низкой степенью злокачественности (пограничных), которые, в свою очередь, развиваются в инвазивные формы эпителиальных карцином. Последние молекулярно-генетические исследования выявили, что гистологически доброкачественные кисты с очагами малигнизации имели мутации гена р53, ответственного за супрессию опухоли, тогда как в доброкачественных опухолях без очагов малигнизации не было отмечено мутации гена р53 [96]. Тем не менее, пограничные опухоли также не имели мутации р53 [76]. Исследователи полагают, что часть цистаденом генетически предрасположены к развитию инвазивной злокачественной опухоли, а молекулярно-генетическое поведение пограничных опухолей имеет другой характер.
В большинстве случаев злокачественного течения эпителиальных опухолей яичников диссеминация происходит путем эксфолиации опухолевых клеток с поверхности пораженной яичниковой ткани с током внутрибрюшинной жидкости по всей брюшной полости, поражая париетальную и висцеральную брюшину, преимущественно правую половину диафрагмы и капсулу печени. Кроме того, сальник является излюбленным местом метастазирования рака яичников. Лимфогенные метастазы встречаются чаще при уже распространенном раке яичника в брюшной полости. Однако у 10-20% больных с локализованными формами рака яичников могут быть метастазы в забрюшинных лимфатических узлах [58]. Метастазирование в парааортальные лимфатические узлы осуществляется через подвешивающую связку яичника, в тазовые — через широкую связку и параметрии, в паховые — через круглую связку. Лимфогенное метастазирование как первый этап диссеминации более характерен для герминогенных опухолей. Наряду с нарушением нормального оттока лимфы с увеличением проницаемости канцероматозно измененной брюшины появляется асцит, в дальнейшем присоединяется плеврит, чаще правосторонний. У 2-3% больных возможно гематогенное метастазирование с поражением печени, костей, головного мозга. Не исключается прямое прорастание опухоли яичников в ректо-сигмоидный отдел кишки, мочевой пузырь.
Приблизительно 27 % всех злокачественных опухолей женских половых органов — это рак яичников (РЯ), 53 % летальных исходов от рака женских половых органов приходится именно на эту его локализацию. Это четвертая причина смертности от онкологических заболеваний у женщин в США.
Столь же высокое место в структуре женской смертности злокачественные опухоли яичников занимают в Канаде, Новой Зеландии, Израиле и странах Северной Европы. В США эта патология развивается приблизительно у 14 из 1000 женщин старше 40 лет, но вылечить удается только 4.

Заболеваемость раком различных локализаций у женщин США
У остальных в связи с прогрессированием опухолевого процесса будут наблюдаться повторяющиеся эпизоды кишечной непроходимости, которые приведут к дефициту питания, кахексии и смерти. В обзоре тенденций смертности в США летальность от РЯ в зависимости от возраста за 1975—2002 гг. повысилась, что отражает увеличение и старение популяции. За последние 30 лет смертность женщин моложе 65 лет снизилась, а у более старших — увеличилась, с некоторой стабилизацией показателей за последние 10 лет.
Это можно объяснить применением пероральных контрацептивов молодыми женщинами, а также смещением кривой выживаемости вправо. У пожилых пациенток выживаемость хуже при любой стадии рака яичников (РЯ). Некоторые объясняют это менее активным применением хирургического и химиотерапевтического лечения у данной категории больных. Смертность, стандартизованная по возрасту, у белых женщин выше, чем у чернокожих.
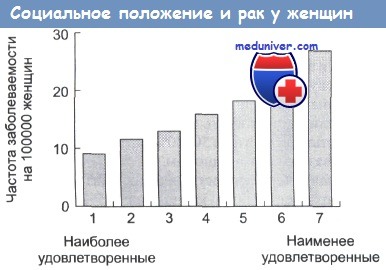
Частота заболеваний раком у женщин различных категорий, отобранных в соответствии с критериями психологической неудовлетворенности по Карстейру.
Эти критерии соответствуют социально-экономическому положению, которое личность занимает в обществе.
У азиаток, уроженок островов Тихого океана, представительниц коренных народностей Америки (индейцы, алеуты, эскимосы) и латиноамериканок показатели смертности ниже, чем у чернокожих.
Злокачественные опухоли яичников возникают в любом возрасте, включая младенческий и детский. Смертность от новообразований яичников у детей и подростков в США незначительно ниже, чем от лейкоза, лимфом, опухолей ЦНС, почек, соединительной ткани и костей. Основные гистологические типы опухолей яичников характерны для определенного возраста.

Злокачественные герминогенные новообразования обычно возникают у женщин моложе 20 лет, а рак яичников (РЯ) — в возрасте старше 50 лет. В возрасте 45—49 лет заболеваемость составляет 16,4 случая на 100 000 женщин, затем резко возрастает: в возрасте старше 60 лет более чем в 2 раза — до 40 на 100 000. Самые высокие цифры отмечают в 65—85 лет, с пиком заболеваемости в 80—84 года (61 случай на 100 000).
Наибольшее количество случаев рака яичников (РЯ) возникает в 60—64 года, более 1/3 случаев — в возрасте старше 65 лет. У пожилых женщин вероятность обнаружения поздних стадий заболевания выше, чем у более молодых; 5-летняя выживаемость в 2 раза ниже (28,4 vs 56,6 %).


Рак яичников.
Распределение злокачественных эпителиальных опухолей яичников по стадиям в зависимости от возраста.
Аннотация научной статьи по клинической медицине, автор научной работы — Набиева Ф.С.
В статье приведен обзор литературы по этиологии , распространению, диагностике и лечению злокачественных опухолей яичника. Намечены перспективы по ранней диагностике и лечению рака яичника
Похожие темы научных работ по клинической медицине , автор научной работы — Набиева Ф.С.
MODERN ASPECTS OF EPIDEMIOLOGY, ETIOLOGY AND DIAGNOSTICS OVARIAN CANCER (LITERATURE REVIEW)
This article provides an overview of the literature on the etiology , prevalence, diagnosis and treatment of malignant ovarian tumors. Prospects for the early diagnosis and treatment of ovarian cancer
ОНКОЛОГИЯ УДК: 616-006.66. 616-073.8. 615.849.12
СОВРЕМЕННЫЕ АСПЕКТЫ ЭПИДЕМИОЛОГИИ, ЭТИОЛОГИИ И ДИАГНОСТИКИ РАКА ЯИЧНИКОВ (ОБЗОР ЛИТЕРАТУРЫ)
НАБИЕВА ФИРУЗА CАЙФУЛЛОЕВНА ассистент кафедры онкологии
и лучевой диагностики Бухарский государственный медицинский институт
В статье приведен обзор литературы по этиологии, распространению, диагностике и лечению злокачественных опухолей яичника. Намечены перспективы по ранней диагностике и лечению рака яичника
Ключевые слова: рак яичников, у женщин молодого возраста, этиология, диагностика, цветное доплеровское картирование (ЦДК), опухоль ассоцированный маркер
MODERN ASPECTS OF EPIDEMIOLOGY, ETIOLOGY AND DIAGNOSTICS OVARIAN CANCER (LITERATURE REVIEW)
NABIYEVA FIRUZA SAYFULLOEVNA- assistant chair of oncology and radial diagnosis Bukhara State Medical Institute
This article provides an overview of the literature on the etiology, prevalence, diagnosis and treatment of malignant ovarian tumors. Prospects for the early diagnosis and treatment of ovarian cancer
Key words: ovarian cancer in young women, etiology, diagnostics, color Doppler mapping (CDM), a tumor marker of associated
Злокачественные опухоли репродуктивной системы: рак молочной железы и гинекологические опухоли (рак тела, шейки матки и яичников) -являются наиболее частыми в структуре онкологической заболеваемости женщин, и их суммарная доля превышает 35%. Рак яичников составляет 46% среди злокачественных опухолей у женщин и занимает седьмое место по частоте. По данным Международного агентства по изучению рака ежегодно в мире регистрируется более 165 тыс. новых случаев рака яичников, и более 100 тыс. женщин умирают от злокачественных опухолей яичников [9, p. 143].
Если удельный вес (%) рака яичников в онкологической заболеваемости женщин во всех странах мира примерно одинаков, то частота заболеваемости на 100 тыс. женского населения (%) значительно варьирует. В Европе, особенно в Северных странах и Великобритании, а также в Северной Америке стандартизованные показатели заболеваемости наиболее высокие (10 и более на 100 тыс.). В Центральной и Южной Америке, Африке и Азии, включая индустриальные страны, такие как Япония, но исключая Израиль, эти показатели значительнониже (7 и менее на 100 тыс.), За последние 20 лет уровни заболеваемости раком яичников в большинстве стран с высоким риском (Скандинавия, Великобритания,
США, Канада) остаются стабильными и даже несколько снижаются. В тоже
Электронный научный журнал « Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Электронный научный журнал « Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
• Большое количество сосудов в опухоли
• Извитый характер (тип строения) сосудов
• Преимущественно центральное расположение зон высокой васкуляризации в образовании
• Наличие кровотока в перегородках и солидных папиллярных разрастаниях опухоли
По мнению А.Киг|ак, в.Киреэю, всех авторов публикующих результаты своих работ по данной теме, можно разделить на три группы в зависимости от их отношения к диагностическим возможностям ЦДК. К 1 -й группе относятся исследователи, получившие результаты, свидетельствующие о высокой чувствительности и специфичности ЦДК в дифференциальной диагностике опухолей яичников. К этой группе также относятся такие ведущие специалисты, как А.Ки^ак, Н.БсИи!тап, А.Р^эсИег, M.Kawai, Т.Воигпе. Авторы считают, что ЦДК дает точный ответ о наличии или отсутствии злокачественного процесса при неоднозначной картине
Электронный научный журнал « Ранняя стадия рака яичников (1-11А) 1. Хирургическое лечение как самостоятельный метод или как этап комбинированных мероприятий.
Стандартной операцией при раннем РЯ являются: • тотальная гистерэктомия, двухстороннее удаление придатков матки, экстирпация большого сальника. В обязательном порядке должно быть
выполнено цитологическое исследование перитонеальной жидкости и биопсия всех подозрительных на опухолевое поражение участков брюшины;
• тазовая и парааортальная лимфаденэктомия при недифференцированных опухолях;
• у молодых женщин для сохранения фертильности при пограничных или высокодифференцированных опухолях выполняется одностороннее удаление придатков матки без гистерэктомии и обязательная биопсия второго яичника. При нежелании пациентки сохранить фертильность выполняется радикальная операция в вышеуказанном объёме;
2. Адъювантная химиотерапия
До сих пор нет достоверных данных о проведении химиотерапии Основные принципы химиотерапии больных раком яичника:
• комбинированная химиотерапия более эффективна, чем монохимиотерапия;
• оптимальной комбинацией является сочетание препаратов платины с алкилирующими агентами (СР) и/или антрациклиновыми антибиотиками (САР) или препаратов платины с паклитакселом;
• цисплатин и карбоплатин в эквивалентных дозах (соотношение 1:4) обладают равной противоопухолевой активностью;
• оптимальным считается 4-6 циклов химиотерапии.
3. Лучевая терапия
Эффективность адъювантной наружной или внутрибрюшной лучевой терапии при раннем раке яичников не доказана и является предметом исследований.
> Местно-распространенный и диссеминированный рак
яичников III стадия
Электронный научный журнал « IV стадия
1. Хирургическое лечение
• возможна первичная циторедуктивная операция в том случае, если отдалённые метастазы проявляются плевральным выпотом, поражением надключичных лимфоузлов, единичным поражением кожи. Циторедуктивная операция нецелесообразна у больных с метастазами в печень и лёгкие;
• паллиативная операция может быть выполнена +больным, у которых проявляются клинические симптомы заболевания (например: признаки кишечной непроходимости) с целью облегчения состояния больной и улучшения качества её жизни.
При проведении паллиативной операции необходимо учитывать следующие факторы: медленный рост опухоли, чувствительность опухоли к химиотерапии, минимальный канцероматоз при первичной лапаротомии.
2. Системная химиотерапия при метастатической форме РЯ обязательна, так как её проведение достоверно увеличивает медиану продолжительности жизни и качество жизни больных.
Косвенные факторы, влияющие на эффективность химиотерапии:
• удовлетворительное общее состояние пациента;
Электронный научный журнал « Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
• длительный интервал без лечения;
• серозная гистологическая структура опухоли;
• минимальное число метастазов.
При диссеминированном РЯ в качестве первой линии химиотерапии предполагается проведение платиносодержащей схемы (СР или САР, или комбинация производных платины с паклитакселом). При достижении объективного лечебного эффекта (полная регрессия, частичная регрессия) проводится не менее 6-8 циклов.
> Рецидив рака яичника
1. Хирургическое лечение: возможно проведение вторичной циторедуктивной операции.
Этот вид оперативного лечения может быть стандартом в случае:
• локального рецидива, который появился спустя 12 мес или более после завершения химиотерапии;
• удовлетворительного состояния пациентки (высокий статус Карнофского);
• возможности полной резекции рецидива.
2. Системная химиотерапия
• в случае позднего рецидива опухоли (более 12 мес после первичного
лечения) возможно повторение схемы аналогичной той, которая
проводилась в адъювантном режиме (СР или САР, или препараты платины с паклитакселом);
• в случае раннего рецидива (менее, чем 8-12 мес после первичного лечения) рекомендуются препараты второй линии, такие как топотекан, этопозид, гемцитабин — [6].
Ещё с 1990-х годов при анализе нескольких исследований по адъювантной терапии определены некоторые неблагоприятные прогностические факторы для ранних стадий рака яичников. К ним относятся:
• Прорастание опухолью капсулы кисты или наличие опухолевых клеток в асцитической жидкости;
• Вскрытие капсулы опухоли при хирургических манипуляциях;
•Массивные сращения и спайки опухоли с окружающими тканями;
• Низкая дифференцировка (G3)
• Высокая экспрессия мутаций гена р53;
• Высокий уровень Ki-67 иHER-2-оэв neu;
Прогностические факторы, которые могут повлиять на результат лечения и на отдаленные результаты, намного больше. Исследование в этом направлении ещё продолжаются. В последние годы появляются работы по выявлению независимых факторов прогноза. Все больше обнаруживаются белки, которые участвуют в трансформации опухолевой клетки из нормальной, и их гиперэкспрессия может служить маркерами, предсказывающими более агрессивное течение заболевания. Открытие новых потенциальных прогностических маркеров поможет на начальном
этапе распределить пациенток в группы стратификации. Целью является выработка стратегий дальнейшего лечения в зависимости от принадлежности к той или иной группе. Итальянские авторы идентифицировали так называемый поверхностный антиген (Тгор-2) человеческие трофобластические клетки, который часто экспрессируется у пациенток с серозной папиллярной аденокарциномой яичников. С помощью реакции ПЦРв режиме реального времени был проведен анализ 104 свежезамороженных тканей рака яичников и 24 нормальных тканей яичников на экспрессию Тгор-2, и параллельно экспрессия изучалась иммунногистохимическим методом. Нарушение регуляции Тгор-2 белка было обнаружено только в опухолевых клетках и только при серозной аденокарциноме яичников. Высокая экспрессия белка Тгор-2 статистически достоверно коррелировалась с наличием асцита (р=0,04), с метастазами в забрюшинные лимфоузлы (р=0,04), также с укорочением времени до прогрессирования (р=0,02), и общей выживаемости (р=0,01). Высокая экспрессия белка Тгор-2 оказалась независимым прогностическим маркером укорочения общей выживаемости также и по результатами мультивариантного Сох регрессионного анализа (р=0,04; НК=2,-35; С1 95%=1.03-5,34). Прогностическая роль этого белка изучается на больших группах пациенток, и возможно будет его использование для селекции больных высокого риска. В предклинических исследованиях находится мышиное моноклональное антитело против Тгор-2 — [2, с.32].
Заключение: По показателям смертности рак яичников опережает рак тела матки и рак шейки матки, занимая 5-е место среди причин смерти от всех опухолей у женщин и 7-е место по частоте заболеваемости. Факторами риска для развития этой опухоли служат генетические факторы (мутации ВКСА или генов отвечающих за репарацию ДНК)
По сравнению с 1990-ми годами значительно увеличилось количество факторов, позволяющих предположить, каким будет ответ на лечение при раке яичников и каковы могут быть отдаленные результаты. Но многие из них требуют дальнейшего изучения. Таким образом, систематизация знаний рака яичников позволяет надеется на улучшение результатов диагностики и лечения этой опухоли. ЛИТЕРАТУРА
1. Ахмедова С.А. Совершенствование клинико-лабораторной концепции использования СА 125 у больных раком яичников: Дис. . канд. мед. наук. — М., 2003.
2. Диагностика и лечение рака яичников. Под редакцией В.А. Горбуновой 2011/
3. Злокачественные новообразования в России в 1998 г. (заболеваемость и смертность). Под ред. акад. В.И. Чиссова, проф. В.В. Старинского, канд. мед. наук Л.В. Ременник. М., 1999.
4. Клиническая онкогинекология под редакцией Ф. Дж. Дисаи, У.Т. Крисмана 2012 том 3
5. Новикова Е.Г., Батталова Г.Ю. Пограничные опухоли яичников,
6. Практическая онкогинекология: избранные лекции. Под редакцией А.Ф. Урменчеевой, С.А. Тюляндина, В.М.Моисеенко 2006.
7. Сергеева Н.С., Ермошина Н.В., Мишунина М.П. Использование опухолеассоциированных маркёров для диагностики и контроля за эффективностью терапии у больных с распространенным раком яичников // М.: МНИОИ им. П.А. Герцена, 2002.
8. Boume T.H., Campbell S., Reynolds K.M., et al. Screening for early familial ovarian cancer with transvaginal ultrasonography and color blood flow imaging.// Br. Med. J.-1993.-Vol. 306.-P. 1025.
9. Cancer Incidence in Five Continents.// IARC Sci Publ. Lyon.-1997.-Vol. 7.-P. 143
10. De Priest P.D., Varner E., Powell J., et al. The efficacy of sonographic morphology index in identifying ovarian cancer: a multic institutional investigation.// Gynecol. Oncol.-1994.-Vol. 55.-P. 174
11. Gagnon A. and Ye B. Discovery and application of protein biomarkers for ovarian cancer // cerr. Opin. Obstet. Gynecol. 2008- Vol. 20 -P.9-13
12. Kurjak A., Shalan H., Kupesic S., et al. An attempt to screen asymptomatic women for ovarian and endometrial cancer with transvaginal color and pulsed Doppler sonography.// J. Ultrasound Med.-1994.-Vol. 13.-P. 295
13. Nossov V. Amneus M., Su F. et al. The early detection of ovarian cancer: from traditional methods to proteomics. Can we really do better than serum CA-125? //Amer. J. Obstet Gynecol. — 2008. -Vol.199 — P.215-223.
14. Rustin G.J.S., Nelstrop A.E., Bentzen S.M. et al. The Gynecologic Oncology Group experience in ovarian cancer.// Annals of Oncology.-1999.-Vol. 10.-P. 1-7.
ФАРМАКОЛОГИЯ, ФАРМАКОГНОЗИЯ, ФИТОТЕРАПИЯ
УДК 547.791.7.615.7 ПРОИЗВОДНЫЕ 1,2,3-ТРИАЗОЛА ПЕРСПЕКТИВНЫЕ СОЕДИНЕНИЯ В СОЗДАНИЕ ОТЕЧЕСТВЕННЫХ НЕСТЕРОИДНЫХ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ
АБДУГАФУРОВ ИБРАГИМДЖАН АЗИЗОВИЧ
Доктор химических наук, Ташкентский химико-технологический институт, кафедра общей и неорганической химии, Ташкент.
E-mail: ibragimaziz@yandex. ru
Доктор химических наук, профессор, Андижанский сельскохозяйственный институт, кафедра физики и химии, Андижанская обл. Андижанский
