Д. Во всех перечисленных случаях
183. Для ВПЧ — инфекции характерно все перечисленное ниже, кроме:
o ВПЧ 16-18 типы с высоким онкогенным риском развития рака шейки матки
o Ацетобелого эпителия шейки матки (при расширенной кольпоскопии)
184. Для микроинвазивного рака шейки матки характерно все, кроме:
o Глубины инвазии до З ммю
o Диаметра опухоли на поверхности до 1см.
o Отсутствие метастазов в регионарные лимфоузлы
· Интактной базальной мембраны
o Возможности выполнять органосохраняющей операции
185.Опишите особенности кольпоскопической картины эктропиона:
A. белесые, четко отграниченные участки на фоне неизмененного
эпителия влагалищной части шейки матки, йоднегативные в пробе
Шиллера
Б. йоднегативный дефект эпителия влагалищной части шейки матки
B. белесые, четко отграниченные участки с мелкими темно-крас
ными точками, йоднегативные в пробе Шиллера
Г. посттравматический выворот слизистой оболочки канала шейки матки
Д. Участок влагалищной части шейки матки, покрытый цилиндрическим эпителием, плохо окрашивающийся йодом
Не нашли то, что искали? Воспользуйтесь поиском:
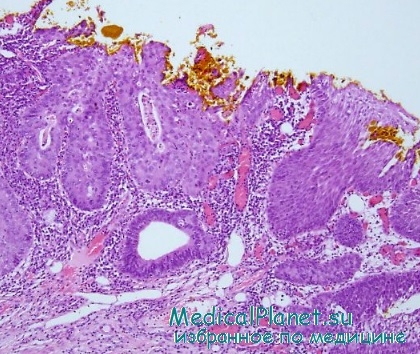
Микрокарцинома — относительно компенсированная и малоагрессивная форма опухоли, которая занимает промежуточное положение между внутриэпителиальным и инвазивным раком.
Микрокарцинома так же, как и рак in situ, является преклинической формой злокачественного процесса и поэтому не имеет специфических клинических признаков.
Колъпоскопия. Наблюдаются изменения влагалищной части шейки матки по типу атипического эпителия.
Цитологическое исследование. При микрокарциноме диагностируются признаки выраженной дисплазии и атипии клеточного фона.
Гистологическое исследование. Изучение микропрепаратов обнаруживает нарушение целостности базальной мембраны, внедрение в подлежащие слои отдельных опухолевых клеток и их групп; инвазия злокачественных элементов не превышает 3 мм.
Лечение. Методом выбора в лечении микрокарциномы является экстрафасциальная экстирпация матки, при наличии противопоказаний к оперативному вмешательству — внутриполостная 
— терапия. Широкая конизация для лечения преинвазивного рака применяется по совокупности показаний:
1) возраст моложе 40 лет;
2) ранняя стромальная инвазия (до 1 мм);
3) отсутствие опухолевых клеток в дистальных участках биоптата;
4) высокодифференцированная форма рака, ограниченная эктоцер-виксом;
5) возможность динамического, клинического, цитологического и кольпоскопического контроля.
Инвазивный рак шейки матки
Клиническая картина. Основные симптомы инвазивного рака — боли, кровотечение, бели. Боли локализуются в области крестца, поясницы, прямой кишки и нижних отделах живота. При распространенном раке шейки матки с поражением параметральной клетчатки и тазовых лимфатических узлов боли могут иррадиировать в бедро.
Кровотечение из половых путей возникает в результате повреждения легко травмируемых мелких сосудов опухоли (во время полового акта, Дефекации, подъема тяжести, влагалищного исследования).
Бели имеют серозный или кровянистый характер, нередко с неприятным запахом; появление белей обусловлено вскрытием лимфатических сосудов при распаде опухоли.
При переходе рака на мочевой пузырь наблюдаются частые позывы и учащенное мочеиспускание. Сдавление мочеточника приводит к образованию гидро- и пионефроза, а в дальнейшем — развитию уремии. При поражении опухолью прямой кишки возникает запор, в кале появляются слизь и кровь, формируются влагалищно-прямокишечные свищи.
Диагностика. Осмотр шейки матки в зеркалах. Обследование больных начинают с осмотра шейки матки в зеркалах. Для предотвращения травмирования органа, пораженного опухолью, шейку матки обнажают с помощью ложкообразного зеркала и подъемника.
При экзофитной форме раковой опухоли обнаруживаются бугристые образования красноватого цвета, с участками некроза, имеющими серый цвет.
Для эндофитной формы характерно увеличение и уплотнение шейки матки, изъязвление в области наружного зева.
Кольпоскопия. При экзофитной форме рака визуализируются образования желто-красного цвета с четко контурируемыми периферическими сосудами, имеющими штопорообразную форму. При эндофитной форме опухоль определяется в виде кратера с неровными краями и бородавчатым дном, покрытым некротическими массами.
Проба Шиллера не является специфичной для диагностики рака шейки матки, так как позволяет лишь дифференцировать нормальные и патологически измененные участки влагалищной части шейки матки.
Кольпомикроскопия способствует установлению полиморфности клеток и их ядер с беспорядочным расположением клеточных элементов. Цитологическое исследование обнаруживает большое количество атипических клеток.
Гистологическое исследование биоптата шейки матки имеет решающее значение в диагностике злокачественного процесса. Точность патоморфологического исследования зависит от способа получения материала для изучения. Поэтому биопсия должна проводиться целенаправленно под контролем кольпоскопии.
Метастазы рака шейки матки и их диагностика. Метастазирование рака шейки матки осуществляется преимущественно по лимфатической системе, в конечной стадии заболевания лимфатический путь распространения раковой опухоли может сочетаться с гематогенным. Для выявления метастазов рака шейки матки применяются хромолимфог-рафия, экскреторная урография, ректоскопия, компьютерная томография и ЯМР-спектроскопия.
Лечение инвазивного рака
Iб стадия — комбинированное лечение в двух вариантах: дистанционное или внутриполостное облучение с последующей расширенной экстирпацией матки с придатками или расширенная экстирпация матки с последующей дистанционной 
-терапией. При наличии противопоказаний к хирургическому вмешательству — сочетанная лучевая терапия (дистанционное и внутриполостное облучение).
II стадия — в большинстве случаев применяется сочетанный лучевой метод; хирургическое лечение показано тем больным, у которых лучевая терапия не может быть проведена в полном объеме, а степень местного распространения опухоли позволяет произвести радикальное оперативное вмешательство.
III стадия — лучевая терапия в сочетании с общеукрепляющим и дезинтоксикационным лечением.
IV стадия — симптоматическое лечение.
Прогноз при раке шейки матки индивидуальный и зависит от морфологического строения опухоли и стадии распространения злокачественного процесса. При выполнении соответствующих лечебных мероприятий пятилетнее выживание больных микрокарциномой составляет 80—90%, I стадией рака шейки матки — 75-80%, II стадией — 60%, III стадией — 35-40%.
Лечение больных раком шейки матки, сочетающимся с беременностью. При выборе тактики лечения беременных с раком шейки матки принимается во внимание, что беременность стимулирует рост злокачественных клеток.
Обнаружение преинвазивного рака в I триместре беременности является показанием к ее прерыванию с обязательным выскабливанием шеечного канала и последующей конизацией шейки матки; во II и III триместрах возможно сохранение беременности до срока родов с динамическим кольпоскопическим и цитологическим контролем.
При Iб и II стадиях рака в I и II триместрах проводится расширенная экстирпация матки с придатками с последующей лучевой терапией; в III триместре беременности лечению рака шейки матки предшествует кесарево сечение.
Больным III стадией рака в I и II триместрах проводится прерывание беременности или ампутация тела матки с последующей лучевой терапией; в III триместре беременности — кесарево сечение, ампутация тела матки, сочетанная лучевая терапия.
Дата добавления: 2018-04-15 ; просмотров: 512 ;
Возможно, в онкогинекологии нет более дискуссионной области, чем проблема диагностики и лечения микроинвазивного рака шейки матки. Эволюция взглядов на эту проблему, а порой и принятие революционных решений берут начало с 1947 г., когда Mestwerdt заметил, что инвазивный рак шейки матки, диагностированный только благодаря гистологическому исследованию, может быть излечен с помощью нерадикального хирургического вмешательства. На протяжении последних трех декад определения микроинвазивного рака и протоколы лечения подвергались существенным изменениям.
Можно надеяться, что большинство из них были вызваны появлением новых данных и, следовательно, оказались логически обоснованными. Немало разногласий было вызвано тем фактом, что Международная федерация акушеров и гинекологов (FIGO) в 1960 г. внесла изменения в критерии ранней стадии инвазивного рака шейки матки после появившейся в печати новой информации о течении заболевания на этом этапе. Нельзя исключить и другие моменты, которые не способствовали устранению путаницы в этом вопросе. Через несколько лет было предложено 20 различных определений и 27 терминов для категории микроинвазивного рака шейки матки. Изменения внесли и в рекомендации по лечению, в результате чего при различной глубине инвазии выполняли и радикальные, и консервативные хирургические вмешательства.
В 1971 г. FIGO определила стадию Iа как преклинический рак шейки матки. Вполне очевидно, что преклинический инвазивный рак не должен иметь глубину инвазии более нескольких миллиметров и наибольший горизонтальный размер 10 мм и более. В 1973 г. SGO были приняты следующие критерии определения микроинвазивного рака шейки матки:
1) случаи интраэпителиального рака с сомнительной инвазией следует рассматривать как интраэпителиальный рак;
2) при микроинвазивном раке шейки матки глубина инвазии неопластического эпителия в строму составляет менее 3 мм от базальной мембраны в одном или нескольких участках при отсутствии опухолевых клеток в кровеносных и лимфатических сосудах.
Не все члены SGO были согласны с этим определением. Тем не менее в то время в США оно привнесло элемент количественной оценки микроинвазивного рака шейки матки и впоследствии служило руководством для многих врачей при выборе метода лечения. FIGO последовательно подчеркивает, что классификации всех злокачественных опухолей по стадиям служат для сравнения различных показателей и не должны применяться как руководство для лечения. В 1979 г. члены Японского общества акушеров и гинекологов (JSOG) согласились с определением SGO в целом, за исключением случаев сливающихся друг с другом поражений, которые они отнесли к стадии lb.
В 1985 г. FIGO впервые предприняла попытку описать стадию Iа рака шейки матки в количественном выражении с учетом морфологических особенностей. Стадия Ial была определена как самая ранняя форма инвазивного рака, при которой минимальные очаги инвазии можно установить только на основании гистологического исследования. При стадии Iа2 макроскопически различимая микрокарцинома не должна превышать 7 мм в горизонтальном распространении и 5 мм в глубину. Наличие опухолевых клеток в сосудах, венозных или лимфатических, не влияет на стадию. Это определение подверглось критике по нескольким причинам. Во-первых, несмотря на постулирование предельно допустимых значений глубины инвазии и размера опухоли, они не указаны для стадии Ial.
Поэтому оказалось сложным разделить больных на две под-стадии. Во-вторых, как уже указывалось, согласно FIGO, определение не должно применяться в качестве руководства для выбора метода лечения. Поэтому эксперты этой организации под одной и той же стадией объединяют больных с проникновением опухолевых клеток в сосудистое пространство и без него. Эти различия иллюстрируют разногласия, связанные со специфичностью данного определения.
На протяжении ряда лет для микроинвазивного рака шейки матки различные авторы в качестве критерия предлагали разный уровень глубины инвазии — от 1 до 3—5 мм и более. На размер поражения обратили внимание совсем недавно, и эта величина включена только в определение FIGO. Некоторые авторы настаивали на учете объема опухоли как основного критерия. В большинстве стран эта рекомендация признана непрактичной по причине дополнительных материальных затрат на вычисление этого показателя. Некоторые авторитетные специалисты исключают из рассматриваемой категории больных со сливающимися очагами опухолевого роста, хотя последнее понятие определено нечетко. Исследователи обращали внимание на степень дифференцировки опухоли как независимый прогностический показатель, однако сошлись во мнении, что он не имеет первостепенного значения. Как упоминалось выше, возможно, самым противоречивым аспектом определения микроинвазивного рака шейки матки остается вопрос о том, включать или нет в эту категорию больных с признаками поражения просветов лимфатических микрососудов. FIGO включает их в эту категорию, a SGO и JSOG исключают.
В 1994 г. FIGO приняла новое усовершенствованное определение микроинвазивного рака шейки матки. К стадии Ial относят опухоли с горизонтальным распространением не более 7 мм и глубиной инвазии до 3 мм, а к стадии 1а2 — опухоли того же диаметра, но с инвазией в строму на глубину 3—5 мм. Наличие опухолевых клеток в просвете лимфатических сосудов не исключает больную из этой стадии. Рецидивирование заболевания у больных этих двух подстадии, по-видимому, не должно превышать 1—2 %. Выживаемость при стадии Ial должна приближаться к 99 %, а при 1а2 — к 97— 98 %. Эта новая формулировка микроинвазивного РШМ позволяет оценить и определить наиболее адекватное лечение для различных подстадии, особенно 1а2.
Классификация стадии IA рака шейки матки:
Стадия Iа. Инвазию рака выявляют только при гистологическом исследовании. Инвазия в строму не превышает 5 мм, а горизонтальное распространение опухоли -7 мм и менее; в случае превышения этих параметров опухоль относят к стадии lb. Все большие очаги даже с поверхностной инвазией также относятся к стадии lb1.
Стадия Ia1. Инвазия опухоли в строму не более 3 мм, а наибольший горизонтальный размер не более 7 мм
Стадия Iа2. Инвазия опухоли в строму более 3 мм, но не более 5 мм, а ее наибольший горизонтальный размер не более 7 мм
Глубина инвазии не должна быть более 5 мм, считая от ба-зальной мембраны поверхностного или железистого эпителия, в зависимости от того, из чего происходит рак. Признаки поражения сосудов, венозных или лимфатических, не должны влиять на стадию.
Вовлечение сосудистого пространства не исключено из определения FIGO по нескольким причинам. Прежде всего, среди патологов имеются разногласия относительно возможности достоверной воспроизводимости результатов обнаружения этого явления. По крайней мере в одном исследовании было показано, что обнаружение опухолевых клеток в просвете капилляроподобных сосудов зависит от количества выполненных срезов и распространенности этого процесса. Артефакт, обусловленный сокращением тканей при фиксации препарата, может привести к гипердиагностике. Для того чтобы избежать этого, необходимо применять специальное окрашивание с целью верификации действительного вовлечения сосудов в опухолевый процесс.
Так, например, в одном исследовании после иммунопероксидазного окрашивания с применением Ulex Europaeus agglutinin 1 lectin (UEAI) из 32 случаев, в которых, согласно первичному заключению, присутствовали признаки поражения просветов сосудов, 10 были исключены. В комбинированном исследовании, охватывавшем 1004 больных в трех крупных медицинских центрах, Burghardt и соавт. определили, что частота инвазии ангиолимфатических пространств колебалась от 9 % в Мюнхене до 23 % в Эрлангене и 43 % в Граце. С накоплением опыта лечения микроинвазивного рака наметилась тенденция при поверхностной инвазии (0—3 мм) и у некоторых больных даже при глубине инвазии 3—5 мм чаще использовать консервативную терапию: конизацию шейки матки при необходимости сохранения репродуктивной функции или простую гистерэктомию.
В 1978 г. Lohe сообщил о 285 больных с микрокарциномой с начальной инвазией в строму (1-я группа) и 134 — с выраженной микрокарциномой (2-я группа). Опухоли с ранней стромальной инвазией в 1-й группе больных автор определил как изолированные поражения переменной формы с несомненными признаками инфильтрации, а сформированные микрокарциномы во 2-й группе пациенток — как истинно карциноматозные сливающиеся поражения с общим горизонтальным размером до 10 мм и глубиной инвазии до 5 мм. Автор пришел к выводу, что для гистологического диагноза двух видов микрокарцином, с начальной стромальной инвазией и уже сформированных, необходимо определять три размера опухоли.
Консервативные хирургические вмешательства — конизация шейки матки или простая гистерэктомия — были выполнены у 72 % больных в 1-й группе и у 41 % — во 2-й. После длительного наблюдения установлено, что никто из пациенток с начальной инвазией стромы не умер; у 3 больных во 2-й группе развились рецидивные опухоли, от которых они умерли. В более крупном наблюдении за 435 больными с выраженными микрокарциномами у 24 (5,5 %) развился рецидив заболевания. Используя свои критерии, Lohe предсказал вероятность метастазирования сформированных микрокарцином в лимфоузлы менее чем в 1 % случаев и практически полное их отсутствие в случаях ранней стромальной инвазии. Воусе и соавт. сообщили о больших группах пациенток с микроскопическими очагами инвазии (360 женщин) и скрытой инвазией (390 случаев). Большинство больных 1-й группы перенесли простую гистерэктомию и только 14 — конизацию. Через 5—15 лет после лечения от основного заболевания умерла только одна женщина. Большая часть больных 2-й группы, со скрытой инвазией, получили ЛТ.
Поражения этих пациенток характеризовались сливающимися массами неопластических клеток с глубиной инвазии более 5 мм. Из 390 больных этой группы 24 умерли через 5 лет. Benedet и соавт. сообщили о 180 больных микроинвазивным раком и бессимптомным инвазивным плоскоклеточным раком шейки матки. Этих больных обследовали кольпоскопически в течение 10 лет. Благодаря этому методу обследования адекватное лечение провели у 90 % больных бессимптомным инвазивным раком и у 84 % — микроинвазивным. Таким образом, чувствительность кольпоскопии была ниже при диагностике микроинвазивных поражений по сравнению с обнаружением бессимптомного инвазивного рака. Атипические сосуды, характерные для раннего инвазивного рака, часто трудно определить, т. к. они слабо выражены. Они лучше различимы после обработки шейки матки физиологическим раствором. Во многих случаях обработка уксусной кислотой способствует сокрытию сосудов за счет усиления рисунка белого эпителия. Австралийский ученый Ostor представил исчерпывающий обзор посвященных данной теме публикаций, которые появились в печати с 1976 г. Как патоморфолог он критически относился ко многим параметрам, которые ранее предлагались в качестве прогностических факторов.
Широкое применение массовых профилактических обследований с обязательным цитологическим скринингом открыло реальные возможности для выявления не только дисплазии и преинвазивного рака, но и начальных форм инвазивного рака. Еще сравнительно недавно ранней диагностикой считалось выявление РШМ в I клинической стадии (установленной до начала специального лечения).
В дальнейшем, однако, было показано, что у 16—20% таких больных к моменту выявления опухоли уже имеются метастазы в регионарных лимфатических узлах таза [Бохман Я. В., 1076]. Все изложенное позволило многим клиницистам заключить, что выявление клинически выраженных форм РШМ в I стадии нельзя считать ранней диагностикой.
Отмечается большое различие в частоте метастазирования микроинвазивного РШМ (стадия Iа). Если принять за критерий микроинвазивного рака глубину инвазии до 5 мм, то частота нахождения метастазов в удаленных при расширенной гистерэктомии узлах таза колеблется от 1,3 до 0,7 и далее 10%. Иными словами, при данных критериях опасность лимфогенного метастазирования остается реальной.
К середине 70-х годов четко обозначился нерешенный ключевой вопрос клинического течения микроинвазивного РШМ. Если вероятность лимфогенного метастазирования при глубине инвазии до 1 мм была признана минимальной, а при о мм — клинически значимой, то оставалось неясным, какова ситуация при глубине инвазии от 2 до 5 мм. Учитывая актуальность и особенно практическое значение получения объективных критериев для определения понятия микроинвазивного рака и индивидуализации лечения, указанная проблема стала предметом всестороннего исследования клиницистов шести стран СЭВ в 1974—1985 гг. (НРБ, ВНР, ГДР, ПНР. СССР, ЧССР).
По предложению научного общества акушеров и гинекологов ГДР, Iа стадия была разделена на 2 группы: глубина инвазии до 1 мм и 2—3 мм. Исходя из заметного нарастания частоты метастазирования при инвазии опухоли 4 и 5 мм, эти наблюдения по решению группы экспертов стран СЭВ были отнесены к стадии Ib. Таким образом, стадии Iа соответствуют наблюдения с инвазией до 3 мм, причем наибольший диаметр опухоли на ее поверхности не должен превышать 1 см, отсутствуют мультицентрические очаги роста и раковые эмболы в кровеносных и лимфатических сосудах стромы.

К 1980 г. участники исследования обобщили сведения о 1079 больных РШМ Iа стадии, подвергшихся расширенной экстирпации матки с удалением регионарных лимфатических узлов, причем метастазы в них были установлены всего у 1 % из них. Как полагают большинство исследователей [Koss, 1981; Dallenbach-Helweg, 1981; Stegner, 1981], РШМ в своем развитии проходит несколько фаз — от дисплазии различной степени выраженности к преинвазивному раку (когда атипия захватывает все слои эпителиального пласта) и, наконец, до инвазии.
Интересные биологические особенности микроинвазивного РШМ выявлены в исследованиях М. Л. Винокур (1984) и Н. И. Шуваевой (1985). Они обобщили клинико-морфологические данные, касающиеся 180 больных РШМ Iа стадии с инвазией не более 3 мм. Частота лимфогенного метастазирования составила 1,2%.
Отмечены 3 варианта развития микроинвазивного РШМ: в 67% — на фоне Са in situ, в 23% — дисплазии и Са in situ, в 10% — на фоне дисплазии. Высокодифференцированные формы микроинвазивного (плоскоклеточного ороговевающего) РШМ в 100% наблюдений локализуются в эктоцервиксе, умереннодифференцированного — и 80% и эктоцервиксе и в 20% — в эндоцервиксе, низкодифференцированного — от 34% [Винокур М. Л., 1984] до 72% [Burghardt, 1981] — в эндоцервиксе. Частота обнаружения раковых эмболов в кровеносных и лимфатических сосудах стромы при стадии Iа (инвазия до 3 мм) колеблется от 3,8% [Burghardt, 1972], 5% [Boges, 1970] до 14,5% [Musses, 1969].
Причины низких потенции микроинвазивного РШМ к лимфогенному метастазированию становятся более понятны при сопоставлении иммунологических и иммуноморфологических исследований [Бохман Я. В., 1976; Яцковская Н. Л., 1980; Винницкая В. К., 1983; Винокур М. Л., 1984; Шуваева Н. И., 1985]. Следует прежде всего заметить, что при комплексном исследовании Т-системы иммунитета не отмечается иммунодепрессии. Изучение стромы указывает на выраженную лимфоплазматическую инфильтрацию, которая препятствует или, во всяком случае, ограничивает рост и распространение микроинвазивного рака. Примечательно, что при инвазии более 3 мм лимфоплазмоцитарная инфильтрация стромы уменьшается.
В регионарных лимфатических узлах таза отмечается преобладание гиперплазии паракортикальной (тимусзависимой) зоны, которая заселяется клетками-киллерами, осуществляющими барьерную и защитную функции узлов. Таким образом, микроинвазивный рак — это еще относительно компенсированная и мало агрессивная форма опухоли, что сближает его с преинвазивным раком и отличает от стадии Ib. Установленные биологические особенности микроинвазивного рака послужили основанием для щадящих и органосохраняющих операций.
