Вам поставили диагноз: десмоидные фибромы?
Наверняка вы задаётесь вопросом: что означает этот диагноз?
Согласно современной гистологической классификации опухолей мягких тканей ВОЗ, десмоиды относят к группе фиброматозов – опухолеподобных фибропластических поражений неясного генеза. Своеобразие десмоидов заключается в том, что полностью лишённый микроскопических признаков злокачественности и никогда не дающие метастазов, они склонны к частому рецидивированною (нередко к многократному) и агрессивному местно-деструктирующему росту. Из-за этого диссонанса среди онкологов общепринята точка зрения о промежуточном положении десмоидов между доброкачественными и злокачественными опухолями. Предлагаем Вашему вниманию краткий, но очень подробный обзор десмоидных фибром.
Введение
Десмоидные фибромы — это опухоли мезинхимальной природы, которые относятся к классу пограничных опухолей так как не метастазируют, однако склонны к агрессивному местному росту и частому рецидивированию. Десмоидные фибромы (ДФ) могут развиваться из мышечно-апоневротических структур практически любой анатомической области тела, включая брюшную стенку, грудную стенку, конечности, шею, в ряде случаев наблюдается мультифокальный рост опухолей.
В зависимости от локализации выделяют:
— абдоминальные десмоидные фибромы (опухоли передней брюшной стенки)
— интраабдоминальные (опухоли забрюшинного пространства)
— экстраабдоминальные (опухоли туловища, конечностей)
— мультифокальные (множественные опухоли различных локализаций)
Статистика (эпидемиология)
Десмоидные фибромы представляют собой достаточно редкую патологию – их частота составляет 2-4 случая на 1 миллион человек в год и это менее 3 % от всех опухолей мягких тканей. Чаще всего заболевают люди в возрасте 20-40 лет.
Причины возникновения и факторы риска
Как правило, пациенты обращаются к врачу по поводу безболезненного опухолевого образования, болевые ощущения и другие симптомы обычно связаны с вовлечением в опухолевый процесс близлежащих структур. Большинство пациентов с десмоидными фибромами экстраабдоминальной локализации связывают появление опухоли с предшествующей травмой. Десмоидные фибромы абдоминальной локализации зачастую развиваются у женщин после беременности или кесарева сечения. Интраабдоминальные десмоидные фибромы чаще всего сочетаются с полипозом толстой кишки (синдрома Гарднера).
Диагностика
1) Морфологическая верификация опухоли при помощи выполнения трепан-биопсии или открытой биопсии.
2) Магнитно-резонансная томография или компьютерная томография опухоли. Эти исследования позволяют адекватно оценить распространенность опухолевого процесса, прилежание опухоли к магистральным сосудисто-нервным структурам, степень вовлечения прилежащих анатомических структур и как следствие сделать вывод о возможности проведения хирургического лечения.
3) Также всем пациентам с диагнозом десмоидная фиброма рекомендовано проведение колоноскоии для исключения полипоза толстой кишки.
Лечение:
Прогноз заболевания
Так как десмоидные фибромы не относятся к злокачественным опухолям, прогноз заболевания благоприятный. Проведение радикальной операции позволяет снизить риск рецидива.
Филиалы и отделения, в которых лечат десмоидные фибромы
Фиброматоз молочной железы является редким лицом, которое имитирует рак молочной железы на клинической и ультразвуковой основе. Только гистология предоставит диагноз, объективируя пролиферацию фузиформных клеток (фиброз и миофибробласт без ядерной атипии), расположенных в пучках, смешанных с коллагеновыми полосками, без эпителиального компонента. Дифференциальный диагноз в основном связан с метапластической карциномой фузиформной клетки. Эволюция строго локальна, с большой повторяющейся силой. Полное хирургическое удаление со здоровыми полями (до 3 см) — это выбор, лучевая терапия остается терапевтическим вариантом в дополнение к хирургии при неполных резекциях и в случае множественных рецидивов. В нашем случае и в обзоре литературы мы попытаемся сосредоточиться на диагнозе этого редкого лица и его управления, поскольку он будет определять прогноз.
Уничтоженный в первый раз в 1832 году, десмоидный фиброматоз является доброкачественной, мезенхимальной опухолью, развившейся из мускуло-апоневротических структур. Локализация молочной железы очень редка, некоторые авторы считают ее подгруппой саркомы мягких тканей и не проводят различия между агрессивным фиброматозом и фибросаркомой низкой степени.
30-летний не состоящий в браке пациент с терактэктомией год назад (опухоль правой стенки грудной клетки), анатомопатологический результат которого заключается в фиброматозе грудной стенки. Обследование обнаружило опухоль QSE правой груди, делая 3/2 см, болезненную, твердую и другую опухоль QSE левой груди, делая 2 / 1,5 см, без отвода или ниппельного выделения. Ультразвук груди + маммография: (1) аспект, указывающий на злокачественное поражение QSE левой груди, представляет собой билобальную массу с нерегулярными спикулированными контурами, классифицированными ACR5; (2) наводящий аспект подозрительного поражения QSE правого грубого классифицированного ACR4. Микробиопсия выявила гистологический вид, указывающий на десмоидный фиброматоз, не будучи исключительным, мы завершили иммуногистохимическое исследование в пользу десмоидного фиброматоза. У нее была двойная туберэктомия со здоровыми краями 3 см (рис. 1).
Подозрительные поражения, имитирующие рак молочной железы
Десмоидные опухоли молочной железы очень редки, до настоящего времени в медицинской литературе было зарегистрировано около 100 случаев. Частота, сообщаемая различными авторами, опухоли почек молочной железы, независимо от пола, не превышает 3,5% от волокнистых опухолей и 0,2% от всех опухолей молочной железы 3. Локализация молочной железы встречается в любом возрасте, максимум от 20 до 40 лет, что соответствует возрасту нашего пациента. Этот десмоидный фиброматоз груди также можно наблюдать у людей. Физиопатология является темной стороной этой патологии, это может быть результатом суммирования этих трех факторов: (1) инициирование клеточной пролиферации после травмы, случаи описаны после травмы или после операции на груди, как и для операций уменьшение груди [1, 4, 5] или после грудного протеза [6, 7]; (2) промоторный эффект половых гормонов: несколько аргументов в пользу этого эффекта в дополнение к гормональной зависимости от десмоидных опухолей, поскольку фиброматоз преимущественно встречается у многоплодных женщин во время беременности в контексте гипертрогенеза или при приеме оральных контрацептивов [8, 9]; (3) генетический ландшафт по причине регуляции роста фибробластов.
Возникновение фиброматоза может быть свидетелем семейной генетической аномалии. Действительно, описаны случаи изолированного многоцентрового семейного фиброматоза; или в рамках синдрома Гарднера, связывающего полипоз толстой кишки, пороки развития костей, эпидермоидные кисты и опухоли мягких тканей, включая десмоидные опухоли. В 1986 году REITAMO определил десмоидный синдром как сущность, связывающую фиброматоз с скелетными аномалиями (экзостозы, геодезии, плотность бедренной кости и нижней челюсти, сакрализация 5-го поясничного позвонка). Этот синдром является аутосомно-доминантным с переменной пенетрантностью [10].
Клинически эта опухоль проявляется в виде массового, твердого, переменного размера, обычно безболезненного периферического, может быть связана с кожным утолщением или ретракцией ниппеля. Радиологически у нас может быть не кальцинированная спикулированная масса в маммограмме, микро- или макрокальцификации встречаются редко, но в 1/3 случаев в маммографии не выявлено никакого поражения. Сонографический внешний вид соответствует твердой массе или microlobulée spiculated нерегулярных гипоэхогенной, можно даже объективно достиг грудных мышцы или межреберных, так что это поражение имитирует клиническую и радиологическая злокачественность. МРТ-МРТ не заинтересована в диагностическом назначении против нее, она может оценить расширение опухолей крупных поражений путем объективирования плохо контурированной массы, спикулированных изо-напряженных мышц, вариабельной интенсивности изо-гиперсинглаза Т2 и гетерогенной [11].
Гистологически это плохо определенное, звездное, твердое, беловатое поражение, макроскопически подражающее нео. Микроскопическое исследование показывает пролиферацию фузиформных клеток (фибро и миофибробластик без ядерной атипии), расположенных в пучках, смешанных с коллагеновыми полосками, без связанного эпителиального компонента. В иммуногистохимии клетки экспрессируют интенсивно и диффузно-гладкие мышцы актина, тогда как десмин выражается только в редких клетках (миофибробластический профиль). Очень часто наблюдается положительность для бета-катенина, которая обычно находится на уровне ядер. Рецепторы эстрогена и прогестерона не обнаруживаются иммуногистохимией в фиброматозе молочной железы, как и его внемаммарный гомолог, тогда как для этого были получены терапевтические ответы на гормональную терапию.
Дифференциальный диагноз в основном связан с метапластической карциномой веретена, потому что характерная экспрессия цитокератина иногда является фокальной, обнаруженной на участке резекции, который подтвердит диагноз. Он также возникает перед опухолью филлоды промежуточной агрессивности или злокачественные, перед фибросаркомой или миоэпителиальной карциномой или все еще перед фиброзным рубцом, поскольку они являются одними и теми же клетками веретена, но это воспалительный контингент, присутствующий в случае фиброзного рубца, который будет иметь значение. Особенность этого фиброматоза, независимо от места, является инфильтрацией соседней ткани
Лечение основано на полной хирургической резекции со здоровыми полями (до 3 см) [12, 13]. Частота рецидивов составляет от 18 до 29% (от 3 до 6 лет), возможна грудная вовлеченность мышц и ребер. У некоторых женщин рекомендуется мастэктомия в случае множественного рецидива, в случае опухоли большого объема или в случае трудности гистологического диагноза. Место радиотерапии очень противоречиво в литературе, его эффективность зависит от дозы, а также контроль опухоли составляет от 60 до 80% для общей вводимой дозы от 50 до 60 Гр. Также применяли другие адъювантные методы: противовоспалительную, антиэстрогенную и низкодозную химиотерапию.
Махровый фиброматоз является редким лицом, клинически и рентгенографически имитирующим рак молочной железы. Диагноз будет давать только гистология. Гистологически это соответствует доброкачественной фибробластической пролиферации, строго локальной эволюции, с большой рекуррентной способностью. Полное удаление со здоровыми пределами безопасности — это выбор.
Авторы не заявляют о каком-либо конфликте интересов.
Все авторы прочитали и утвердили окончательную рукопись.
Десмоидные опухоли – мягкие волокнистые новообразования, которые могут развиваться из мышечных структур по всему телу. Термин “десмоид”, был придуман Мюллером в 1838 году, это слово происходит от греческого desmos, что означает “похожий на сухожилие”. Десмоидные опухоли часто появляются как инфильтративные, хорошо дифференцированные образования из фиброзной ткани. Стоит также обратить внимание на то, что эти опухоли локально агрессивны. Этот аспект сделал лечение этих относительно редких опухолей сложной задачей.
Десмоидные опухоли. Эпидемиология
В целом, на десмоидные опухоли приходится 0,03% от всех новообразований. При наличии у пациентов семейного полипоза толстой кишки, распространенность десмоидных опухолей достигает 13%. Десмоидные опухоли встречаются в два раза чаще у женщин, чем у мужчин. Десмоидные опухоли чаще встречаются у лиц в возрасте 10-40 лет, но в медицинской литературе также были зафиксированы случаи, когда эти опухоли развивались у маленьких детей и у пожилых людей.
Десмоидные опухоли. Причины
Основные и точные причины развития десмоидных опухолей остаются еще неопределенными. Развитие этих опухолей может быть связано с травмой или гормональными факторами, или они могут иметь генетическую связь. Эндокринная этиология также была предложена некоторыми исследователями. Десмоидные опухоли наиболее часто появляются у молодых женщин во время или после беременности. Опухоли регрессируют во время менопаузы и после лечения тамоксифеном.
Синдром Гарднера характеризуется развитием колоректальных аденоматозных полипов. У человека с этим синдромом, эти полипы могут исчисляться сотнями а то и тысячами. В своё время, синдром Гарднера был расценен как отдельное заболевание, пока не был идентифицирован ген APC, мутации в котором были признаны в качестве основной причины развития синдрома Гарднера. Некоторые исследователи считают, что у лиц с этим синдромом существует генетическая предрасположенность к развитию десмоидных опухолей, независимо от типа мутаций в гене APC. Десмоидные опухоли развиваются у 10-15% у пациентов с синдромом Гарднера. Однако основные генетические факторы, не зависящие от мутаций в гене APC, которые могут играть важную роль в восприимчивости к десмоидным опухолям еще не были определенны.
Десмоидные опухоли. Патофизиология
Хотя десмоидные опухоли наиболее часто возникают из прямой мышцы живота женщин, в послеродовом периоде, они фактически могут возникнуть в любой скелетной мышце. Десмоидные опухоли имеют тенденцию проникать в соседние пучки мышц, часто захватывая их и вызывая их дегенерацию. Несмотря на то, что эти опухоли очевидно крепятся к мышцам, покрывающая их кожа является нормальной как функционально так и на внешний вид. Миофибробласты являются основным типом клеток из которых развиваются десмоидные опухоли.
Десмоидные опухоли. Фото


Экстраабдоминальная десмоидная опухоль

Десмоидная опухоль брюшной стенки.

Последний шаг хирургического вмешательства. Полное иссечение опухоли и установка полипропиленовой сетки в брюшной полости для фиксации структур.

Десмоидная опухоль коленного сустава

Интраоперационная картина удаления опухоли
Десмоидные опухоли. Симптомы и проявления
Хотя десмоидные опухоли могут возникать в любой скелетной мышце, они чаще всего развиваются в передней брюшной стенке и в плечевом поясе. Забрюшинные новообразования являются более распространенными у лиц с семейным полипозом, с синдромом Гарднера и у лиц прошедших абдоминальную хирургию.
Периферийные десмоидные опухоли
Периферийные десмоидные опухоли – упругие, гладкие и подвижные образования. Они часто придерживаются окружающих структур. Кожа, закрывающая эту опухоль, обычно не проявляет никаких подозрительных аспектов. Наличие такого нароста мягких тканей должно настороживать любого врача, это должно заставить его копаться глубже в истории семьи для поиска доказательств наличия у членов семьи семейного полипоза и синдрома Гарднера. Брюшные десмоидные опухоли встречаются редко и они могут дать о себе знать с постепенно возрастающим отеком ног. Очень редко, но десмоидные опухоли могут развиться в ногах.
Интраабдоминальные и экстра-брюшные десмоидные опухоли
Интраабдоминальные десмоидные опухоли, в некоторых случаях, могут развиваться в мочевом пузыре и в мошонке. Интраабдоминальные десмоидные опухоли остаются бессимптомными до тех пор, пока они не начнут рости и пока они не начнут проникать в близлежащие структуры. Симптомы со стороны кишечной, сосудистой систем, мочеточника или нервной системы, могут быть начальными проявлениями этой опухоли.
Десмоидные опухоли груди
Десмоидные опухоли молочных желез составляют только 0,2% от всех известных опухолей молочной железы, которые развиваются из мышечной фасции. Десмоидные опухоли могут имитировать рак молочной железы.
Десмоидные опухоли. Диагностика
- Иммуноокрашивание виментином и десмином полезно в различении опухоли и в дифференциальной диагностике десмоидных опухолей.
- Также желательно провести проверку гена APC на наличие мутаций.
- КТ и МРТ используются для диагностики и последующего наблюдения за десмоидными опухолями. С помощью этих методов также можно определить степень опухоли и ее инвазию в близлежащие структуры, особенно до хирургического удаления. МРТ превосходит КТ по качеству получаемых результатов.
- Биопсия
Десмоидные опухоли. Лечение
Первичная операция является самым успешным первичным методом лечения десмоидных опухолей. Остаточные послеоперационные положительные края отражают высокий риск развития рецидива.
У тех пациентов, которые отказываются от хирургии или которые не являются кандидатами на операцию, могут быть применены другие варианты лечения.
Лучевая терапия может быть использована в качестве средства лечения рецидива или в качестве первичной терапии, с помощью которой можно избежать хирургическую резекцию. Лучевая терапия может применяться в послеоперационном периоде, до операции, или в качестве единственного метода лечения.
Фармакологическая терапия с применением антиэстрогенов и ингибиторов простагландина также может быть применена.
В случаях рецидива экстра-абдоминальных десмоидных опухолей, при которых операция противопоказана, химиотерапевтическая комбинация из доксорубицина, дакарбазина и карбоплатина может оказаться очень эффективным методом. Интраабдоминальные десмоидные опухоли, как часть синдрома Гарднера, могут ответить на внутривенное введение доксорубицина и ифосфамида.
Агрессивная, широкая хирургическая резекция является основным методом выбора. Полное хирургическое иссечение десмоидных опухолей будет наиболее эффективным методом лечения. В некоторых случаях, это может потребовать удаления большого количества здоровой ткани. В обширных случаях к операции также может потребоваться адъювантная терапия в том числе химиотерапия и повторные операции. А в очень отдельных случаях, может потребоваться радикальная резекция с последующей немедленной реконструкцией пострадавшего региона.
Опыт показывает, что беременность не влияет на результаты хирургической операции.
Опухоли, которые развиваются в конечностях и в глубоких мягких тканях туловища имеют более высокий риск рецидива.
Для опухолей, которые не вызывают симптомов и не увеличиваются в размерах, некоторые врачи предпочитают выжидательный и наблюдательный подход.
Десмоидные опухоли. Прогноз
Несмотря на их доброкачественный гистологический внешний вид и незначительный метастатический потенциал, тенденция десмоидных опухолей к местной инфильтрации является существенной с точки зрения (1) деформации, заболеваемости и смертности и (2) потенциальной обструкции жизненно важных структур и органов.
Рецидив десмоидной опухоли развивается у около 70% пациентов. Положительный хирургический край является значительным фактором риска развития рецидива.
Для людей с синдромом Гарднера и с внутрибрюшными десмоидными опухолями прогноз может быть не самым лучшим. Пятилетняя выживаемость таких пациентов, с опухолью на стадии I, II, III, IV составляет 95%, 100%, 89%, и 76% соответственно. 5-летняя выживаемость пациентов с опухолью на стадии IV и с тяжелой болью, у которых размер опухоли более 10 см, составляет 53%.
Кроме того, из-за большого количества редких заболеваний, информация по некоторым расстройствам и состояниям может быть изложена только в виде краткого введения. Для получения более подробной, конкретной и актуальной информации, пожалуйста, свяжитесь с вашим персональным врачом или с медицинским учреждением.
Zorka Inic 1 , Gordana Pupic 1 , Marko Buta 1 , Merima Oruci 1 , Radan Dzodic 1,2
1) Институт Онкологии и Радиологии Сербии, Белград
2) Университет Медицинской Школы Белграда
В статье представлен клинический случай десмоидной опухоли молочной железы у 38-летней пациентки.
Материалы и методы. У 38-летней пациентки диагностирована опухоль в нижнемедиальном квадранте, в складке под левой молочной железой, с инфильтрацией мягких тканей и увеличенными подмышечными лимфатическими узлами. Клинически и радиографически опухоль была крайне подозрительна на рак.
Результаты. Приведены данные осмотра, ультрасонографии, маммографии и цитологического исследования опухоли, напоминающей рак молочной железы. Объем операции включал широкую резекцию нижнемедиального квадранта левой молочной железы с большой порцией большой грудной мышцы. Исследование замороженных срезов было неинформативно.
В этом клиническом примере гистологическое исследование не выявило рак молочной железы и возможное вовлечение кожи и большой грудной мышцы и подтвердило наличие фиброматоза без инфильтрации кожи и мышечной ткани. Это обусловило широкую резекцию молочной железы с чистыми краями резекции. В связи с подозрением на злокачественное поражение, клинически увеличенные лимфатические узлы I и II порядка в левой подмышечной области, подмышечная лимфаденэктомия была выполнена вместе с биопсией сторожевого лимфатического узла. Плановое гистологическое исследование показало фолликулярную дисплазию подмышечных лимфатических узлов.
Выводы. Фиброматоз молочной железы является крайне редкой патологией. Стандартное первичное лечение – хирургическое, когда оно возможно. Цель операции – получить чистые края резекции с сохранением функции и хорошим косметическим результатом. Принципы оперативного вмешательства включают резекцию единым блоком. Объем хирургического лечения различен, от широкой туморэктомии до радикальной мастэктомии с удалением грудной фасции и грудных мышц. Мы не рекомендуем выполнять подмышечную лимфаденэктомию до получения гистологического анализа биопсии сторожевого лимфатического узла, несмотря на наличие клинически суспициозной опухоли в молочной железе и увеличенных подмышечных лимфатических узлов.
Ключевые слова: десмоидная опухоль молочной железы, фиброматоз, сторожевой лимфатический узел.
Распространенность десмоидных опухолей молочной железы (агрессивного фиброматоза) составляет менее 0,2% первичных новообразований молочной железы [1, 2].
Фиброматоз – это инфильтративная пролиферация фибробластов и клеток мышечных волокон, не обладающая метастатическим потенциалом, но со склонностью к местному рецидивированию [3].
Десмоидная опухоль молочной железы является клинической дилеммой, поскольку клинически, по данным ультрасонографии, маммографии и цитологически ее трудно отличить от рака, и только гистологическое исследование может подтвердить диагноз. Лечение выбора – широкое иссечение с чистыми краями резекции 6.
В этой статье мы описываем 38-летнюю пациентку с опухолью в нижнемедиальном квадранте, в складке под левой молочной железой, с инфильтрацией мягких тканей и увеличенными подмышечными лимфатическими узлами. Клинически и радиографически опухоль была крайне подозрительна на рак. Новообразование было полностью иссечено с резекцией окружающей железистой тканью и клетчаткой с чистыми краями резекции. Мы, безусловно, превысили необходимый объем оперативного вмешательства в связи с клиническими и диагностическими подозрениями, но состояние пациента хорошее с отличными косметическими результатами, лечение прошло без каких-либо осложнений, без рецидива заболевания.
Пациентка 38 лет при самостоятельном осмотре обнаружила опухоль в левой молочной железе. У пациентки не было никаких оперативных вмешательств или травм в области груди. Семейный анамнез по злокачественным новообразованиям не отягощен.
При физикальном осмотре имелись признаки фиброзной дисплазии обеих молочных желез, выявлена опухоль около 1,5 см в диаметре, плотная, неподвижная, вовлекающая кожу и расположенная в складке под левой молочной железой, в нижнемедиальном квадранте, ближе к грудине. У пациентки имелись пальпируемые увеличенные лимфатические узлы I и II порядка в левой подмышечной области.
При ультрасонографии выявлена гетерогенная гипоэхогенная опухоль в складке под левой молочной железой, с неоднородным внутренним эхо и относительно нечеткими границами с затуханием кзади. Опухоль была диаметром 1,5 см, располагалась близко к грудной фасции, которая в других участках была гиперэхогенна и интактна (BI RADS 4-5).
При маммографии в нижнемедиальном квадранте левой молочной железы выявлено дольковое затемнение 16×8 мм.
Перед операцией выполнена лимфосцинтиграфия, коллоид с 99mTc вводили периареолярно. При лимфосцинтиграфии выявлен сторожевой узел в левой подмышечной области. В проекции внутренней грудной артерии фиксации радиоколлоида не было.
Пациентке выполнена широкая резекция нижнемедиального квадранта левой молочной железы с большой порцией большой грудной мышцы. Исследование замороженных срезов было неинформативно.
С помощью гамма-датчика верифицирован горячий лимфатический узел II уровня, который был удален через отдельный разрез и направлен на плановое гистологическое исследование. В связи с клинически увеличенными и суспициозными лимфатическими узлами в левой подмышечной области выполнена лимфодиссекция I и II уровней.
По данным гистологического исследования: фиброматоз молочной железы, опухоль 8×18×12 мм, хорошие края резекции и отсутствие элементов фиброматоза в краях резекции.
При иммуногистохимическом исследовании обнаружена положительная реакция на актин (рис.1), виментин (рис.2) и десмин, CD34 и CD 68, фолликулярная гиперплазия в лимфатических узлах (0/13) и сторожевом лимфатическом узле расценена как гистиоцитоз синусов и липоматоз лимфатических узлов.
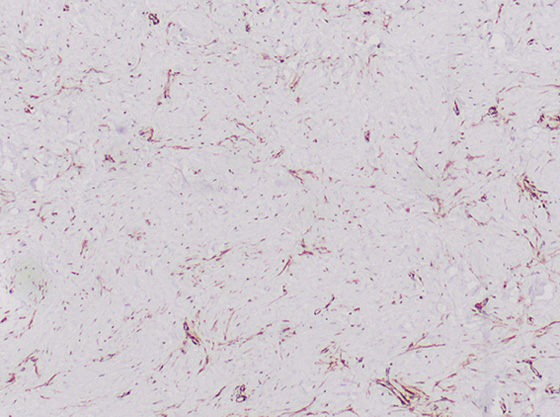
Рис. 1. Гистологическая картина: положительная реакция на актин (гематоксилин и эозин, x4).
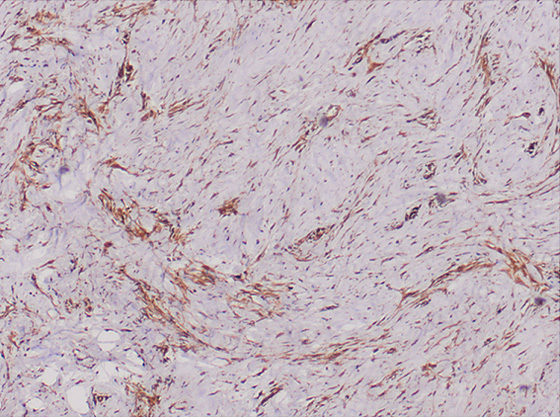
Рис. 2. Гистологическая картина: положительная реакция на виментин (гематоксилин и эозин, x4).
Десмоидная опухоль впервые была обнаружена MacFarlane в 1832 г. [7].
Десмоидные опухоли составляют примерно 0,03% всех новообразований и менее 3% всех опухолей мягких тканей.
Предположительная ежегодная заболеваемость в общей популяции составляет 2-4 на 1 млн. населения [8].
Причина развития десмоидных опухолей полностью не объяснена, но выявлена связь с семейным аденоматозным полипозом (синдром Гарднера), протезированием молочной железы и хирургической травмой. Десмоидные опухоли встречаются у 10-15% пациентов с семейным аденоматозным полипозом, заболеванием, наследуемым по аутосомному типу, обусловленным мутацией в гене APC [9].
Отсутствие мутаций генов H-ras, K-ras и N-ras и генов p53 в этих опухолях свидетельствует о том, что инактивация генов APC играет роль в индукции агрессивного роста десмоидных опухолях с наивысшей частотой рецидивирования. Это составляет важную часть молекулярного механизма образования десмоидных опухолей [10].
Несмотря на повышенную встречаемость у молодых женщин детородного возраста, десмоидные опухоли также обнаруживают у мужчин, но редко [11].
Избыток эстрогенов, например, во время беременности, считают значимым предрасполагающим фактором развития десмоидных опухолей [3, 11].
В десмоидных опухолях обнаруживают хромосомные аномалии, включая делецию хромосомы 5q [12, 13], потерю хромосомы Y [13], трисомию 8 [14] и трисомию 20 [15]. Считают, что трисомия 8, в частности, служит прогностическим фактором рецидива.
Фиброматоз молочной железы проявляется клинически как крайне серьезное солитарное поражение, которое в некоторых случаях вовлекает грудную фасцию за счет локальной инфильтрации [16]. Он может также вызывать втяжение соска и имитировать рак молочной железы [11].
Эти доброкачественные мезенхимальные опухоли, исходящие из мышечной фасции или апоневроза, хотя и не обладают метастатическим потенциалом, но могут быть местно-агрессивными с частотой рецидивирования 23-40% [17].
Радикальное первичное хирургическое лечение играет важную роль для длительного контроля заболевания, при этом обязательны точная предоперационная диагностика и хорошо спланированная операция [18].
Наиболее эффективный метод лечения десмоидных опухолей – полное иссечение. Повторное иссечение рецидивных опухолей оправдано.
Высокодозная лучевая терапия также эффективна для контроля рецидива заболевания и также может подходить для первичного лечения, когда это служит единственной альтернативой калечащей операции [19].
В 1928 г. Ewing был первым, кто в качестве контроля десмоидных опухолей применил лучевую терапию [20].
Помимо лучевой терапии, к другим возможным методам лечения нерезектабельных опухолей или при необходимости удаления прилежащих структур относят гормональную терапию, лечение цитостатиками и противовоспалительными препаратами [11].
Ясно, что многие авторы высказываются в пользу ранней диагностики и широкого иссечения фиброматоза, ограниченного молочной железой и не вовлекающего соседние структуры грудной полости. Эта местная хирургическая стратегия приведет к излечению огромного числа пациентов с фиброматозом только молочной железы и может помочь избежать необходимости дальнейшей радикальной резекции для получения чистого края [21].
В этом клиническом примере гистологическое исследование не выявило рак молочной железы и возможное вовлечение кожи и большой грудной мышцы и подтвердило наличие фиброматоза без инфильтрации кожи и мышечной ткани. Это обусловило широкую резекцию молочной железы с чистыми краями резекции. В связи с подозрением на злокачественное поражение, клинически увеличенные лимфатические узлы I и II порядка в левой подмышечной области, подмышечная лимфаденэктомия была выполнена вместе с биопсией сторожевого лимфатического узла. Плановое гистологическое исследование показало фолликулярную дисплазию подмышечных лимфатических узлов.
Мы, безусловно, превысили необходимый объем лечения нашей пациентки, но у нее нет каких-либо осложнений после подмышечной лимфаденэктомии, получен отличный косметический результат (рис. 3).
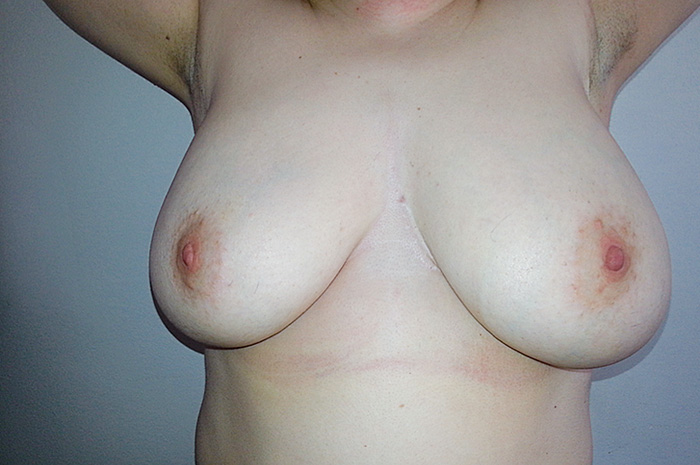
Рис. 3. Отличный косметический результат после операции.
Фиброматоз молочной железы является крайне редкой патологией. Стандартное первичное лечение – хирургическое, когда оно возможно. Цель операции – получить чистые края резекции с сохранением функции и хорошим косметическим результатом. Принципы оперативного вмешательства включают резекцию единым блоком. Объем хирургического лечения различен, от широкой туморэктомии до радикальной мастэктомии с удалением грудной фасции и грудных мышц. Мы не рекомендуем выполнять подмышечную лимфаденэктомию до получения гистологического анализа биопсии сторожевого лимфатического узла, несмотря на наличие клинически суспициозной опухоли в молочной железе и увеличенных подмышечных лимфатических узлов.
Нашей пациентке выполнена широкая (en bloc) резекция с удалением части грудной фасции и порции большой грудной мышцы. Пациентка находилась под динамическим наблюдением в течение 3 лет, у нее отсутствуют признаки рецидива, получен отличный косметический результат.
- Neuman HB, Brogi E, Ebrahim A. Desmoid tumors (fibromatoses) of the breast: a 25-year experience. Ann Surg Oncol 2008; 15: 274-80.
- Devouassoux-Shisheboran M, Schammel MD, Man YG, Tavassoli FA. Fibromatosis of the breast: age-correlated morphofunctional features of 33 cases. Arch Pathol Lab Med 2000; 124: 276-80.
- Basak Erguvan-Dogan, Peter J Dempsey, Geetha Ayyar, Michael Z. Gilcrease. Primary desmoid tumor (extraabdominal fibromatosis) of the breast. AJR 2005; 185(2): 488-9.
- Stephen P Povoski, Rafael E Jimenez. Fibromatosis (desmoid tumor) of the breast mimicking a case of ipsilateral metachronous breast cancer. World J Surg Oncol 2006; 4: 57 doi:10.1186/1477-7819-4-57.
- Ng WH, Lee JS, Poh WT, Wong CY. Desmoid tumor (fibromatosis) of the breast. A clinician’s dilemma – a case report and review. Arch Surg 1997; 132(4): 444-6.
- Winnie Yeo, Peter Teo, Wing Kwan, Michael Suen. Desmoid tumor mimicking local recurrence of carcinoma of the breast. Int J Clin Oncol 1998; 3(1): 49-51.
- McFarlane J. Clinical report of the surgical practices of Glasgow Royal Infirmary. Glasgow: Roberson, 1832; 63-6.
- Reitamo JJ, Häyry P, Nykyri E, Saxén E. The desmoid tumor. I. Incidence, sex-, age- and anatomical distribution in the Finnish population. Am J Clin Pathol 1982; 77: 665.
- Brueckl WM, Ballhausen WG, Förtsch T, Günther K, Fiedler W, Gentner B, Croner R, Boxberger F, Kirchner T, Hahn EG, Hohenberger W, Wein A. Genetic testing for germline mutations of the APC gene in patients with apparently sporadic desmoid tumors but a family history of colorectal carcinoma. Dis Colon Rectum 2005; 48(6): 1275-81.
- Michiko Miyaki, Motoko Konishi, Rei Kikuchi-Yanoshita, Masayuki Enomoto, Kiyoko Tanaka, Hiromi Takahashi. Coexistence of somatic and germ-line mutations of apc gene in desmoid tumorsfrom patients with familial adenomatous polyposis. Cancer Res 1993; 53, 5079-82. Advances in Brief.
- Torres Sousa MY, Arias Ortega M, Rozas Rodríguez ML, Murillo Lázaro CM. Fibromatosis of the breast in a 52-year-old man. Eur Radiol 2011; 21(7): 1575.
- Wara WM, Phillips TL, Hill DR, Bovill EG, Luk KH, Lichter AS, Liebel SA. Desmoid tumors. Treatment andprognosis. Radiology 1977; 124: 225-6.
- Dangel A, Meloni AM, Lynch HT, Sandberg AA. Deletion(5q) in a desmoid tumor of a patient with Gardner_syndrome. Cancer Genet Cytogenet 1994; 74: 94-8.
- Bridge JA, Sreekantaiah C, Mouron B, Neff JR, SandbergAA, Wolman SR. Clonal chromosomal abnormalities indesmoid tumors. Cancer 1992; 69: 430-6.
- Fletcher JA, Naeem R, Xiao S, Corson JM. Chromosome aberrations in desmoid tumors. Cancer Genet Cytogenet 1995; 79: 139-43.
- Appelbaum AH, et al. Mammographic appearances of male breast disease. Raiographics 1999; 19: 559-68.
- Pajares B, Torres E, Jiménez B, Sevilla I, Rodríguez A, Rico JM, Trigo JM, Alba E. Multimodal treatment of desmoid tumours: the significance of local control. Clin Transl Oncol 2011; 13(3):189-93.
- Mátrai Z, Tóth L, Szentirmay Z, Vámos FR, Klepetko W, Vadász P, Kenessey I, Kásler M. Sporadic desmoid tumors of the chest: long-term follow-up of 28 multimodally treated patients. Eur J Cardiothorac Surg 2011; 40(5): 1170-6. Epub 2011 Mar 23.
- Easter DW, Halasz NA. Recent trends in the management of desmoid tumors. Summary of 19 cases and review of the literature. Ann Surg 1989; 210(6): 765-9.
- Ewing J. Neoplastic Diseases. 3rd ed. Philadelphia: W.B. Saunders, 1928.
- Stephen P Povoski, William L Marsh, Dimitrios G Spigos, Abbas E Abbas, Brentley A Buchele. Management of a patient with multiple recurrences of fibromatosis (desmoid tumor) of the breast involving the chest wall musculature. World J Surg Oncol 2006; 4: 32 doi:10.1186/1477-7819-4-32.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
