Рак — это заболевание, вызванное генетической мутацией или эпигенетическими модификациями на уровне транскрипции. Диагностика заболеваний на ранней стадии — это сложный шаг, который необходимо предпринять для улучшения результатов выживания пациентов. Последние успехи возродили интерес и закончились разработкой различных потенциальных биомаркеров. Биомаркеры рака включают ДНК, РНК, белки, липиды, сахара, мелкие метаболиты, цитокинетические и цитогенетические параметры и все опухолевые клетки, обнаруженные в различных жидкостях организма. Биомаркеры должны быть тщательно исследованы для точной диагностики болезни и для помощи в разработке таргетной терапии для улучшения результатов заболевания.
Эпигенетика достаточно молодая наука, которая изучает изменения в экспрессии генов или фенотипа клеток, вызванных механизмами, не затрагивающими последовательность ДНК.
Метилирование ДНК и модификации гистонов считаются основными эпигенетическими механизмами 3. Они играют жизненно важную роль в таких процессах как репликация, транскрипция и восстановление ДНК. Следовательно, изменения генома или аномальная экспрессия различных регуляторов могут вызывать выраженный эффект, приводящий к индукции рака [6,7].
В генах, которые ингибируют развитие опухолевых образований, есть зона промотора с CpG-островками. Гиперметилирование таких островков является важным механизмом инактивации генов. Гипометилирование способствует росту различных типов злокачественных новообразований 9.
Метилирование ДНК связано со многими ключевыми процессами, такими как инактивация теломер, центромер, Х-хромосом и подавление повторяющихся элементов, геномный импринтинг и канцерогенез. Существует два типа аномального метилирования ДНК, связанного со злокачественными новообразованиями человека. Глобальное гипометилирование часто связано с нестабильностью хромосом и потерей импринтинга, тогда как гиперметилирование происходит на островках CpG, расположенных в зонах промотора, и часто связано с инактивацией генов-супрессоров опухолей 20.
Эпигенетические аберрации оказывают влияние на стадии развития опухоли, что в конечном итоге способствует росту и дифференцировки опухолевых клеток. Определение этих изменений может быть использовано в качестве прогностических биомаркеров для диагностики рака в начале заболевания. Эти биомаркеры будут полезны для выявления пациентов, злокачественные новообразования которых чувствительны к препаратам. Кроме того, они могли бы дать гарантию того, что у пациентов будут положительные результаты от новых средств, нацеленных на онкогены 21.
Открытие новых биомаркеров является сложным шагом в исследовании рака. Биомаркер – это биологический объект, обнаруженный в тканях, крови или других биологических жидкостях, который указывает на нормальное или ненормальное течение заболевания 35. Разработаны различные типы биомаркеров рака для скрининга пациентов, находящихся в группе риска, или для обнаружения определенного типа рака или для прогнозирования результатов лечения опухоли или для подбора специфической лекарственной терапии 56.
Биомаркеры в основном подразделяются на три категории. Диагностические и прогностические биомаркеры относятся к количественным признакам, которые помогают врачам лучше всего подобрать терапию. Эти биомаркеры существуют в различных формах; биомаркеры включают в себя оценку пациентов с помощью радиологических методов и использование опухолеспецифических антигенов. Высокоэффективное секвенирование ДНК, масс-спектрометрия и ДНК-микролинейка — прогресс в технологиях изучения генома человека. Все это привело к развитию биомаркеров, связанных с выявлением рака, путем сравнения последовательности и уровня экспрессии ДНК, РНК и белка. Генетические и геномные методологии, например, исследование картины экспрессии генов, полученной с помощью технологии ДНК-микролинейки, играют важную роль в диагностике и прогнозировании рака и многих других заболеваний 58.
Онкология — это группа заболеваний, которая включает генетические модификации, такие как точечные мутации, генные перестройки и амплификации генов, приводящие к изменениям в молекулярных путях, регулирующих рост клеток, выживание и метастазирование 68. Когда эти типы изменений появляются среди большого числа пациентов, имеющих определенный тип опухоли, то такие изменения могут быть использованы в качестве биомаркеров для определения терапии [71,72].
Биомаркеры, основанные на антигенах.
Опухоль выделяет небольшое количество макромолекул во внеклеточную жидкость, из которой некоторые белки попадают в кровоток и сохраняются там некоторое время. Они выделяются из сыворотки и работают в качестве потенциальных биомаркеров [73, 74].
Простат-специфический антиген (ПСА)
Простат-специфический антиген (ПСА), вероятно, является наиболее широко распространенным биомаркером при диагностике рака предстательной железы. Он относится к семейству генов Калликреин и продуцируется как нормальными, так и злокачественными эпителиальными клетками предстательной железы. ПСА находится в небольших количествах в сыворотке нормальных мужчин и повышается при раке предстательной железы 76.
Альфа-фетопротеин (АФП) — это известный диагностический биомаркер, используемый при диагностике гепатоцеллюлярной карциномы (ГЦК). Но он не является специфическим для выявления ранних стадий гепатоцеллюлярной карциномы. Это основной сывороточный фетальный белок, обнаруженный у млекопитающих. Он активно продуцируется и секретируется гепатоцитами. В связи с тем, что уровни АФП могут повышаться в сыворотке у пациентов с другими хроническими заболеваниями печени; АФП не может использоваться для скрининга у пациентов, страдающих гепатитом C или циррозом [80,81].
Антиген рака-125 (CA125)
CA-125 антиген, как известно, является основным маркером в сыворотке крови, используемым для диагностики рака яичников, для прогноза, ответа на химиотерапию и прогрессирование болезни. Антиген CA 125 является мембранным гликопротеином, который находится в целомическом эпителии и экспрессируется большинством видов эпителиального рака яичников. Основным недостатком использования маркера CA125 в качестве инструмента для скрининга является его низкая чувствительность и эффективность при диагностике ранних стадий онкопроцесса. Он также может быть повышен при других злокачественных новообразованиях, в том числе при раке легких, раке фаллопиевых труб, раке молочных желез, раке эндометрия и желудочно-кишечного тракта 85.
Тироглобулин (Tg) является органо-специфическим опухолевым маркером; связанным с пациентами, имеющими дифференцированный рак щитовидной железы, источник которого фолликулярные клетки. При раке щитовидной железы уровень тиреоглобулина в крови нарастает. Он считается гликопротеином большого размера, хранящимся в коллоиде фолликулов щитовидной железы, который действует как прогормон в синтезе тироксина (Т4) и трийодтиронина (Т3) в щитовидной железе 89.
Белок теплового шока (Hsp)
Белок теплового шока (Hsp) приобрел значение из-за влияния на прогрессирование опухоли и ответа на лечение. Это привело к развитию таргетной терапии путем использования Hsp в качестве иммунологического адъюванта в противораковых вакцинах. Экспрессия белков теплового шока (Hsp) усиливается при различных раковых заболеваниях. Кроме того, они участвуют в процессах, связанных с клеточным циклом. Обычно патологические процессы связаны со стимуляцией индуцирования Hsp физиопатологическими особенностями микроокружения опухоли 94.
Хорионический гонадотропин человека (hCG)
Хорионический гонадотропин человека (hCG) является гормоном, в норме продуцируемым плацентой. Кроме того, его концентрация повышается в крови пациентов с определенными видами рака яичников, яичек и хориокарциномой. Повышение уровня ХГЧ и его метаболитов в сыворотке нельзя рассматривать в качестве прогностического маркера, поскольку, по результатам исследований, βhCG может непосредственно изменять рост опухоли, что приводит к худшему результату. У беременных уровень ХГЧ всегда повышен, поэтому при данном состоянии он не может быть использован в качестве маркера онкологии 99.
Цитотоксическая химиотерапия и лучевая терапия считаются лучшими методами, доступными для лечения злокачественных новообразований. Однако они могут вызывать серьезные побочные эффекты, такие как повреждение нормальных клеток вместе с опухолевыми клетками. Недавние достижения в понимании основного механизма развития рака привели к развитию таргетных методов лечения, которые могут ингибировать рост опухолевых клеток, мешающих молекулярным путям, ведущим к апоптозу. Например, препараты Иматиниб и Эрлотиниб могут ингибировать активность тирозинкиназы белка, нацеленной на рецепторы эпидермального фактора роста (EGFR). Другие таргетные препараты, такие как антитела бевацизумаб, будут действовать на фактор роста, который стимулирует рост опухолевого кровеносного сосуда 102.
Большинство злокачественных опухолей зависят от глюкозы, необходимой для их развития. Когда изучали корреляцию различных видов опухолей человека с разной степенью гликолиза, было обнаружено, что существует обратная зависимость между скоростью гликолиза и повреждением, вызванным химиотерапевтическими лекарственными средствами и излучением. Исследования показали, что 2-DG избирательно сенсибилизирует опухолевые клетки к ионизирующей радиации, не вызывая повреждения нормальных клеток. Таким образом, клинические испытания у пациентов с опухолями головного мозга при использовании протокола гипофракционной радиотерапии в сочетании с 2-DG оказались успешными. Комбинированная терапия привела к минимальной острой токсичности и поздним радиационным эффектам, также было отмечено значительное увеличение выживаемости и улучшение качества жизни 106.
Мишень рапамицина в клетках млекопитающих (mTOR)
Мишень рапамицина в клетках млекопитающих (mTOR) – это серин-треониновая протеинкиназа, которая является членом семейства PIKK [фосфатидилинозитол-3-киназа-подобная киназа (PI3K)], представляет собой важную часть в регулировании развития и пролиферации клеток. Когда mTOR активируется, повышаются уровни фосфорилирования его мишеней p70S6K и 4EBP1, что приводит к увеличению уровней биогенеза рибосом, трансляции, ингибированию аутофагии и реорганизации актинового цитоскелета. Исследования показали, что сигнальный путь (PI(3)K) -PTEN-mTOR аберрантно активируется во многих опухолях, что приводит к дисрегуляции клеточного роста и пролиферации. Потеря мРНК PTEN или производство белка в опухолевой ткани могут рассматриваться как биомаркеры для оценки активации молекулярного пути. Маркер пролиферации Ki-67 используется для оценки ингибирования mTOR рапамицином, который может показывать присутствие фосфорилированной формы рибосомального белка S6 и его терапевтическое действие на опухолевые клетки 110
Теломераза представляет собой фермент, известный как обратная транскриптаза, которая использует РНК в качестве матрицы для продуцирования ДНК и содержит как РНК, так и белковые компоненты. Фермент является единственным ответственным за защиту клетки от деградации и смерти путем поддержания теломер. Таким образом, его можно рассматривать как один из лучших диагностических маркеров рака человека, что делает его идеальной мишенью для химиотерапии 116.
Известно, что ген р53 является геном-супрессором опухоли, который предотвращает неконтролируемое деление аномальных клеток. Радиация и многие другие противоопухолевые препараты вызывают повреждение ДНК раковых клеток, которое активирует ген р53, что приводит к апоптозу. Во время лечения, интактный ген p53 дикого типа, по существу, необходим для стимуляции запрограммированной гибели раковых клеток. Таким образом, ген p53 является хорошо изученным потенциальным биомаркером для прогнозирования и ответа пациента на терапию [120, 121].
Тирозинкиназа относится к группе ферментов, которые регулируют различные клеточные процессы, такие как рост клеток, дифференцировка, миграция и апоптоз, которые способствуют развитию опухолей и их прогрессированию. Таким образом, влияние на белок тирозинкиназы как на терапевтический биомаркер является привлекательным подходом к остановке роста опухоли. Например, ингибиторы тирозинкиназы Гефитиниб и Трастузумаб оказались противораковыми средствами 122.
Клетки как биомаркеры
Циркулирующие опухолевые клетки (CTCs)
Циркулирующие опухолевые клетки можно рассматривать как мощные биомаркеры для прогноза прогрессирования заболевания и реакции на терапию. Увеличение CTCs в любой момент во время терапии является показателем прогрессирования, тогда как снижение количества CTCs показывает эффективность терапии. Исследования показали, что их можно рассматривать как стандартные маркеры опухолей (например, Ca27-29) при оценке прогноза заболевания [124].
Т-регуляторные клетки (CD4 +, CD25 + и Foxp3 +)
T-регуляторные клетки (T-regs) считаются важными в индуцировании и поддержании периферической аутотолерантности, что препятствует развитию иммунной патологии. Предполагается, что они контролируют как естественные, так и приобретенные иммунные ответы. T-regs хорошо известен как суррогатный иммунный маркер прогрессирования рака; также выступает в качестве предиктора ответа на таргетные методы лечения. Наличие клеток FoxP3 + в опухолях помогает в оценке прогноза, метастатической способности и инвазивности некоторых опухолей путем модуляции способности иммунной системы нацеливаться на опухолевые клетки 125.
Стволовые клетки (CSC).
Раковые стволовые клетки являются субпопуляцией клеток, которые обладают способностью к самообновлению и генерации более дифференцированного потомства, составляющего основную массу опухоли. Исследования показали, что раковые стволовые клетки (CSC), опухолеобразующие клетки или клетки, инициирующие опухоль, могут приводить к появлению новых опухолей при трансплантации их животным с иммунодефицитом. Поэтому крайне важно идентифицировать CSC для каждой возможной опухоли, что может привести к новым методам лечения 131.
Эпигенетические изменения были связаны с развитием и прогрессированием рака у человека. Исследования показали, что эпигенетические модификации являются обратимыми, в отличие от генетических мутаций. Это заставило исследователей сосредоточиться на разработке эпигенетических препаратов для лечения больных раком. Хотя исследования в области эпигенетики привели к улучшению результатов лечения пациентов с определенными формами лимфомы и лейкемии с использованием препаратов, которые изменяют метилирование ДНК и ацетилирование гистонов, следует уделять больше внимания оптимизации и подтверждению маркеров метилирования в клинических испытаниях. Терапия, направленная на отмену эпигенетических изменений в раковых клетках, а также диагностические и прогностические анализы, основанные на моделях метилирования генов, являются многообещающими направлениями для будущего прогресса в лечении пациентов.
Journal of Oncology Research and Treatment.
J Oncol Res Treat, Vol 2(1).
Epigenetics — Role as Biomarker in Cancer Diagnosis.
Manasa P* Department of Biotechnology, JNTU Hyderabad, India.
05 сентября 2013
- 3534
- 2,6
- 6
- 4
Антитела могут служить не только эффективной системой защиты организма от незванных гостей-патогенов, но и позволяют выявить наличие опухоли на ранних стадиях ее развития

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.

Рисунок 1. Иммунная система организма — высокопрофессиональная армия, стоящая на пути полчища патогенов
Здравствуй, антитело молодое, незнакомое.
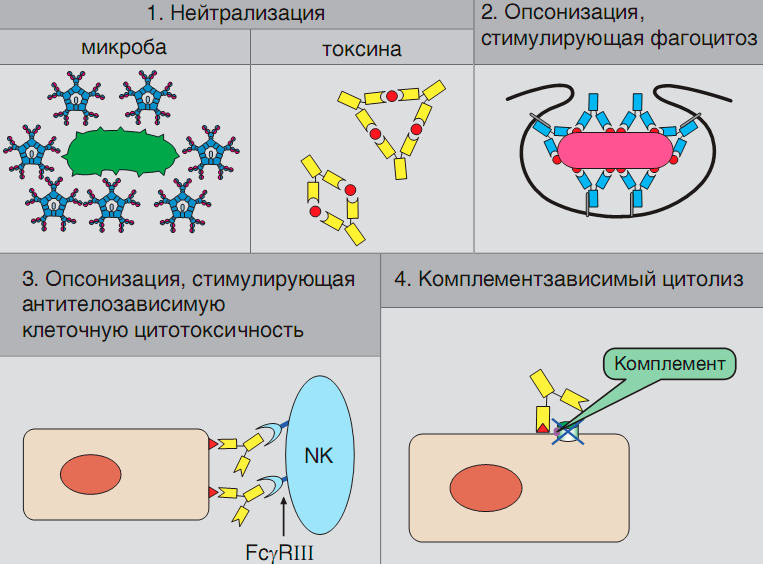
Рисунок 2. Основные механизмы действия антител. Нейтрализующее действие антител (вариант 1) проиллюстрировано на примере IgM-антител, блокирующих микроорганизм, и IgG-антител, формирующих иммунный комплекс с токсином. Варианты 2 и 3 (опсонизация, усиливающая фагоцитоз, и стимуляция цитотоксической активности NK-клеток) реализуются через взаимодействие иммуноглобулинов с Fcγ-рецепторами клеток. Взаимодействие с антигеном (вариант 4) открывает комплементсвязывающие участки IgG-антител, что приводит к запуску комплемента по классическому пути и лизис или опсонизацию клеток-мишеней.
Рак и ты: кто кого?
Злокачественные новообразования — бич современного человечества. Антибиотики, вакцины [4], лекарственные препараты, иммунные сыворотки и т.д. сделали возможным лечение и предупреждение огромного количества болезней, пандемии которых в прошлом уносили миллионы жизней (чума [2], [5], холера, оспа, сибирская язва и др.; рис. 3). Средняя продолжительность жизни человека увеличилась, и наиболее частой причиной смерти стали сердечнососудистые заболевания и опухоли (25 и 23% от общего числа умерших в год, соответственно, по данным на 2008 г. [6]). Средняя пятилетняя выживаемость пациентов с диагностированными опухолями легкого (первое место по частоте встречаемости у мужчин и второе после рака молочной железы у женщин) составляет 16,3%. Однако, если проанализировать данные по выживаемости отдельно для каждой из стадий диагностированной опухоли, то окажется, что обнаружение новообразования на стадии локализованной опухоли дает 52% выживаемости, а на стадии регионарных и отдаленных метастазов — 24% и 4%, соответственно [7] (рис. 4). Таким образом, наиболее перспективным путем снижения смертности от злокачественных новообразований является разработка и внедрение новых методов их ранней диагностики, наиболее многообещающим из которых является неинвазивное или малоинвазивное выявление биомаркеров опухоли (онкомаркеров) в крови, моче, слюне, бронхоальвеолярной жидкости, мокроте и опухолевой ткани пациента.

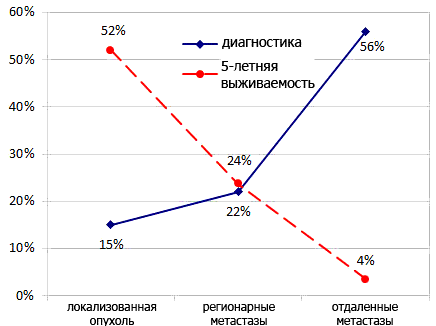
Рисунок 4. Диагностика рака легкого и выживаемость пациентов по стадиям, 2001–2007 гг.
- Малая инвазивность при заборе биоматериала.
- Отсутствие специфических требований к забору материала и пробоподготовке.
- Простота и унифицированность определения (используются различные типы иммуноферментного анализа).
- Высокая стабильность в пробах сыворотки и плазмы крови.
- Высокое время полужизни.
- Минимальные концентрационные колебания в зависимости от времени суток, принятия пищи, лекарств, физической активности, фазы менструального цикла, определенных медицинских вмешательств и пр.
- Высокая специфичность.
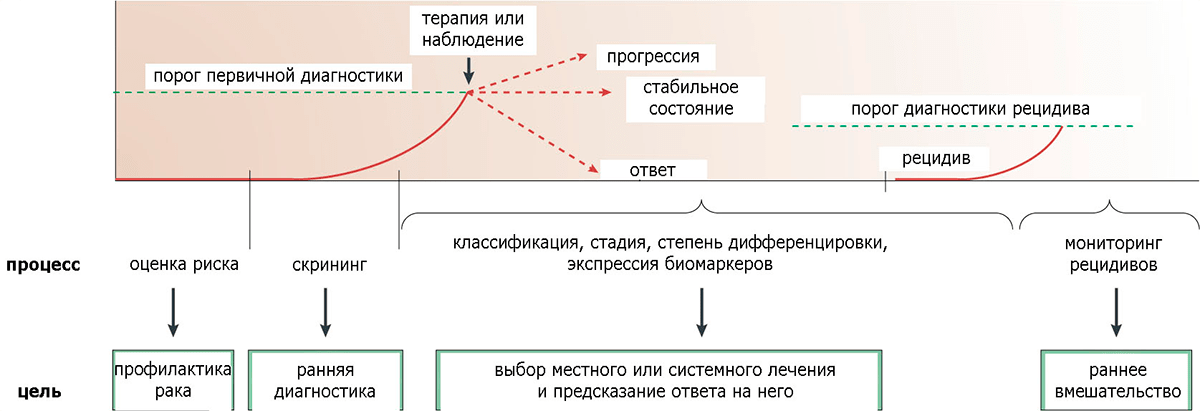
Рисунок 5. Схематическое представление использования биомаркеров на разных стадиях опухолевой прогрессии
Аутоантитела для диагностики — новое решение старых проблем!
Примером успешного применения аутоантител в диагностике злокачественных новообразований могут служить аутоантитела против опухолевого супрессора p53 [9], который часто мутирован в различных типах новообразований человека. Мутации приводят к нарушению третичной структуры белка, и в результате этого многие скрытые эпитопы становятся доступными для презентации их В- и Т-клеткам иммунной системы. Анти-p53 антитела в сыворотке крови рабочих, подвергшихся воздействию винилхлорида, детектируются до клинического диагноза ангиосаркомы печени [10], а у пациентов с хронической обструктивной болезнью легких — до клинического диагноза рака легкого [11]. Некоторые исследования продемонстрировали корреляцию между наличием у пациентов анти-p53 аутоантител и выживаемостью (рак яичников, колоректальный рак и рак легкого); при этом в большинстве случаев регистрация аутоантител против p53 была ассоциирована с неблагоприятным прогнозом.
Нельзя не упомянуть об онконевральных антителах — аутоантителах, специфичных к нейрональным антигенам — белкам, в норме экспрессирующимся только в нервной ткани, однако в силу различных генетических нарушений начинающих продуцироваться в опухолевой ткани, вызывая так называемый паранеопластический синдром (ассоциированное с опухолью патологическое состояние, характеризующееся аутоиммунным поражением различных отделов нервной системы). В качестве примера таких антигенов можно привести белки HuB, HuC и HuD (human antigens B, C, D), которые в норме экспрессируются во всех нейронах, а также при мелкоклеточном раке легкого, раке простаты и нейробластоме, и CDR2, в норме экспрессирующийся только в нейронах Пуркинье и ассоциированный с такими типами рака, как рак молочной железы, яичников и мелкоклеточный рак легкого. Онконевральные антитела обнаруживаются у большей части пациентов с паранеопластическим синдромом, и было показано, что их появление четко и независимо коррелирует с развитием в организме пациента злокачественного новообразования [12]. В настоящее время по наличию тех или иных онконевральных антител можно судить о преимущественной локализации опухолевого очага, который в силу своих малых размеров не был обнаружен в ходе первичного осмотра пациента [13].
Другим примером биомаркеров антительной природы являются аутоантитела против раково-семенниковых (раково-гаметных) антигенов [14]. Они экспрессируются в широком спектре новообразований (меланома, рак яичников, рак легкого), но не в нормальных тканях организма, за исключением мужских семенников. Аберрантная экспрессия этих белков приводит к развитию на них Т-клеточного и/или B-клеточного ответа, т.е. к появлению аутоантител в кровотоке больного. Наиболее известными представителями данного семейства опухолеассоциированных аутоантигенов являются MAGE-1 (он был первым найденным антигеном этой группы), NY-ESO1, MAGE-3 и SSX2.
Пожалуй, наиболее ярким успехом в области разработки аутоантительных биомаркеров является диагностикум EarlyCDT-Lung, основу которого представляют антитела против семи опухолеассоциированных антигенов, созданный в 2007 году и уже успешно применяющийся для выявления рака легкого на его ранних стадиях. В данной панели присутствуют раково-семенниковые антигены (NY-ESO-1, CAGE, MAGE A4), опухолевый супрессор p53, транскрипционный фактор SOX2, онконевральный антиген HuD и GBU4-5 — белок, функция которого в клетке до сих пор плохо изучена. Интересно, что состав антигенной панели менялся в процессе разработки в сторону более высокой чувствительности и специфичности, которые в конечном счете удалось поднять до 41% и 91%, соответственно. Рутинным тестом для обнаружения карцином легкого на Западе является компьютерная томография (КТ), однако было показано, что EarlyCDT-Lung диагностикум справляется с этой задачей лучше. КТ в силу разрешающей способности метода может не дать достоверных результатов при наличии у пациента опухоли с малыми линейными размерами, тогда как адаптивный иммунный ответ, формирующийся на опухолеассоциированные аутоантигены, может быть детектирован на самых ранних этапах развития новообразования.
Поиск антител против опухолеассоциированных аутоантигенов и разработка диагностикумов на их основе на сегодняшний момент являются одной из многообещающих ветвей современной диагностической онкоиммунологии. Простота исполнения и дешевизна, а, следовательно, доступность широкому кругу лиц, в будущем делает возможным применение таких диагностикумов в рамках планового медицинского обследования граждан, что является залогом своевременного обнаружения опухоли и полного выздоровления больного.
Вот так иммунная система не только стоит на страже организма, препятствуя развитию патогенов и опухолей, но и помогает исследователям находить все новые и новые методы диагностики различных заболеваний, — в частности, опухолей. Стрелы-антитела, прицельно пущенные В-клетками в мятежников, позволяют врачам найти и обезвредить последних, продлив тем самым жизнь пациента на долгие-долгие годы.
