При подтвержденном РМЖ консультация онколога-маммолога Портного Сергея Михайловича — БЕСПЛАТНО .
Наиболее изученными генами предрасположенности к развитию РМЖ являются гены BRCA1 и BRCA2 (BReast CAncer – рак молочной железы). Мутации этих генов обуславливают чрезвычайно высокий риск развития РМЖ и рака яичников (РЯ), нарастающий с возрастом (см. таблицу 1, рис. 1 и 2).
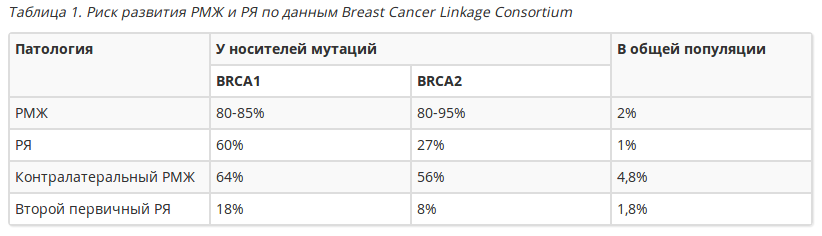
Вероятность развития РМЖ и РЯ у носителей мутаций гена BRCA1
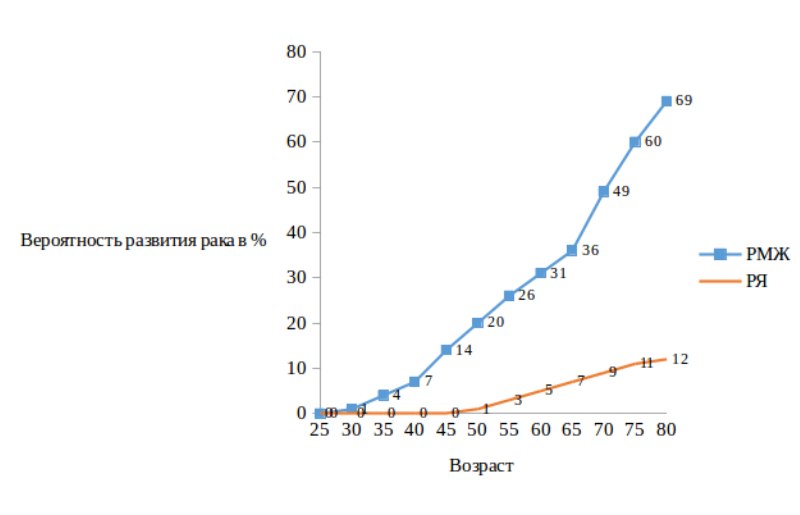
Вероятность развития РМЖ и РЯ у носителей мутаций гена BRCA2
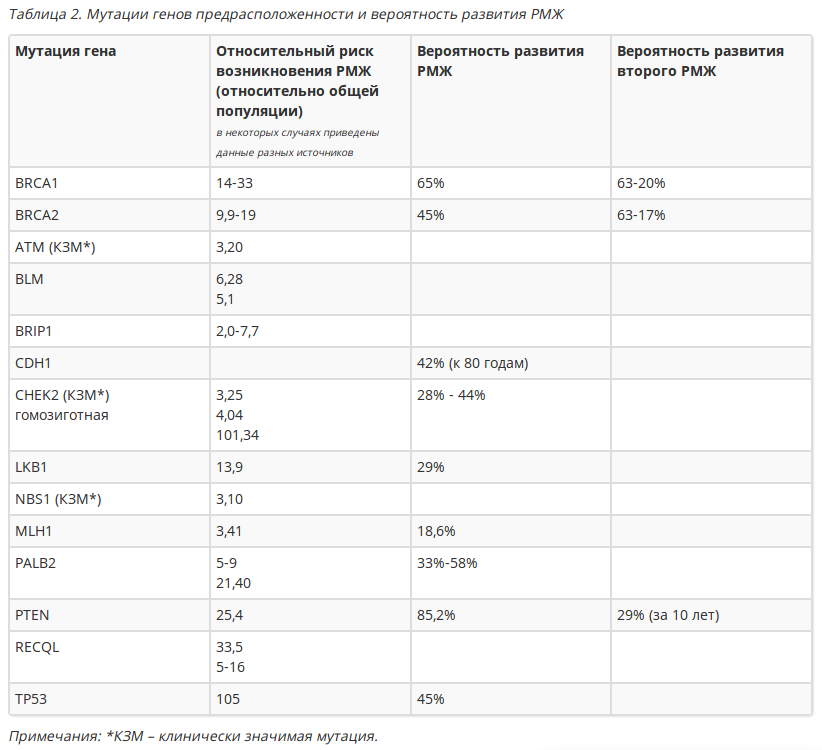
Дополнительные сведения о генах предрасположенности к развитию РМЖ представлены в таблице 2.
Сергей Михайлович Портной «Исследование BRCA1 и BRCA2»
Меры профилактики развития РМЖ у носителей мутации генов предрасположенности
Прежде всего, хотелось бы понять, какова эффективность наименее травматичных мер профилактики, которые известны для общепопуляционного РМЖ, в частности, ранние роды и приём тамоксифена. К сожалению, исходя из результатов исследований, специалисты делают вывод, что эти меры неэффективны (или их эффект полностью не изучен) у носителей мутаций генов предрасположенности.
Две операции снижают риск заболеть РМЖ: удаление придатков матки (сальпинго-оофорэктомия) и удаление молочных желёз (двустороння профилактическая мастэктомия).
Cальпинго-оофорэктомия снижает риск развития РМЖ на 53% у носителей мутаций гена BRCA1, такой же эффект, — 53% получен и у носителей мутаций гена BRCA2. Указанная операция также приводит к снижению риска РЯ у носителей мутаций генов BRCA1/2 на 79%.
Эффективность двусторонней профилактической мастэктомии изучалась в двух группах пациенток: в группе с высоким риском и в группе с умеренным риском развития РМЖ. В группе с умеренным риском: ожидалось 37,4 случая РМЖ, наблюдалось 4, снижение риска развития болезни – 89,5%. В группе с высоким риском развития РМЖ 3 случая рака развились у 214 оперированных женщин. Из 403 женщин, не подвергшихся профилактической мастэктомии, рак развился у 156, снижение риска развития болезни – 96%. Кроме того, профилактическая мастэктомия сопровождалась снижением смерти от РМЖ не менее, чем на 90%. Позже, когда были открыты гены BRCA1 и BRCA2, у этих же женщин дополнительно было оценено влияние операции на риск развития РМЖ именно у носителей мутаций этих генов. Снижение риска составило 89,5%-100%.
Законный вопрос: почему РМЖ имеет шанс развиться, если молочные железы удалены?
Дело в том, что при операциях раннего периода могла оставаться часть железистой ткани, из которой потом развивалась опухоль. После того, как этот факт был установлен, подход к технике операции ужесточился. При соблюдении принципа полного удаления железистой ткани эффект операции достигает 100%. В частности, у женщин, оперированных нами, не было случаев возникновения РМЖ, то есть эффект = 100%.
Итак, профилактическая двусторонняя мастэктомия надёжно защищает от развития РМЖ.
Естественно, что, если болезнь не развилась, не требуются те мероприятия, которые используются при её лечении:
- удаление подмышечных лимфатических узлов,
- химиотерапия,
- лучевая терапия,
- гормонотерапия.
Операция может выполняться с одномоментной реконструкцией молочных желёз или без реконструкции. При выполнении реконструкции возможно дополнительное изменение размеров и формы молочных желёз.
Пациентки, которым не выполнена профилактическая мастэктомия, имеют повышенный риск развития РМЖ, в том числе и в относительно ранних возрастных группах, что снижает возможности раннего выявления болезни с помощью маммографического скрининга. Женщинам, являющимся носителями мутации гена, ответственного за развитие РМЖ, может быть предложена следующая программа профилактического обследования. В возрасте от 25 до 50 лет – УЗИ молочных желёз 1 раз в 6 месяцев, при наличии технической возможности — 1 раз в год МРТ-маммография. После 50 лет – маммография 1 раз в год.
Двухсторонняя профилактическая мастэктомия с одномоментной реконструкцией груди, пациентке 33 года.
Принципиальными особенностями технологии являются:
Модели оценки риска
Чтобы помочь врачам в выявлении женщин с повышенным риском рака молочной железы, существуют модели для оценки риска.
Они позволяют оценивать риск рака, основываясь на личном и семейном анамнезе или только на семейном анамнезе, а также оценивают вероятность наследственного синдрома злокачественных опухолей молочной железы и яичников, вызываемого мутациями генов BRCA1 и BRCA2.
Все эти модели независимо от того, предназначены ли они для выявления женщин с повышенным риском развития рака молочной железы или с риском носительства мутаций генов восприимчивости к злокачественным опухолям, обладают существенными ограничениями и представляют собой научные догадки или вероятность для конкретной пациентки.
На деле риск у женщины будет равен либо нулю, либо ста процентам.
Модель Гейла, опубликованная в 1989 г., была создана с целью облегчить оценку индивидуального риска развития рака молочной железы за определенный интервал времени, исходя из возраста. В модели использовались персональные факторы риска, включая возраст, возраст менархе, возраст первых родов, число предшествующих биопсий молочной железы и число родственниц первой степени родства, страдавших раком молочной железы.
Позднее модель была адаптирована таким образом, чтобы включить гистологические индикаторы риска, атипичную протоковую гиперплазию и дольковый рак in situ. Специфические характеристики пациенток включены в модель, вероятность рассчитывается для риска развития рака молочной железы с шагом в 5 лет относительно частоты для пациенток того же возраста без специфических факторов риска.
Модель была разработана главным образом на основе данных по женщинам европеоидной расы, которые проходили ежегодные обследования в рамках Breast Cancer Detection and Demonstration Project (BCDDP, Проект выявления и демонстрации рака молочной железы) в США.
Модель использовалась в клинических испытаниях профилактики рака молочной железы National Surgical Adjuvant Breast Project (NSAPB, Национальный проект хирургического адъювантного лечения рака молочной железы) и в испытаниях Study of Tamoxifen and Raloxifene (STAR, Исследование тамоксифена и ралоксифена) в США.
Модель Клауса является эффективным инструментом в оценке риска рака молочной железы у женщин с семейным анамнезом рака молочной железы или рака яичников. Клаус и др. (Claus) использовали данные из исследования CASH (Cancer and Steroid Hormone, Рак и стероидные гормоны), проведенного Centers for Disease Control (CDC, Центр по контролю заболеваемости) в США, для прогнозирования кумулятивной вероятности развития рака молочной железы к определенному возрасту, основываясь на возрасте установления диагноза рака молочной железы у родственниц. В модели Клауса за условие принят аутосомно-доминантный тип наследования высокопенетрантных генов восприимчивости к раку молочной железы.
Таблицы Клауса учитывают семейный анамнез матери и отца и включают родственниц второй степени родства и семейный анамнез рака яичников. В отсутствие выявления наследственного синдрома злокачественных опухолей с осуществимым прогностическим тестированием таблицы Клауса могут служить руководством для расчета риска рака молочной железы.
Выявление генов, связанных с наследственной восприимчивостью к раку молочной железы и яичников, позволило прояснить риск в некоторых семьях. Тестирование в клинических условиях на мутации генов BRCA1 и BRCA2 существует с середины 1990-х годов.
BRCAPRO — модель, в которой используется байесовский анализ и ранее опубликованные модели для прогнозирования вероятности обнаружения мутаций BRCA1 и BRCA2, а также риска рака молочной железы и рака яичников на основе семейного анамнеза. В эту модель для оценки риска включены возраст установления диагноза рака молочной железы или яичников в семье, двустороннее поражение при раке молочной железы и происхождение из евреев-ашкенази.
Оценка риска рака молочной железы и консультирование
Оценка риска рака молочной железы — это процесс извлечения информации из личного и семейного анамнеза пациента и оценка его или ее риска на основе информации, почерпнутой из литературных источников, с использованием подходящих моделей оценки риска и обеспечения информации в помощь для принятия решений по снижению риска или диспансеризации, в надежде предотвратить развитие злокачественных опухолей или выявить их на ранней стадии.
Генетическое тестирование во многих случаях является методом прояснения риска и обеспечения ценной информации для семьи пациента. Поскольку на этот процесс затрачивается много времени, в большинстве случаев в этой службе работают медицинские сестры, прошедшие специальную подготовку в области генетики злокачественных опухолей, или врачи генетических консультаций, специализирующиеся в области онкологии и получившие соответствующую подготовку. Данная служба часто предоставляет консультации и других специалистов.
Процесс оценки риска злокачественных опухолей подразумевает получение первичной информации. Пациентку спрашивают о ее семейном анамнезе, особо выясняя вопросы установления онкологических диагнозов, возраста установления диагноза, возраста и причины смерти или других хирургических вмешательств или процедур, которые могут оказывать влияние на риск (например, удаление яичников).
После этого семейный анамнез оценивается и записывается в родословное древо. Кроме того, оценивается личный анамнез пациентки, и если возможно, диагнозы злокачественных новообразований записываются вместе с заключениями гистологических исследований или их описаниями.
Также в анамнезе выясняют вопросы, касающиеся менструаций и приема гормональных препаратов. Наконец, с пациенткой обсуждают вопросы, касающиеся ее ожиданий, связанных с консультацией, а также то, какие из них могут быть разрешены. Важно выяснить, сталкивалась ли пациентка со случаями онкологических заболеваний в своей семье или у других лиц.
Образовательный компонент данного процесса различается в зависимости от индивидуальных потребностей в конкретный момент времени, но он может включать и описание факторов риска злокачественных новообразований.
Такое описание включает рак молочной железы и яичников, а также пожизненный и скорректированный по возрасту риск рака для популяции в целом так, чтобы пациентка увидела их в контексте индивидуального риска. Краткое обсуждение может включать типы риска, которые можно использовать для выражения риска злокачественных новообразований, и модели, используемые для оценки такого риска.
Ограничения моделей в оценке индивидуального риска также рассматриваются. Вместе с пациенткой обсуждаются рекомендации по скринингу рака или доступные методы снижения риска, включая и ограничения на современном этапе развития медицины.
Обсуждается информация о наследственных синдромах злокачественных новообразований. Если семейный анамнез указывает на наследственный синдром рака молочной железы или яичников, обусловленный генами BRCA1 и BRCA2, то предлагается генетическое тестирование на мутации этих генов.
Обсуждается вероятность выявления мутаций генов BRCA1 и BRCA2, согласно доступным моделям. Может рассматриваться возможность проведения тестирования, несмотря на малую вероятность положительного результата соответственно выбранной модели.
Ограничения применяемых моделей могут быть очевидны в семьях, в которых немного родственников, мало родственников женского пола или недостаточно информации о самой семье. Рассмотрение семей или пациенток в отношении тестирования не всегда является простым процессом.
Лица, относящиеся по происхождению к евреям-ашкенази, имеют повышенную вероятность носительства одной из трех обнаруживаемых мутаций генов BRCA1 и BRCA2, и тестирование на эти три мутации в данной группе будет выявлять 95% носителей.
В табл. 3.5 перечислены характеристики семей, подходящих для генетического тестирования. Решение для пациентки и членов семьи должно быть, вероятно, крайне индивидуальным. Обсуждаются стоимость, процесс, время и ограничения тестирования.
Таблица 3.5. Характеристики семей и отдельных пациенток, подходящих для генетического тестирования на мутации BRCA1 и BRCA2
| Семейный анамнез с большим числом случаев рака молочной железы и/или рака яичников. |
| Семейный или личный анамнез двустороннего рака молочной железы. |
| Наличие в семейном или личном анамнезе случаев сочетанного рака молочной железы и яичников. |
| Семейный или личный анамнез рака молочной железы у мужчины. |
| Наличие в семейном анамнезе более одной родственницы, страдавшей раком яичников. |
| Большое число пораженных членов семьи, аутосомно-доминантный тип наследования. |
| Семейный или личный анамнез рака молочной железы и/или яичников и происхождение из евреев-ашкенази. |
| Семейный или личный анамнез злокачественных опухолей, диагностированных моложе предполагаемого возраста их развития. |
Тестирование обычно подразумевает полное секвенирование генов на BRCA1 и BRCA2, а оценка геномной перестройки не обнаруживается при секвенировании. Тестирование затратно и занимает несколько недель до получения результата. При тестировании могут выявляться вредные мутации или могут обнаружиться варианты с неясным клиническим значением, или мутации вовсе не выявляются. Для пациентки важно понять это до проведения тестирования.
В идеале сначала тестируют пораженных членов семьи, и если вредная мутация обнаружена, то можно подвергнуть тестированию непораженных членов семьи, что позволит получить окончательные результаты. Отрицательный результат приобретает существенное значение только в условиях ранее выявленной в семье мутации.
Распространенность клинически значимых мутаций BRCA1 и BRCA2 варьирует среди населения. В США она может составлять примерно 1/500. У лиц с происхождением из евреев-ашкенази она составляет 1/40.
Женщины-носительницы мутаций BRCA1 и BRCA2 имеют существенно более высокий риск рака молочной железы и яичников. До настоящего времени продолжают описывать риски, связанные с мутациями в этих генах. Их обзор дан в табл. 3.6.
Таблица 3.6. Отдельные риски рака, связанные с мутациями BRCA1 и BRCA2, % (Easton et al., 1995,1999; Ford)
| Рак молочной железы по возрасту (женщины) | ||||||
| Евреи-ашкенази (не отобранные по семейному анамнезу) | ||||||
| BRCA1 | BRCA2 | BRCA1 | BRCA1 | BRCA2 б | ||
| 30 | 3 | — | — | — | ||
| 40 | 19 | 12 | 21 | 17 | ||
| 50 | 50 | 28 | 39 | 34 | 33 | 2 |
| 60 | 64 | 48 | 58 | 48 | ||
| 70 | 85 | 84 | 69 | 74 | 56 | 7 |
| Риск рака молочной железы на противоположной стороне | Женщины, перенесшие рак молочной железы (не BRCA1/BRCA2) | |||||
| 5 лет после установления диагноза | 20 | 12 | 2,5-5 | |||
| К возрасту 70 лет | 60 | 52 | ||||
| Риск рака молочной железы у мужчин | 6-10 | 0,05 | ||||
| Риск рака яичников | ||||||
| 40 | 0,6 | — | 3 | 2 | ||
| 50 | 22 | 0,4 | 21 | 2 | ||
| 60 | 30 | 7,4 | 40 | 0,6 | ||
| 70 | 63 | 27 | 46 | 12 | ||
| 80 | 54 | 23 | а King et al. (2003). б Struewing et al. (1997).
Некоторые семьи имеют в своем составе потомков, соответствующих наследственному синдрому злокачественных опухолей молочной железы и яичников, но результаты тестирования на мутации генов BRCA1 и BRCA2 у них отрицательны. Недавно проведенные исследования показали, что у 17% семей с крайне высоким риском (т. е. в которых имеется более четырех случаев рака молочной железы или яичников с отрицательным результатом тестирования на мутации BRCA1 и BRCA2 при скрининге на геномные перестройки в генах BRCA1 и BRCA2,атакже мутациив CHEK2, TP53 и PTEN) были обнаружены ранее не выявлявшиеся мутации. Из них 12% были ранее не выявлявшимися геномными перестройками BRCA1 и BRCA2,5% — мутациями CHEК2, а 1% — мутациями TP53. Мутации гена CHEK2 сопровождались повышением риска рака молочной железы. Тестирование на мутации этого гена в настоящее время доступно в клинической практике, хотя риск злокачественных опухолей, связанный с этими мутациями, пока до конца не описан. Рак молочной железы является компонентом других наследственных синдромов злокачественных опухолей дополнительно к наследственному синдрому рака молочной железы и яичников, вызываемым мутациями BRCA1 и BRCA2. Следует проявлять осторожность при оценке риска рака, консультировании и интерпретации состояния потомков в отношении других наследственных синдромов злокачественных опухолей. Синдром Коудена (Cowden) — часто не распознаваемый синдром, сопровождаемый повышенным риском злокачественных опухолей молочной и щитовидной железы и вызываемый мутациями гена PTEN. Синдром Ли-Фраумени (Li-Fraumeni) — синдром, вызываемый мутациями гена TP53, связанный со множественными злокачественными опухолями, многие из которых возникают в детстве. Злокачественные опухоли при этом синдроме включают рак коры надпочечников, саркомы, рак молочной железы, злокачественные опухоли головного мозга и лейкозы. Другой синдром, сопровождаемый гамартомными полипами и повышенным риском рака молочной железы, — синдром Пейца-Ягерса (Peutz-Jeghers), который связан с мутациями генов STK11/LKB1. Хотя эти синдромы редки, врач должен учитывать их вероятность и предлагать пациенткам соответствующее тестирование и наблюдение, учитывая потенциальные последствия этих синдромов. Рекомендации по скринингу женщин, имеющих повышенный рискВ настоящее время достоверно установлено, что скрининг рака молочной железы, включая осмотр молочной железы и маммографический скрининг, создает преимущества. Согласно определению, общепопуляционный скрининг рекомендован женщинам без установленных факторов риска или страдающим определенными заболеваниями молочной железы, но при этом проведение скрининга должно одобряться у всех женщин. Женщинам, у которых установлено клинически значимое повышение риска, следует предлагать более интенсивный скрининг с маммографией в более раннем возрасте. В особых ситуациях магнитно-резонансная томография (МРТ) молочной железы можно предлагать дополнительно к маммографическому скринингу. Следует инструктировать пациенток и одобрять самообследование молочных желез. Осмотр молочных желез следует предлагать каждые полгода, а не каждый год, или еще чаще тем женщинам, которые чувствуют себя некомфортно или бояться выполнять самообследование раз в месяц. Скрининг и идеальное ведение женщин с крайне высоким риском развития рака молочной железы, например с наследственной восприимчивостью, продолжают внедряться. Рекомендации включают ежемесячное самообследование молочных желез, ежегодные или каждые полгода клинические осмотры молочных желез и начало проведения маммографии в возрасте 25-35 лет или на основе семейного анамнеза. Кроме того, правомерны попытки выявления каких-либо изменений у женщин с повышенным риском. Для синдромов, сопровождаемых повышенным риском других злокачественных опухолей, наблюдение или снижающие риск меры должны соответствовать величине риска. Вмешательства по снижению риска рака молочной железыВ идеале пациентки с крайне высоким риском рака молочной железы должны получать медицинскую помощь в лечебных учреждениях, имеющих опыт ведения таких пациенток. Усиленное наблюдение по поводу рака молочной железы нацелено на раннее выявление злокачественных опухолей. Также вариантом ведения таких пациенток могут быть меры по снижению риска. Можно рассмотреть возможность назначения таких препаратов, как тамоксифен или ралоксифен. Прием этих препаратов сопровождается существенными побочными эффектами, и врач должен внимательно следить за балансом между рисками и потенциальными преимуществами у каждой конкретной пациентки. Снижающая риск мастэктомия является вариантом для женщин с крайне высоким риском. Это крайняя мера, и врач не должен предпринимать ее без скрупулезного рассмотрения и повторных консультаций. Существенной частью такого решения для многих женщин является их собственный опыт, касающийся злокачественных новообразований. Также следует отметить, что при удалении яичников снижается риск рака молочной железы у женщин с крайне высоким риском, с наследственным синдромом рака молочной железы и яичников. Мы обладаем множеством инструментов, чтобы помочь выявлению женщин с существенно повышенным риском развития рака молочной железы. Выявление и тщательная оценка риска на индивидуальной основе могут предоставить возможности для уменьшения у пациенток тревожности и психического напряжения, а также предлагает варианты интенсивного наблюдения и мер по снижению риска. К.И. Бленда, М.У. Бухлера, А. Ксендес, М.Г. Сарра, О.Д. Гардена, Д. Уонга detector | |||
