
Клетки апокринного рака молочной железы. Зернистая цитоплазма, круглые ядра с выраженными ядрышками, четко определенные границы клеток.
Апокринный рак протоков молочной железы часто ошибочно принимают за доброкачественные опухоли. Правильный диагноз можно поставить только после исключения других доброкачественных заболеваний молочных желез с апокринными свойствами. Такой самой распространенной доброкачественной болезнью груди является кистозная болезнь молочной железы, которую часто называют GCDFP-15, поскольку жидкость, которая содержится в кистах, содержит белок 15 (GCDFP-15).
Лечение апокринного рака протоков молочной железы включает в себя хирургическое удаление опухоли (лампектомия или мастэктомия), лучевую терапию и системную химиотерапию (особенно для предотвращения рецидива или метастазирования клеток рака в другие части тела). Шестилетняя выживаемость составляет 70-80%.
Апокринный рак — редкое новообразование, которое состоит из клеток с обильной эозинофильной цитоплазмой, напоминающих метапластические апокринные элементы. Его часто неверно называют онкоцитарным раком или карциномой потовых желез. Эта форма составляет около 1 % всех злокачественных новообразований молочных желез. Макроскопически опухолевые узлы плотные, сероватые, с признаками инфильтративного роста. Под микроскопом апокринный рак имеет вид слизистого, долькового, тубулярного, медуллярного внутрипротокового рака, клетки которого обладают увеличенными и полиморфными ядрами с выраженными ядрышками, а также эозинофильной LUHK(PAS)- и альциан-положительной гомогенной или гранулярной цитоплазмой с вакуолизацией.
Рак с признаками эндокринного новообразования (син.: первичная карциноидная опухоль, апудома) — редкая опухоль, представленная одиночным четко отграниченным узлом диаметром 1—5 см. Иногда она имеет многоузловое строение. Под микроскопом большинство таких новообразований выглядят как инвазивный протоковый рак разной степени гистологической дифференцировки. Аргирофильные клетки находятся как внутри протоковых структур, так и в инвазивной части опухоли. Кроме того, паренхима опухоли может состоять из пластов тубулярного, слизистого, сосочкового, внутрипротокового, внутридолькового и инвазивного долькового рака. Ряд аргирофильных карцином молочных желез обладают эндокринным типом строения и напоминают карциноидные опухоли других органов.
В этом случае опухолевые клетки составляют гнезда и тяжи, разделенные полосками стромы, а также могут формировать ленты, сосочки и микрожелезы. Клетки паренхимы такого новообразования имеют мелкие размеры, нечеткие контуры, гиперхром ные округлые ялра. Они дают положительную аргирофильную реакцию по Гримелиусу и отрицательную — по Фонтана—Массону. При этом в аргирофильных клетках рака молочных желез не удается обнаружить полипептидные гормоны и биогенные амины. Поэтому опухоли с клетками, обладающими аргирофильными гранулами, не представляют собой отдельную нозологическую единицу и рассматриваются как рак с очагами эндокринной метаплазии.
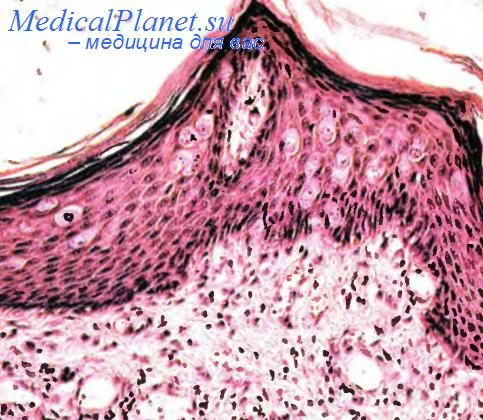
Болезнь Педжета.
Болезнь Педжета — своеобразная и довольно редкая форма рака, представленная сочетанным поражением структур эпидермиса соска и крупных протоков молочных желез. По числу находок болезнь Педжета составляет 1 —2 % всех случаев рака молочных желез. Возраст больных 26— 88 лет. Пациенты жалуются на боли в пораженном органе, выделения из соска, иногда изъязвление на коже соска. Прогноз широко варьирует и определяется своевременностью начатого лечения и уровнем распространения процесса.
Под микроскопом при этом новообразовании в эпидермисе, преимущественно в нижних отделах сосков молочных желез, обнаруживаются крупные бледные клетки, иногда с оптически пустой цитоплазмой. Это клетки Педжета. Они располагаются поодиночке в поверхностных отделах эпидермиса с тенденцией к формированию пучков в базальных отделах. Их полиморфные крупные и часто светлые ядра содержат крупные ядрышки, а в цитоплазме может обнаруживаться небольшое количество пигмента или слизи. Изредка одиночные клетки Педжета располагаются в вакуолях. Все эти клетки дают положительные реакции на эпителиальный мембранный антиген, низкомолекулярные цитокератины и онкопротеин гена С-ERBB2 (HER2/neu). В подлежащей дерме и строме опухоли определяется лимфоидный инфильтрат. Болезнь Педжета может распространяться за пределы соска.
Почти всегда болезнь Педжета сочетается с вкутрипротоковым раком, реже с инвазивным раком молочных желез. Внутрипротоковый рак представлен комедокарцикомой, солидным раком, а инвазивный протоковый рак — низкодифференцированным солидным раком.
Болезнь Педжета следует дифференцировать от меланомы кожи и болезни Боуэна.
Диагноз рака апокринных потовых желез устанавливается на основании результатов гистологического исследования. Основные трудности гистологической диагностики заключаются в различии между раком апокринных и раком ккринных потовых желез, при этом следует учитывать локализацию, гистологические и иммуногистохимические характеристики опухолей, особенности их течения, тип секреции и т.д. В то же время следует помнить, что некоторые новообразования потовых желез имеют промежуточные признаки или являются недифференцированными, что осложняет их четкое разделение на группы апокринного и эккринного происхождения. Примерами смешанных опухолей являются себокринная аденома, себоциома и поромаподобная аденома придатков кожи. Классификации отдельных опухолей помогают данные энзимной гистохимии, иммуногистохимии и электронной микроскопии. В частности, рак апокринных потовых желез часто содержит неопластические клетки с обильной зернистой эозинофильной цитоплазмой; почти в 30% случаев он позитивно окрашивается на железо. Эккринные раки никогда не окрашиваются положительно на железо, однако содержат ШИКположительные диастазорезистентные гранулы. Опухолевые клетки при эккринных раках, в отличие от рака апокринных потовых желез, имеют значительно меньшие размеры, они слабоэозинофильные, а клетки протоков — слабобазофильные .
Дифференциальный диагноз рака апокринных потовых желез также проводится с келоидом, гемангиомой, меланомой, эпидермоидной кистой, дерматофибромой, лимфомой, плоскоклеточным раком кожи, базалиомой, нейроэндокринным раком, саркомой Капоши, метастазами рака внутренних органов. Например, дуктальный рак потовой железы с локальной миоэпителиальной дифференцировкой может иметь сходство с раком носоглотки, а папиллярный рак потовой железы — с кожными метастазами рака яичников. Перстневидноклеточный рак гистологически сходен с метастазами рака молочной железы, желудка или кишечника. Дифференциальный диагноз во всех перечисленных случаях проводится с использованием иммуногистохимических и электронно-микроскопических исследований. Для дифференциальной диагностики с раком молочной железы, метастазировавшим в подмышечную область, используют маммографию и окрашивание биоптата на рецепторы к эстрогенам и прогестерону.
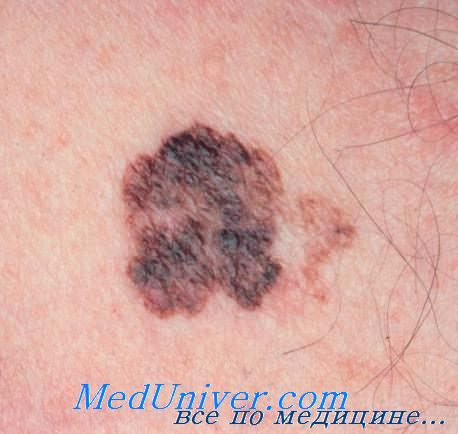
Течение апокринной аденокарциномы. Около 30-50% дуктопапиллярных раков апокриновых потовых желез метастазируют, в первую очередь лимфогенно, а в 48-50% случаев — гематогенно. Наиболее часто метастазируют дуктопапиллярные раки век, что обусловлено хорошей васкуляризацией этого региона. Метастазирование обычно происходит в региональные лимфатические узлы, а из них — во внутренние органы, в первую очередь в легкие, реже в печень, кости и мышцы.
Местные рецидивы после хирургического лечения рака апокринных потовых желез встречаются часто, в 80% случаев. Для снижения риска их развития необходим контроль операционного края.
Прогноз при раке апокринных потовых желез не анализировался отдельно от других раков потовых желез, при которых регионарные метастазы имели место в 85% случаев, отдаленные метастазы — в 31%. Десятилетняя продолжительность безрецидивного течения при отсутствии метастазов в лимфатические узлы составляла 56%, а при их наличии — только 9%. Риск метастазирования и летального исхода зависит от гистологических особенностей опухоли: 5-летняя выживаемость отмечена почти у 70% пациентов с высокодифференцированным раком и ни в одном случае — у пациентов с низко- и недифференцированным.
Лечение апокринной аденокарциномы — хирургическое удаление опухоли в широких пределах, нередко с последующей пластикой. При опухолях в области век, губ, носа, кончиков пальцев используют микрографическую операцию по Mohs. В профилактических целях показано удаление региональных лимфатических узлов. Химиотерапия (циклофосфамид, доксорубицин, флуороурацил, цисгшатин, блеомицин) недостаточно эффективна. Большинство опухолей радиорезистентно.
— Вернуться в оглавление раздела «Дерматология»
Молекулярные апокринные (MA) опухоли представляют собой отрицательные раковые опухоли рецептора эстрогена (ER), характеризующиеся экспрессией рецептора андрогена (AR). Мы проанализировали группу из 58 транскрипционно определенных опухолей MA и предложили новый инструмент для идентификации этих опухолей.
Мы провели количественную обратную транскрипционную ПЦР (qRT-PCR) для ESR1, AR, FOXA1 и AR-родственных генов и иммуногистохимию (IHC) для ER, PR, рецептора фактора роста эпидерма человека 2 (HER2), CK5 / 6, CK17, EGFR , Ki67, AR, FOXA1 и GCDFP15, и мы проанализировали клинические признаки.
MA все были охарактеризованы ESR1 (-) AR (+) FOXA1 (+) и AR-родственными генами положительный профиль мРНК. Окрашивание IHC на этих опухолях показало 93% ER (-), только 58% AR (+) и 90% FOXA1 (+). 67% и 57% опухолей MA были HER2 (3+) и GCDFP15 (+) соответственно. Почти у всех опухолей MA (94%) была подпись IHC HER2 (3+) или GCDFP15 (+), но ни одна из 13 контрольных базальноподобных (BL) опухолей не делала. Клинически опухоли MA были довольно агрессивными, с плохими прогностическими факторами.
Опухоли MA могут быть лучше определены их профилем qRT-PCR-AR, чем AR IHC. Кроме того, мы обнаружили, что избыточная экспрессия белка HER2 или GCDFP15 является чувствительным и специфическим инструментом для дифференциации MA от BL в контексте ER-негативных опухолей. Таким образом, составная молекулярная и IHC-сигнатура могут помочь идентифицировать опухоли MA в повседневной практике.
Рак молочной железы является наиболее распространенным инвазивным раком у женщин. Сексуальные стероидные гормоны эстрогена и прогестерона являются ключевыми факторами в канцерогенезе благодаря их действиям на рецепторы альфа-рецептора эстрогена (ER) и рецептора прогестерона (PR). В повседневной практике молекулярная классификация рака молочной железы основана на иммуногистохимической экспрессии этих рецепторов (ER и PR) и рецептора человеческого эпидермального фактора роста 2 (HER2), члена семейства рецепторов эпидермального фактора роста. Однако рецептор андрогена (AR), другой член семейства стероидных рецепторов, также в значительной степени выражен более чем на 70% случаев рака молочной железы и теперь явно вовлечен в патогенез рака молочной железы [1]. Хотя в значительной степени со-экспрессированный с ER, AR также может быть сверхэкспрессирован в ER (-) опухолях молочной железы [2]. ER (-) опухоли представляют 30% рака молочной железы и являются весьма гетерогенными, включая по крайней мере базальноподобные (BL) опухоли и часть HER2-положительных опухолей. Тем не менее, среди этих ER (-) опухолей несколько групп идентифицировали подтип молекулярного апокринового рака молочной железы (MA), характеризующийся экспрессией AR и активацией AR-пути на анализах экспрессии генома, парадоксальной экспрессией генов, известных как ER-мишени, или выраженных в ER (+) опухолях и гиперэкспрессии HER2 примерно в 50% случаев [3] [4]. Существование этой подгруппы MA предполагает новую молекулярную классификацию для рака молочной железы, включая подгруппы опухолей молочной железы с просветом, MA и BL [5]. Сверхэкспрессия AR может обеспечить новую терапевтическую мишень для рака молочной железы [6], особенно у пациентов с ER (-) опухолями, которые не пользуются эндокринной или HER2-нацеленной терапией. Потенциальный терапевтический эффект ингибирования АР в подтипе MA уже показан с использованием моделей in vitro [4]. Однако пока нет четкого консенсуса по определению подгруппы МА, за исключением транскриптомического анализа. Простой и воспроизводимый метод определения рака молочной железы MA необходим для лучшего понимания поведения этих опухолей и для их включения в конкретные исследования.
Здесь мы использовали молекулярную апокринную подпись qRT-PCR, первоначально определенную на наборе образцов рака молочной железы, аннотированных их транскрипционными профилями. Мы ретроспективно идентифицировали группу опухолей MA на основе этой сигнатуры. Мы описали их клинические, молекулярные и патологические особенности, и мы идентифицировали новую упрощенную иммуногистохимическую и молекулярную сигнатуру, что привело к простому в использовании и воспроизводимому диагностическому инструменту для этих опухолей.
Чтобы идентифицировать пациентов с молекулярными апокриновыми опухолями, мы предложили сигнатуру молекулярной апокрины (MA) qRT-PCR, определяемую отсутствием избыточной экспрессии ESR1 (ER-), AR и FOXA1, а также сверхэкспрессию трех из пяти генов, связанных с путь AR (Agr2, ALCAM, SPDEF, TTF3, UGT2B28A), согласно тому, что было описано ранее в литературе [4,5].
Для подтверждения этой MA-сигнатуры в контексте ER-негативных опухолей мы составили набор проверок из 45 ER-негативных образцов с доступными данными микрочипов (E-MTAB-365, GSE26639), которые, как прогнозируется, были молекулярными апокринами (32 случая) или базально- (13 случаев) нашим ранее опубликованным предиктором [7]. Эти данные проверки доступны в дополнительном файле 1. Подпись qRT-PCR правильно распознала 32 опухоли, которые, как предполагается, были молекулярными апокринами с помощью предсказателя микрочипов.
С этой проверенной сигнатурой qRT-PCR мы ретроспективно проверили 502 пациента с раком молочной железы, лечившихся в больнице Сент-Луис (Париж) в период с 1996 по 2008 год, и замороженные образцы, доступные для молекулярного анализа. Мы идентифицировали 58 молекулярных апокринных опухолей и использовали 13 базальноподобных опухолей в качестве контрольной группы. Клинические данные, включая возраст, тип операции, тип лечения, возникновение и тип рецидива и текущий статус, были получены в Центре заболеваний молочной железы в больнице путем обзора медицинских карт. Были зарегистрированы патологические данные, включая гистологический тип, степень, размер опухоли, перитуморальную сосудистую инвазию и стадию. Образцы были предоставлены Центром биологических ресурсов после утверждения Комиссии по этической экспертизе больницы в Сент-Луисе (Париж, Франция: соглашение № DC, 2009-929), следуя национальным и французским правилам этики и права для информации и согласия пациентов (ANAES, HAS и INCa). Все пациенты были проинформированы об этом исследовании и не возражали против этого, согласно рекомендациям Совета по институциональному обзору.
Суммарную РНК экстрагировали из секций свежей опухолевой ткани с использованием экстракции фенолом / хлороформом. После операции обратной транскрипции (обратной транскриптазы Superscript II, Life Technologies SAS, Saint Aubin, France) мы проанализировали экспрессию ESR1, AR, FOXA1 и AR (UGT2B28A, ALCAM, AGR2, SPDEF и TTF3) с использованием конкретных праймеров и зондов или анализы экспрессии генов (Applied Biosystems Inc., Foster City, CA, USA) (ER [8], AR (Hs00171172_m1), FOXA1 (Hs00270129_m1), UGT2B28A (Hs00852540_s1), ALCAM (Hs00233455_m1), AGR2 (Hs00180702_m1), SPDEF ( Hs01026048_m1), TFF3 (Hs00173625_m1) путем количественной ПЦР в реальном времени (qPCR, Taqman 7500, Applied Biosystems Inc.). Мы провели относительную количественную оценку с использованием гена TBS-связывающего белка (TBP) в качестве эндогенного контроля, а конечные результаты были выражены как нормированные отношения (целевой ген / контрольный ген). AR и FOXA1 были рассмотрены как сверхэкспрессированные с относительным отношением отсечения при 100. Коэффициенты отсечения были определены на гистограмме распределения отношения мРНК на наших опухолях. Мы показали четкое бимодальное распределение в все наши образцы, используя модель смеси двух гауссовских распределений с оптимальным отсечением при пересечении функций плотности вероятности [9]. Мы определили уровень экспрессии ERBB2 (HER2) с помощью qRT-PCR, как описано ранее [10]. Мы также проанализировали статус TP53 по функциональному анализу у дрожжей (FASAY), как первоначально описано в [11,12], и как описано в [13].
После экстракции ДНК с использованием метода фенол / хлороформ мы проанализировали мутационный статус PIK3CA (горячие точки: E542K, E545K и H1047R) с помощью аллелической дискриминации на циклере LC480 (Roche Diagnostics, Meylan, France) [14].
Мы провели следующие иммуногистохимические окраски: ER (клон 6F11, разбавление 1/50, Novocastra Laboratories, Neucastle Upon Tyne, UK), PR (клон 312, разбавление 1/75, Novocastra), HER2 (клон CB11, разбавление 1/250, Novocastra), Ki-67 (клон Mib 1, разбавление 1/100, Dako-France Les Ulis, Франция), CK5 / 6 (клон D5 / 16 B4, разбавление 1/50, Dako), CK17 (клон E3, разведение 1 / 75, Dako), EGFR (клон Dak-H1-WT, разбавление 1/20, Dako), AR (клон AR441, разбавление 1/20, Dako), FOXA1 (клон 2F83, разбавление 1/500, Abcam, paris, Франция) и GCDFP15 (клон 23А3, разбавление 1/50, Дако). Оценка иммунного окрашивания HER2 оценивали согласно рекомендациям ASCO [15, 16]. Двойная гибридизация на основе серебра in situ (Roche Ventana, Tucson Arizona, USA) использовалась в 4 HER2 (2+) случаях, а поликлональное антитело против HER2 (Dako) использовалось в другом случае HER2 (2+). Цитоплазматические иммуноокраски для GCDFP15 и для базальных цитокератинов считались положительными, если по крайней мере 5% опухолевых клеток были положительными. Все другие иммуноокраски были ядерными пятнами (ER, PR, FOXA1, AR) и считались положительными, если по крайней мере 10% опухолевых клеток были положительными. Для иммуноокрашивания Ki67 отмечалось процентное содержание положительных ядер.
Иммуногистохимический белок и экспрессию мРНК сравнивали между двумя группами опухолей с использованием точных тестов Фишера. Выполнение иммуногистохимических сигнатур для распознавания апокринных и базальноподобных опухолей было выражено с точки зрения чувствительности, специфичности и площади под кривой рабочих характеристик приемника (AUC). Данные о выживаемости, общей выживаемости (OS) и выживаемости без заболевания (DFS) оценивались с использованием оценки предела продукта Kaplan-Meier.

В Европейской онкологической клинике ведёт консультативный приём и выполняет операции известный российский хирург-маммолог, доктор медицинских наук Сергей Михайлович Портной (автор более 300 печатных работ, член правления Российского общества онкомаммологов, автор трех патентов на изобретения).
Сергей Михайлович выполняет весь объем оперативных вмешательств на молочной железе, включая органосохраняющие и реконструктивные пластические операции.
До 25% всех случаев рака у женщин приходится на рак молочной железы (РМЖ). Часто его возникновению предшествуют доброкачественные изменения в молочной железе — мастопатия. У мастопатии есть много синонимов: фиброзно-кистозная болезнь, мастодиния, доброкачественная дисгормональная дисплазия, доброкачественная гиперплазия, аденоз и др.

Что такое мастопатия?
Мастопатия — доброкачественный процесс, при котором в ткани молочной железы нарушается правильное соотношение между клетками железистого эпителия и соединительной ткани. Незначительные изменения обнаруживаются также на уровне строения клеток.
По статистике, женщины с доброкачественной дисплазией молочных желез заболевают РМЖ в 3–4 раза чаще, чем здоровые. Если же процесс сопровождается размножением клеток эпителия с образованием узелков, то риск развития рака увеличивается в 30–40 раз.
До 60–90% женщин репродуктивного возраста имеют те или иные признаки мастопатии. Основная причина развития этого заболевания — гормональный дисбаланс. При доброкачественной дисплазии отмечается избыток эстрогенов на фоне дефицита прогестерона. К такому дисбалансу приводят:
- хронические гинекологические заболевания;
- ожирение;
- некоторые общесоматические болезни (сахарный диабет, гипотиреоз, артериальная гипертензия и др.);
- отдельные методы контрацепции;
- нарушения менструального цикла;
- постоянный стресс и др.
Виды мастопатии
Различают диффузную и узловую мастопатию. Для диффузной формы характерно равномерное разрастание эпителия и соединительной ткани в молочной железе. При узловой мастопатии обнаруживают один или несколько уплотненных узелков с четкой границей — это результат местного разрастания фиброзной ткани и расширения протоков. По данным исследований, узловая мастопатия, будучи локальной формой заболевания, протекает легче, кроме того, она более благоприятна в плане прогноза.
При мастопатии на микроскопическом уровне обнаруживается увеличение количества и размеров клеток эпителия — это явление называют гиперплазией. Различают дольковую (разрастание долек молочной железы) и протоковую (разрастание эпителия протоков) гиперплазию. Если при гиперплазии изменяется также форма клеток, ее расценивают как атипичную и склонную чаще других перерождаться в рак.
Аденоз молочных желез — это форма мастопатии с преобладанием гиперплазии железистого эпителия долек. Если преобладает гиперплазия эпителия молочных протоков, то отмершие в большом количестве эпителиальные клетки забивают просвет протоков, вызывая их расширение. Это явление называют эктазией протоков молочных желез.
Гиперплазия, аденоз и эктазия молочных желез обладают типичными симптомами мастопатии и часто используются в качестве ее синонимов.
Симптомы мастопатии
В ряде случаев пациентки годами живут, даже не догадываясь о наличии у них мастопатии. Неприятные симптомы отмечаются лишь в 38–50% случаев, они зависят от формы заболевания и фазы менструального цикла.
- боли в молочных железах (масталгии),
- отек и увеличение молочных желез (мастодиния),
- выделения из сосков.
Боли появляются обычно за 7–10 дней до менструации, они могут быть ноющими, тупыми или распирающими, разными по интенсивности. Неприятные ощущения усиливаются при движении и пальпации (ощупывании). В начале заболевания боли начинаются незадолго до и проходят сразу после менструации, но со временем они становятся продолжительнее и интенсивнее.
Отек и увеличение размеров молочных желез при мастопатии выражены сильнее, чем их физиологическое нагрубание перед менструацией. Иногда пациентки замечают прозрачные, молочные или зеленоватые выделения из соска. При узловой мастопатии все эти симптомы выражены незначительно или отсутствуют вовсе.
Диагностика мастопатии
При мастопатии важно регулярно наблюдаться у маммолога и уметь самостоятельно обследовать грудь. Врачи рекомендуют проводить самообследование ежемесячно, на 5–12 день цикла.
Вас обязательно должны насторожить:
- асимметрия и разная форма желез;
- узлы и уплотнения;
- втяжения соска;
- пигментации;
- выделения из соска;
- втяжения кожи;
- увеличение и уплотнение подмышечных лимфоузлов.
При обнаружении хотя бы одного из таких симптомов необходимо обратиться к гинекологу, маммологу или онкологу. При мастопатии врач в любом случае назначает дополнительное обследование.
Маммография — рентгенологическое исследование молочных желез, которое используют в качестве метода скрининга (массовой диагностики). Маммографию проводят на 8–10 день цикла. В идеале данное обследование должно назначаться всем женщинам с 35 до 50 лет 1 раз в 2 года, после 50 лет — ежегодно, по показаниям — чаще. Маммография не требует специальной подготовки и с высокой точностью позволяет обнаружить патологические признаки. Благодаря повсеместному распространению маммографов смертность от РМЖ снизилась на 30%.
При мастопатии на маммограмме могут быть обнаружены контурированные тяжистые, округлые сливающиеся или множественные мелкоочаговые тени. Чаще всего изменения носят смешанный характер.
Ультразвуковое исследование (эхография) молочных желез рекомендуется в качестве скрининга женщинам до 35 лет, оно менее информативно, нежели маммография. Точность результатов эхографии определяется размерами образования и разрешением аппаратуры, поэтому его относят к вспомогательным методам.
Пункционная дуктография применяется при подозрении на поражение протоков молочной железы — в проток вводят раствор метиленового синего и выполняют маммографию.
Перед лечением мастопатии независимо от сроков предыдущего исследования обязательно проводят маммографию или УЗИ молочных желез и, по показаниям, — пункционную дуктографию. Если их результаты позволяют заподозрить наличие злокачественного новообразования, врач может назначить более точные методы диагностики, проведение которых возможно лишь в специализированных центрах:
- пункционную биопсию с цитологией,
- тонкоигольную аспирационную биопсию под контролем УЗИ,
- исследование гормонального фона (эстрогены, пролактин).
Они исключают или подтверждают онкологический диагноз со 100%-ной вероятностью.
Важно помнить, что даже если в груди обнаружены уплотнения, или на маммографии зафиксированы узелки — о раке думать еще рано. До 80% пункций новообразований молочной железы в итоге выявляют доброкачественную природу узелков. Тем не менее, при наличии любой формы мастопатии важно регулярно наблюдаться у специалиста и вовремя проходить назначаемые доктором исследования.
БИФАЗНАЯ) КАРЦИНОМА
СМЕШАННАЯ ПРОТОКОВАЯ И ДОЛЬКОВАЯ
Такие карциномы характеризуются частично микроскопическими признаками инфильтрирующей дольковой карциномы, частично — инфильтрирующей протоковой. Она выявляется достаточно редко и ее необходимо отличать от случаев, когда две отдельные опухоли различного микроскопического строения существуют рядом в одной и той же молочной железе.

Иногда слизистый рак почти целиком состоит из муцина и тогда в препарате необходимо тщательно искать опухолевые, клетки. Слизь в таких случаях внеклеточная и представляет собой один из продуктов распада коллагеновых волокон.
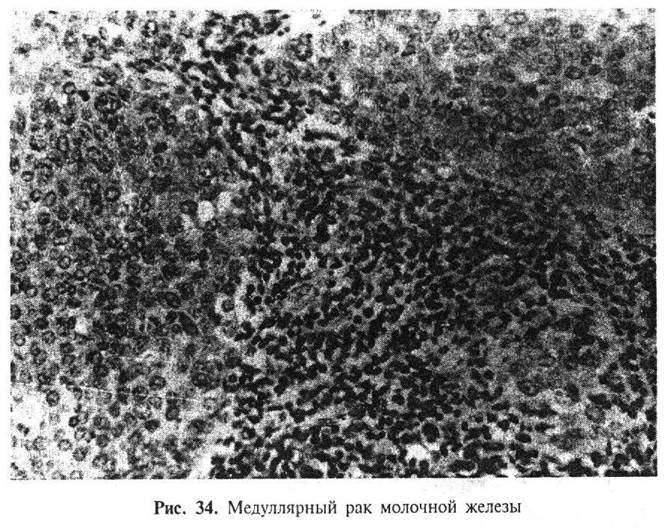
Постоянным микроскопическим компонентом является выраженная лимфоцитарная инфильтрация периферии опухоли. Иногда значительное количество лимфоцитов проникает вглубь опухоли, располагаясь между раковыми клетками.
Прогноз при медуллярной карциноме лучше, чем при обычном инвазивном раке. 10-летняя выживаемость при медуллярной карциноме составляет 84%, по сравнению с 63% при обычных протоковых раках. Метастазы в подмышечных лимфатических узлах выявляются часто, но обычно поражаются единичные лимфатические узлы и их локализация ограничена нижней аксиллярной группой. Прогноз особенно благоприятен при медуллярной карциноме менее 3 см в диаметре и сохраняется лучшим, чем для протоковой инфильтрирующей карциномы, даже когда имеются метастазы в регионарных лимфатических узлах.
Диагноз медуллярная карцинома должен ставиться лишь в тех случаях, когда имеются все признаки, ее характеризующие (ровные контуры опухолевого узла, массивные поля полиморфных опухолевых клеток, скудные соединительнотканные прослойки и выраженная лимфоплазмоцитарная инфильтрация). Опухоли, лишенные хотя бы одной из этих черт, следует расценивать как обычные инфильтрирующие протоковые карциномы высокой степени злокачественности.
Папиллярный инвазивный рак встречается очень редко, преимущественно у женщин в период менопаузы. При макроскопическом исследовании определяется четко очерченный деревянистой плотности серого цвета опухолевый узел, плотно спаянный с тканью молочной железы. Микроскопическое исследование показывает, что среди грубоволокнистой соединительной ткани располагаются неправильной формы и разной величины железистые полости, сформированные раковыми клетками. В просветы полостей выступают истинные сосочки, покрытые опухолевым эпителием.
Метастазирует папиллярная инвазивная карцинома редко и в метастазах в регионарные лимфатические узлы, обычно, сохраняет папиллярное строение. Прогноз инвазивного папиллярного рака значительно благоприятнее, чем при обычной протоковой инфильтрирующей карциноме. Иногда в одном и том же опухолевом узле выявляются стpyктуры инвазивного папиллярного рака и обычной протоковой карциномы (скиррозные, солидные и прочие структуры). Такие опухоли следует относить к инфильтративным протоковым раковым опухолям, так как прогноз в этих случаях не отличается от аналогичного показателя при банальной протоковой карциноме.
Редко инфильтрирующая папиллярная карцинома бывает представлена расположенными в строме железистыми полостями, имеющими правильную округлую или овальную форму и содержащими истинные сосочковые структуры, эпителий которых не имеет выраженного полиморфизма. Такие опухоли при микроскопическом исследовании бывает трудно отличить от папиллярного протокового рака in situ. Главным критерием в пользу инвазивного рака является наличие определяемого при макроскопическом исследовании плотного четко очерченного опухолевого узла.
Тубулярный рак — редкий гистологический вариант карциномы молочной железы, выявляющийся у женщин как в репродуктивном возрасте, так и менопаузальном периоде. Средний возраст таких больных около 50 лет.
Макроскопически новообразование представляет собой опухолевый узел твердой консистенции, неподвижный по отношению к окружающим тканям молочной железы. Нередко опухоль имеет звездчатую конфигурацию и похожа на протоковый инфильтрирующий рак скиррозного строения. Характерной особенностью опухолевого узла служат его небольшие размеры (1,5-2,5 см), что связано с медленным ростом карциномы.
Микроскопическая картина тубулярного рака представлена мелкими железами, расположенными на значительном расстоянии друг от друга в обильной строме. Железы не ветвятся и не анастомозируют друг с другом. Значительная часть желез имеет угловатую форму. Эпителий желез кубический или низкий цилиндрический, располагается в один ряд. Многие клетки на апикальной поверхности имеют реснички (апокриновый тип секреции). Клеточные элементы, формирующие железы, мономорфны, митотические фигуры не обнаруживаются.
Миоэпителиальные клетки не определяются; базальная мембрана отсутствует или обнаруживается в виде небольших ее фрагментов, что хорошо демонстрируется при использовании ШИК-реакции.
В просветах большинства желез не содержится продуктов секреции. В некоторых железистых структурах имеются клеточные мостики, соединяющие противоположные стенки железы (рис. 35).

В значительной части (более 2/3) тубулярных карцином в опухолевом узле или вне его определяются очаги внутридолькового или внутрипротокового рака, как правило, микропапиллярного или криброзного типа (рис. 36).
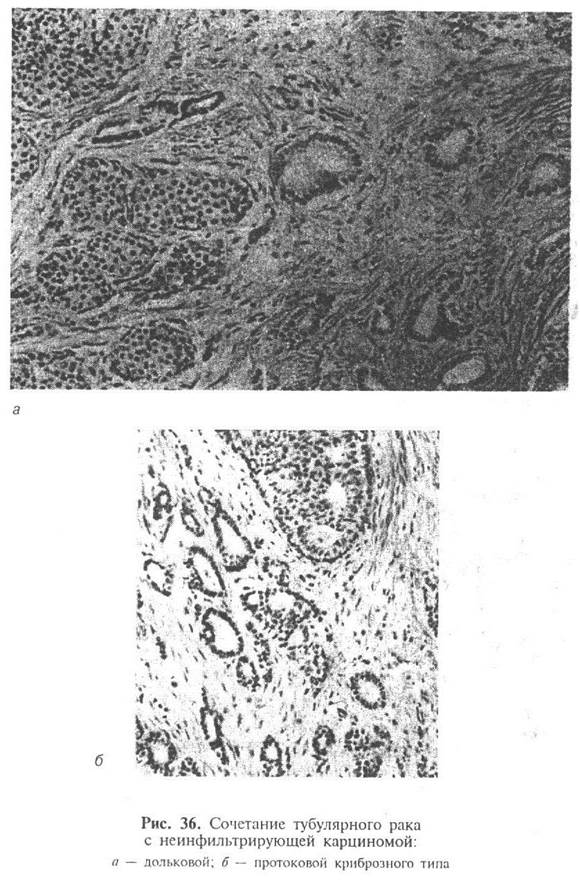
Строма опухоли обычно богата клеточными элементами. Микрокальцификаты выявляются, примерно, в половине случаев тубулярного рака. Количество их может быть разным, локализация — как в просветах железистых структур, так и в строме опухоли.
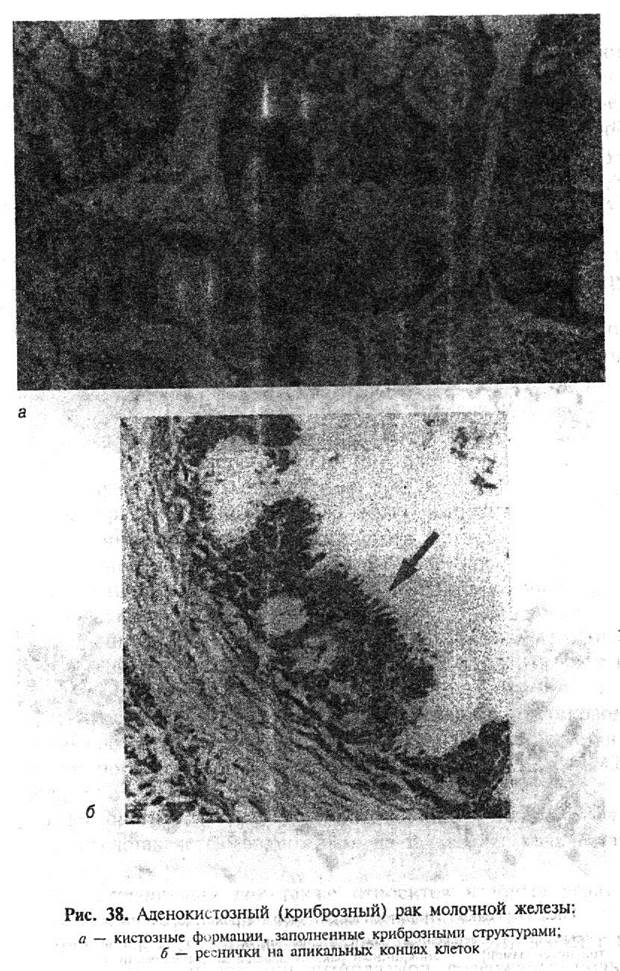
Тубулярный рак иногда имитирует доброкачественное поражение молочной железы и, прежде всего, мелкожелезистый аденоз. Дифференциально-диагностические критерии этих процессов изложены в разделе, посвященном фиброкистозной болезни.
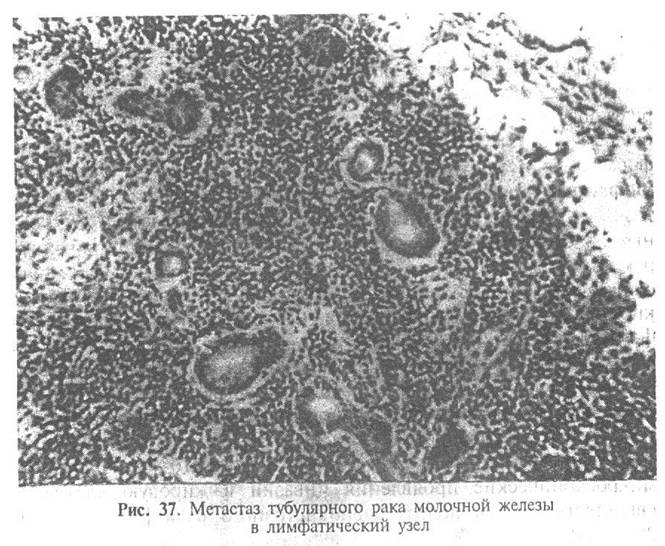
Прогноз благоприятный. Регионарное и отдаленное метастазирование выявляется редко.
Апокринный рак — крайне редкая форма, образованная эпителием апокринового типа. Опухолевые клетки крупные, имеют хорошо выраженную обильную, ШИК-положительную цитоплазму, содержащую эозинофильную зернистость. Ядра светлые, с хорошо выраженными ядрышками. Опухолевые клетки формируют железисто-солидные или выстилают кистозные структуры. На апикальных концах раковых клеток нередко видны булавовидные выпячивания цитоплазмы (рис. 39б). Некоторые опухоли представляют собой пристеночный узел в пределах кисты, выстланной доброкачественным эпителием апокринового типа. В связи с редкостью наблюдений апокринного рака достоверных сведений о его прогнозе не имеется.
Рак с метаплазией представляет собой инфильтрирующий протоковый рак, при котором наблюдаются различные варианты метапластических изменений. К их числу относится эпидермоидная карцинома — исключительно редкая опухоль молочной железы, выявляемая у женщин пожилого возраста. Макроскопически не отличается от обычного протокового инфильтрирующего рака. В отдельных случаях в опухолевом узле можно увидеть центрально расположенную кисту, выполненную роговыми массами. Микроскопически опухоль представляет собой протоковый инфильтрирующий рак с очагами плоскоклеточного строения, величина которых может варьировать в широких пределах. Иногда наряду с очагами высокодифференцированного плоскоклеточного рака можно наблюдать веретеноклеточные плоскоклеточные участки, непосредственно переходящие друг в друга.
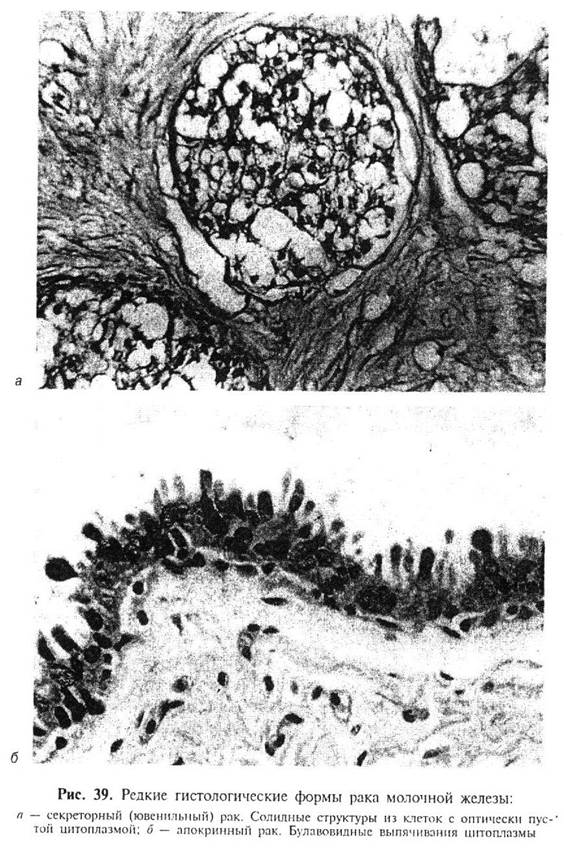
В редких случаях в низкодифференцированном протоковом раке выявляются очаги хондроидного, остеоидного и даже гигантоклеточного остеокластоподобного строения.
Судить о прогнозе метапластических карцином молочной железы не представляется возможным из-за малого количества наблюдений.
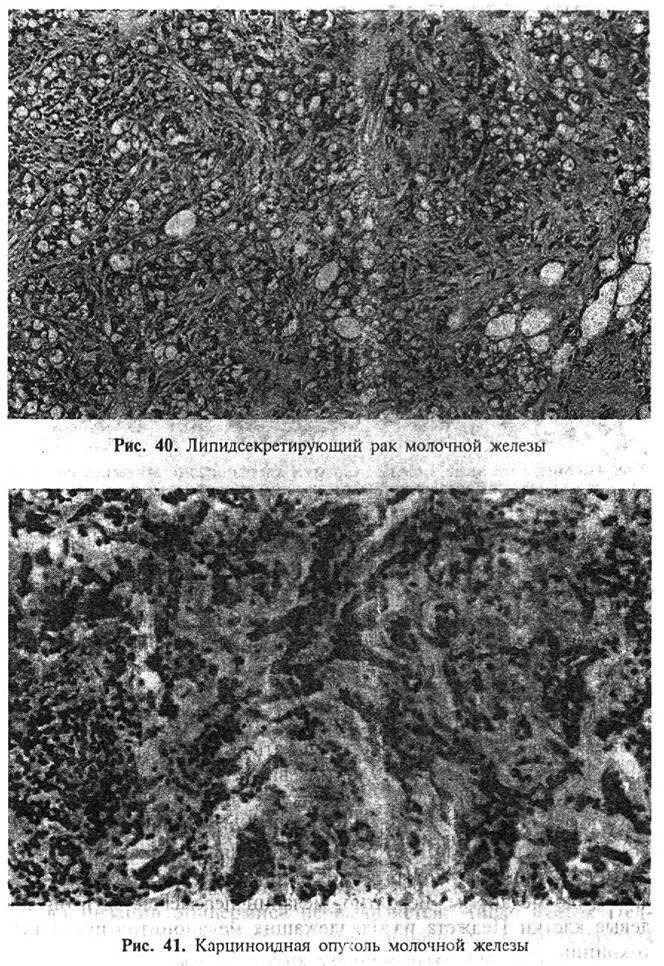
Липидсекретирующий рак также относится к числу редких гистологических вариантов карцином молочной железы. Он представлен солидными комплексами из крупных клеток с обильной вакуолизированной цитоплазмой, содержащей большое количество липидов (рис. 40), наличие которых следует подтвердить с помощью специальных методов окраски.
Описана, так называемая, карциноидная опухоль молочной железы (инвазивный протоковый рак с эндокринной дифференцировкой). Клиническая и макроскопическая картина при этой гистологической форме рака не отличается от таковой при обычных инфильтрирующих карциномах. Карциноидный синдром не отмечается даже при распространенных формах заболевания. При микроскопическом исследовании определяются солидные гнезда мелких мономорфных клеток, разделенные фиброзными прослойками, лентовидные и розеткоподобные структуры (рис. 41). Клетки этой формы рака содержат аргирофильные гранулы.
Болезнь Педжета соска наиболее часто выявляется у пожилых женшин. Средний возраст больных около 50 лет, т.е. такой же, как и при других формах рака молочной железы. Болезнь Педжета характеризуется экземоподобным поражением соска и протоковым раком молочной железы.
Первым клиническим проявлением болезни служат изменения кожи соска: отек, покраснение, мокнутие; могут появляться корочки или чешуйки, иногда поверхностное изъязвление. В дальнейшем эти изменения могут распространиться на ареолу и даже изредка на окружающую ее кожу. В отличие от экземы, которая протекает волнообразно, с обострениями и ремиссиями, при болезни Педжета ее проявления неуклонно прогрессируют и не реагируют на местное лечение.
При микроскопическом исследовании в эпидермисе соска или ареолы определяются крупные (значительно крупнее эпителия эпидермиса) клетки с выраженной эозинофильной светлой цитоплазмой (клетки Педжета). Ядра таких клеток полиморфны, иногда пикнотизированы. Эти клетки чаше располагаются в глубоких слоях эпидермиса, но могут лежать на разных его уровнях. Клетки Педжета могут лежать отдельно друг от друга, располагаться изолировано или в виде небольших скоплений (рис. 43). Они никогда не проникают в дерму. Такие клетки могут быть обнаружены в выводных протоках и придатках кожи. Иногда в цитоплазме клеток Педжета выявляются гранулы меланина — признак, который может привести к ошибочной диагностике меланомы. Вероятно, меланин перемешается в опухолевые клетки Педжета из близлежащих меланоцитов путем цитокринии.
Иммуногистохимически опухолевые клетки Педжета экспрессируют ЕМА, мембранный антиген глобул молочного жира, СЕА (при использовании поликлональных антител), кератин низкомолекулярной массы и инволюкрин.
В начальной стадии болезни эпидермис представляется мало дезорганизованным и сохраняет типичное подразделение на слои (стратификацию). В дальнейшем эпидермис расширяется, появляются акантотические тяжи. Часто возникают нарушения стратификации разной степени, вплоть до картины, соответствующей тяжелой дисплазии. Иногда появляется клеточный и ядерный полиморфизм, что в сочетании с выраженным нарушением стратификации напоминает карциному in situ.

Зависимости между количеством клеток Педжета и степенью дезорганизации эпидермиса не выявляется. Число клеток Педжета при нарастании дезорганизации эпидермиса в одних случаях может уменьшаться, в других увеличиваться.
Иногда в акантотических тяжах могут возникать полости, ограниченные одним слоем эпителиальных клеток (рис. 44), в результате чего возникают железистоподобные формации.
По мере развития болезни в дерме усиливается лимфоцитарная и плазмоклеточная инфильтрация.
Болезнь Педжета соска почти всегда сочетается с протоковым инфильтрирующим раком молочной железы.
Последний может локализоваться в любом квадранте молочной железы, исходить из средних и даже мелких протоков и не иметь видимой связи с соском или ареолой. Имеются сведения о малочисленных случаях возникновения долькового рака при болезни Педжета соска.
Столь частое сочетание болезни Педжета соска и рака молочной железы дает основание ряду авторов говорить о существовании болезни Педжета молочных желез. При этом выявляемые в эпидермисе клетки Педжета, не будучи раковыми, служат маркером расположенной в глубине ткани молочной железы карциномы. В связи с этим, при обнаружении в эпидермисе соска клеток Педжета необходима 
мастэктомия, даже если карцинома в молочной железе не выявляется при клиническом обследовании.
В описании макропрепарата и гистологическом заключении должна быть подробно охарактеризована карцинома молочной железы, что является основанием для дальнейшего выбора рационального метода комплексной и комбинированной терапии.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
