В климаксе и в менопаузе у женщин нередко появляются боли в мышцах, костях, сухожилиях и суставах. Локализуясь в различных частях тела (позвоночник, конечности, крестец, ребра), боли возникают то самопроизвольно, то при надавливании на эти части тела или минимальном травмировании их. Боли появляются во время полного покоя и во время движения.
Согласно исследованиям последних лет, заболевания опорно-двигательного аппарата в период климакса и менопаузы могут быть обусловлены, с одной стороны, эндокринными нарушениями, особенно в связи с угасанием функции яичников и исчезновением эстрогенных гормонов, а с другой — общими возрастными изменениями, которые в период климакса и менопаузы часто, вызывают ухудшение имевшихся ранее латентно протекающих воспалительных, трофических и дегенеративных нарушений.
К заболеваниям, вызванным нарушением эстрогенной функции яичников, относятся: a) arthropathia ovaripriva и б) osteoporosis menapausalis. При arthropathia ovaripriva больные жалуются на боли различной интенсивности, которые локализуются чаще в коленных и плечевом суставах, реже в локтевых и лучезапястных и еще реже в голеностопных и межфаланговых суставах. Характерным для заболевания является симметричность поражения: одновременно и быстро одно за другим наступают заболевания одноименных суставов — обоих коленных, обоих плечевых и т. д. В одних случаях заболевание протекает с нерезко выраженными субъективными явлениями, в других вызывает значительные боли, ограничение движений и быстро наступающую деформацию суставов. Последние заметно утолщаются, активные и пассивные движения становятся ограниченными и болезненными. При этом, рентгенологически костных изменений не отмечается и только в отдельных случаях выявляется утолщение суставной капсулы. Эффективным методом лечения этой патологии, дающим наиболее стойкий результат, является бальнео-физиотерапия, в частности грязелечение в комбинации с небольшими дозами эстрогенного гормона.
В настоящее время более изученной и чаще встречающейся формой патологии опорно-двигательного аппарата, связанной с недостатком в организме женщины эстрогенов, являются климактерические, особенно менопаузальные остеопорозы (osteoporosis menapausalis). Регулируя обмен кальция, эстрогенные гормоны способствуют повышению активности остеобластов, активируя процессы кальцификации костей. Понижение уровня эстрогенов у женщин в период климакса, особенно менопаузы, способствует образованию остеопорозов.
У женщин остеопорозы сильнее выражены и наступают значительно раньше, чем у мужчин. У первых остеопорозы встречаются в возрасте 55—56 лет, у мужчин — в возрасте 65—75 лет. Остеопорозы у женщин развиваются через 9—10 лет после физиологической и через 12—15 лет после искусственно вызванной менопаузы [Олбрайт, Рубенс (Rubens), Рейфенштейн (Reifenstein), Лихтвитц (Lichtwitz) и др.]. Такой большой промежуток времени показывает, что возникновение остеопорозов. обусловлено наряду с недостаточностью яичниковых гормонов другими, на сегодня еще неизвестными факторами.
Однако клинические и экспериментальные исследования показывают, что ведущую роль в возникновении менопаузальных остеопорозов все же играют яичниковые гормоны.
Больные остеопорозом жалуются на боли в спине, в области шейных позвонков, ребер, таза и особенно в пояснице. Незаметно появившиеся боли начинают усиливаться, становятся непрерывными, мало уступая болеутоляющим средствам. При физическом напряжении появляются острые боли, напоминающие боли в результате смещения позвонков. В начале заболевания наблюдаются рассеянные боли при надавливании на отростки спинных и поясничных позвонков. В более запущенных случаях отмечаются кифоз спины, сплющивание позвонков с ложными ребрами, которые приближаются к гребешкам подвздошных костей [Вейссенбах (R. Weissenbach)]. Рентгеноскопические исследования в начале заболевания почти ничего не выявляют, и лишь иногда отмечается трудно различимая прозрачность позвонков. Четкие рентгенографические данные наблюдаются лишь тогда, когда потеря кальция в организме достигает 30%. Параллельно с рентгенологическими исследованиями часто отмечается резко повышенная кальцинемия и кальциенурия — избыточное выделение кальция в кровь и мочу за счет неусвоения его костной тканью. Введение больших доз эстрогенов вызывает уменьшение экскреции кальция с мочой и калом при неизменившемся содержании кальция в крови. Это указывает на начавшееся усвоение кальция. Задержка кальция в организме при введении больших доз эстрогенов начинается с 5—6-го дня лечения, достигая максимума через 3—4 недели. Полученный эффект длится несколько недель. Клинико-экспериментальными исследованиями показано, что эстрогены не только задерживают в костях кальций и фосфор, активируя процессы кальцификации и усиливая роет остеобластов, но и вызывают рост костей путем образования новой костной ткани [Шейер (F. Scheuer), Альбо-Ферне (М. Albeaux-Fernet), Олбрайт и др.]. Действие андрогенов на костную ткань выражено значительно слабее. Введение в организм женщины андрогенов улучшает усвоение кальция кишечником, а следовательно, и его задержку в организме. Главное же значение андрогенов при лечении климактерических и менопаузальных остеопорозов заключается в нейтрализации действия эстрогенов на половые органы женщины. Андрогены, как и эстрогены, назначаются перорально и в виде инъекций. Наиболее принята следующая схема гормонального лечения: эстрогены, (натуральные или синтетические) по 2—3 мг ежедневно в течение 3—4 недель с перерывом на 10—15 дней + андрогены (метилтестостерон) по 5 мг 3 раза в день или тестостерон-пропионат по 25 мг 2—3 раза в неделю в течение 3—4 недель с перерывом на 10—15 дней. Повторно гормональное лечение следует проводить под контролем содержания кальция в крови и моче.
Помимо гормональной терапии, при менопаузальных остеопорозах показано: а) кальций в небольших дозах; нужно помнить, что при остеопорозах отмечается не недостаток кальция, а неусваяемость его организмом; характер соли кальция (хлористый кальций, глюконат кальция и др.) не имеет особого значения, так как под влиянием желудочного сока соли диссоциируют, превращаясь в ионы кальция; б) назначение витаминов: витамина D2 (антирахитический) по 15 мг (600 000 единиц) 2 раза в месяц. Большие дозы могут вызвать гипервита-миноз, включающий почечные (альбиминурия, гиперазотемия, артериальная гипертензия и др.), пищеварительные (отсутствие аппетита, боли в животе и др.), нервные (астения, головные боли) симптомы и, наконец, подкожное и сосудистое образование кальцификатов и парадоксальную декальцинацию костей (Вейссенбах); витамин С по 100—200 мг ежедневно; в) диетическое питание — пища, богатая белками (рыба, мясо); д) ортопедическое лечение — ношение специального корсета, учитывая боли при движении и хрупкость костей (особенно позвонков).
По имеющимся данным, результат лечения наступает медленно. После 2—3-месячного систематического комплексного лечения отмечается уменьшение и только через 4—12 месяцев прекращение болей, причем не всегда стойкое. Рентгенологические изменения (в сторону улучшения) наступают через 6—12 месяцев. Обострение процесса отмечается через несколько месяцев после прекращения лечения эстрогенами, которое, как указано выше, необходимо периодически повторять.
К заболеваниям опорно-двигательного аппарата, непосредственно связанным с эндокринными нарушениями, может быть отнесена мало изученная климактерическая миопатия — менопаузальная мышечная дистрофия, описанная М. Ихерн (М. Eachern), Кезер (Н. Е. Kaeser) и др. Авторы наблюдали медленно развивающуюся миопатию мышц тазового и плечевого пояса, наступавшую в период менопаузы. Временное излечение и улучшение давали препараты коры надпочечника (кортизон, преднизон, преднизолон) по 10 мг 2 раза в день ежедневно в течение 4—6 недель.
Кроме описанных заболеваний опорно-двигательного аппарата, в период климакса и менопаузы нередко встречаются другие процессы, являющиеся в основном обострениями ранее бывших латентно протекающих нарушений.
а) Хронические ревматические полиартриты. Длительно, месяцами и годами латентно протекающие полиартриты дают значительное обострение болей и всей клинической картины в периоде климакса. Заболевание нередко сопровождается расстройствами эндокриннотрофического характера (выпадение волос, дистрофия ногтей, нарушение пигментации), а также и вазомоторными, неврологическими и психическими нарушениями. По данным отечественных и зарубежных авторов, частота ревматических артритов значительно увеличивается у женщин в возрасте от 50 до 55 лет. Авторы отмечают, что благоприятный результат дают препараты кортизона, преднизолона и преднизона, быстро снимающие боли в суставах. Надо помнить, что названные препараты оказывают побочные действия в виде ожирения, которое особенно быстро наступает у женщин в период менопаузы. По данным отечественных авторов, применение эстрогенов (в небольших дозах) в сочетании с бальнео-физиотерапией дает улучшение общего состояния больных за счет уменьшения сопутствующих патологических явлений при незначительно выраженном улучшении со стороны двигательного аппарата;
б) Климактерические артральгии и остеоартриты. Процесс наступает независимо от травмы, простуды или другой видимой причины: Боли носят часто неясно выраженный мигрирующий характер. Объективных изменений, даже при наличии выраженных, строго локализованных болей в определенном суставе или в кости не отмечается. В отдельных случаях на пальцах ног, чаще рук, отмечаются утолщения в виде так называемых узлов Гебердена. При этом заболевании происходит гипертрофия хрящевых частей сустава, их дегенерация и образование анкилоза. По мнению некоторых авторов [Яшке (Jaschke), Пинель (Pinele) и др.], заболевание связано с угасанием функции яичников.
Такая связь, однако, не может считаться достаточно обоснованной. Лечение эстрогенами, по имеющимся данным, выраженного благоприятного действия также не оказывает.
Мы более подробно остановились на заболеваниях опорно-двигательного аппарата, в частности на остеопорозах, потому что заболевания эти нередко представляют большие трудности для диагностики, особенно в начальных стадиях развития. Женщины годами ходят от специалиста к специалисту с диагнозом климактерического невроза или с невыясненным диагнозом, пока, наконец, не выявляется истинное заболевание, ставшее к этому времени уже необратимым. В этой связи интерес представляет следующий случай.
Больной назначен синэстрол по одной таблетке (0,001 г) по 2 раза в день в течение 30 дней. При повторном посещении через 1,5—2 месяца больная отметила улучшение в общем состоянии — уменьшение приливов, а главное, выраженное облегчение болей в пояснично-крестцовой области, которые, однако вновь стали усиливаться после окончания приема синэстрола. Повторно назначенный рентгеновский снимок выявил остеопороз пояснично-крестцовых позвонков (L4—S3). Представляется, что остеопоротические изменения, активированные перенесенным гриппом, начались у больной в период менопаузы; 3 года, не поддаваясь активной неспецифической терапии, они оставались нераспознанными. Положительный терапевтический результат в связи с применением эстрогенной терапии дал нам основание подозревать, что причиной болей в пояснично-крестцовой области являются костные изменения, связанные с периодом менопаузы. Данные рентгенографического исследования подтвердили наше предположение.
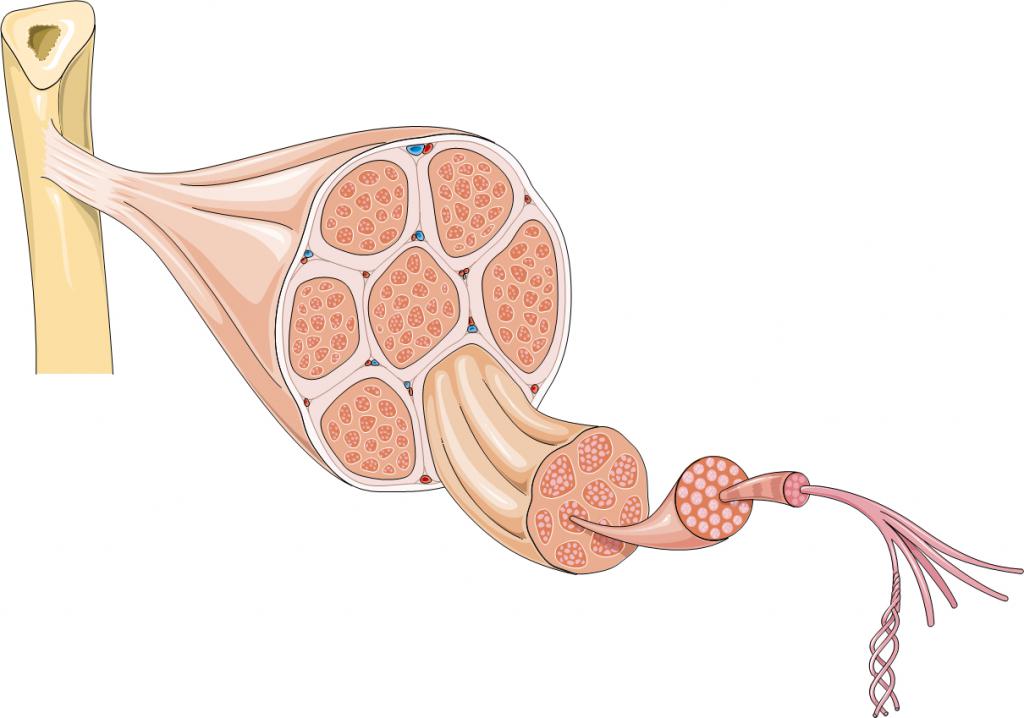
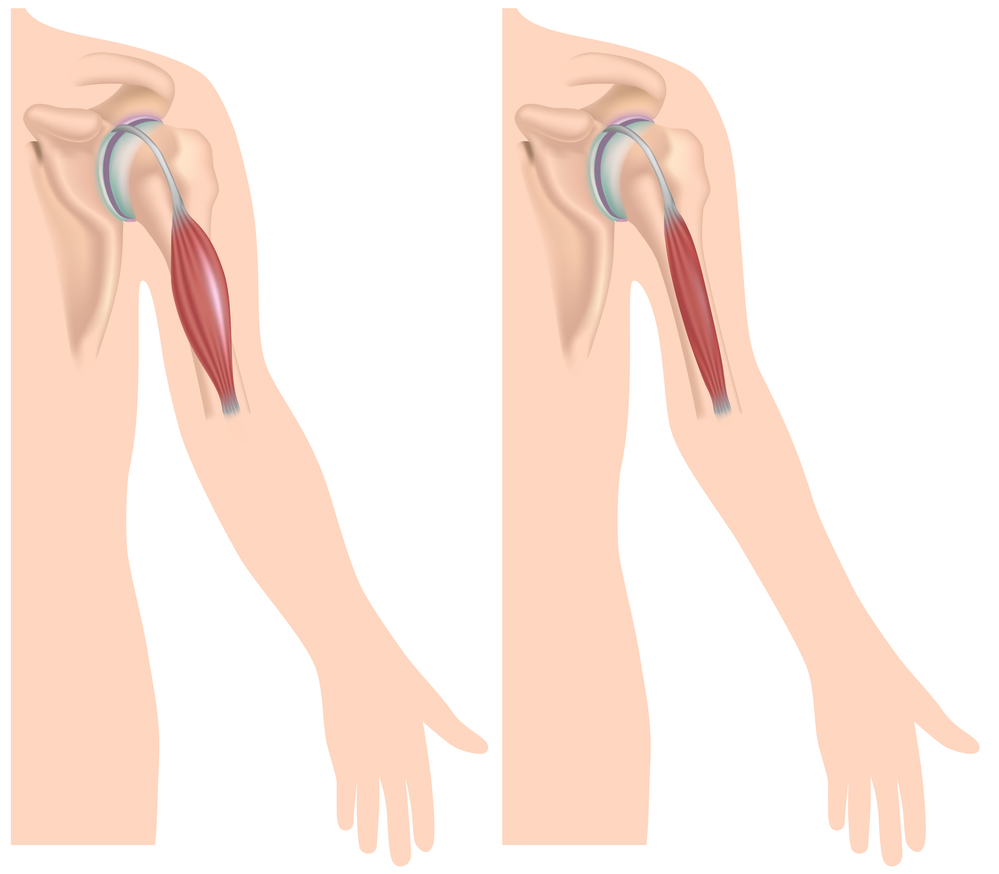
Мышечная дистрофия – это заболевание мышц (чаще всего скелетных), которое носит хронический характер. Заболевание характеризуется дегенерацией мышц, которая проявляется в снижении толщины мышечных волокон и нарастающей слабостью мышц. Больные мышечные волокна со временем начинают терять свою способность сокращаться, затем начинают постепенно распадаться и вместо них появляется соединительная и жировая ткань.
Чаще всего встречается такая форма этого недуга, как мышечная дистрофия Дюшенна. Симптомы этого заболевания можно наблюдать у мальчиков, но иногда они встречаются и у взрослых людей.
На сегодняшний день медицина еще не нашла таких способов, чтобы больной мог полностью избавиться от этой болезни. Но все же, существуют многие методы лечения, которые помогают облегчить пациенту симптомы мышечной дистрофии, а также значительно замедлить развитие заболевания.
Некоторые сведения о недуге
Мышечной дистрофией в медицине называют совокупность заболеваний, которые вызывают атрофию мышц. Основная причина этой болезни заключается в отсутствии в организме человека белка, который носит название дистрофин. Одним из самых распространенных видов этого заболевание является мышечная дистрофия Дюшенна.
В настоящее время ученые медицины проводят различные испытания, чтобы создать способ борьбы с мышечной дистрофией на генном уровне. А пока полностью излечиться от этого недуга невозможно.
Дистрофия мышц, прогрессируя, вызывает постепенное ослабевание мускулатуры скелета. Обычно заболевание диагностируется у представителей мужского пола. По статистическим данным 1 человек из 5 тысяч имеет такую патологию.
Заболевание передается на генетическом уровне, поэтому, если такой недуг имеется у одного из родителей, то очень большая вероятность, что симптомы мышечной дистрофии у детей тоже проявятся.
Виды мышечной дистрофии
Существует несколько разновидностей этого заболевания. К ним относятся:
- Мышечная дистрофия Дюшенна. Встречается значительно чаще, чем другие виды. Симптомы такой формы мышечной дистрофии у ребенка обычно появляются до трехлетнего возраста. Болеют чаще всего мальчики. Вначале заболевания происходит поражение мышц нижних конечностей и таза, затем расположенных в верхней половине тела, а после этого болезнь переходит на остальные группы мышц. Происходит дегенерация мышечной ткани и разрастание соединительной. Заболевание быстро прогрессирует. К 12 годам жизнь таких детей связана с инвалидным креслом, а в 20-25 лет большинство из них умирает от дыхательной недостаточности.
- Мышечная дистрофия Беккера. Встречается не очень часто. Симптомы схожи с предыдущим видом недуга. Разница только в том, что начало заболевания припадает на более поздние сроки. Кроме этого, оно прогрессирует более медленно. Больной человек обычно доживает до 45 лет, многие годы сохраняя удовлетворительное состояние. Инвалидом человек становится только на фоне травм или других сопутствующих болезней. Этим видом мышечной дистрофии чаще болеют люди маленького роста.
Симптомы заболевания
Симптомы мышечной дистрофии у взрослых и детей, в основном, имеют одинаковые проявления. У больных значительно снижен мышечный тонус, атрофия скелетных мышц приводит к нарушению походки. Пациенты не чувствуют мышечной боли, но при этом чувствительность в них не нарушена. Мышечная дистрофия у маленького пациента приводит к тому, что он теряет наработанные ранее навыки, когда он был еще здоровым. Больной ребенок перестает ходить и сидеть, не может удерживать голову и многое другое.

Болезнь постоянно прогрессирует, на месте мышечных волокон, которые отмирают, появляется соединительная ткань, и в результате этого мышцы увеличиваются в объеме. Больной чувствует себя постоянно уставшим, у него полностью отсутствуют физические силы.
В детском возрасте, если причиной заболевания стали генетические сбои, могут происходить различные неврологические расстройства в поведении, например, синдром дефицита внимания, гиперактивность, легкая форма аутизма.
Ниже будут приведены симптомы дистрофии мышечной ткани Дюшенна, так как эта форма является самой распространенной. Они очень похожи с аналогичным заболеванием Беккера, разница состоит лишь в том, что эта форма начинается не раньше 20-25 лет, протекает более мягко и медленнее прогрессирует.
Ранние и поздние симптомы
Среди ранних симптомов мышечной дистрофии следует выделить:
- чувство скованности в мышцах;
- у больного появляется ковыляющая походка;
- сложно бегать и прыгать;
- случаются частые падения;
- трудно находиться в сидячем или стоячем положении;
- больному легче ходить на пальчиках;
- ребенка сложно чему-либо обучать, он не может сконцентрировать свое внимание на чем-то одном, начинает говорить позже, чем здоровые дети.
- больной не может самостоятельно передвигаться на ногах;
- значительно сокращается длина сухожилий и мышц;
- происходит дальнейшее ограничение движений;
- больному настолько трудно дышать, что он не может обойтись без медицинской помощи;
- если у мышц не хватает достаточно силы, чтобы удерживать позвоночник, может возникнуть сильное его искривление;
- пациенту настолько трудно глотать, что иногда, чтобы покормить его, приходится применять специальную питательную трубку, а иногда это провоцирует развитие аспирационной пневмонии;
- происходит ослабевание мускулов сердца, что часто становится причиной различных сердечных заболеваний.
Причина заболевания мышечной дистрофией
Лечение дает лучшие результаты, когда известны причины болезни. Медицинские исследования показывают, что мышечную дистрофию провоцируют мутации на Х-хромосоме, при этом каждая отдельная форма недуга имеет разный набор мутаций. Но, тем не менее, они все не дают организму вырабатывать дистрофин, а без этого белка мышечная ткань не может восстанавливаться.
От общего количества белков, которые присутствуют в поперечнополосатых мышцах, всего лишь 0,002 процента составляет белок дистрофин. Но без него мышцы не могут нормально функционировать. Дистрофин относится к очень сложной группе белков, которые отвечают за правильную работу мышц. Благодаря белку различные компоненты внутри мышечных клеток скрепляются вместе, также белок связывает их с наружной мембраной.
При отсутствии или деформации дистрофина этот процесс нарушается. Это приводит к ослаблению мышц и разрушению мышечных клеток.
При диагнозе мышечная дистрофия Дюшенна дистрофина в организме больного человека очень маленькое количество. И чем его меньше, тем тяжелее симптомы и течение болезни. Также значительное уменьшение количества дистрофина наблюдается и при других видах этого недуга мышц.
Диагностика болезни

Для диагностики мышечной дистрофии используются разные методы. Генетические мутации, которые вызывают эту патологию, хорошо известны медицине, они используются для диагностирования заболевания.
В медицинских учреждениях используются следующие методы диагностического исследования:
- Генетическое тестирование. Наличие генетических мутаций свидетельствует о том, что у пациента имеется мышечная дистрофия.
- Ферментный анализ. При повреждении мышц вырабатывается креатинкиназ (КК). Если у больного каких-либо других повреждений мышц нет, а уровень КК повышен, то это может свидетельствовать о заболевании мышечной дистрофией.
- Сердечный мониторинг. Исследования с помощью электрокардиографа и эхокардиографа помогут обнаружить изменения в мускулах сердца. Такие методы диагностики хороши при определении миотонической мышечной дистрофии.
- Биопсия. Это способ диагностики, при котором отделяется кусочек мышечной ткани и исследуется под микроскопом.
- Мониторинг легких. То, как выполняют свою функцию легкие, тоже может указывать на наличие патологии в мышцах.
- Электромиография. В мышцу вводится специальная игла и измеряется электрическая активность. По результатам видно, имеются ли признаки синдрома мышечной дистрофии.
Как лечить заболевание
До сих пор научная медицина не придумала еще лекарств, которые могли бы полностью излечить больного от такой патологии мышц. Различные способы лечения способны только поддержать двигательные функции человека и замедлить прогрессирование болезни, как можно дольше. У взрослых и у детей мышечную дистрофию, симптомы и лечение определяет врач. Как правило, для борьбы с таким заболеванием используют медикаментозное лечение и физиотерапию.
Лекарственные препараты

Для медикаментозного лечения мышечной дистрофии у ребенка, а также у взрослого человека применяют две группы препаратов:
- Кортикостероиды. Лекарства этой группы помогают замедлить процесс развития заболевания и увеличить мышечную силу. Но если использовать их очень долгое время, то это может привести к ослаблению костей скелета и значительно прибавить больному вес.
- Сердечные препараты. Применяются в случае, когда заболевание неблагоприятно влияет на нормальную работу сердца. Это такие лекарства, как ингибиторы ангиотензинпревращающего фермента и бета-блокираторы.
Физиотерапия
К этому методу лечения относится выполнение специальных физических упражнений по растяжке и движению мышц. Такая лечебная физкультура дает больному возможность передвигаться более длительное время. Во многих случаях замедлить развитие заболевания также помогают простая ходьба и плавание.
Так как прогрессирование болезни приводит к ослаблению мышц, которые нужны при дыхании, больному может потребоваться дыхательная помощь. Для этого используются специальные устройства, помогающие в ночное время улучшить доставку кислорода. На поздних стадиях заболевания может понадобиться аппарат искусственного дыхания.
Больному человеку очень трудно передвигаться. Чтобы хоть как-то помочь ему в этом, рекомендуется использовать трости, ходунки, инвалидные коляски.
Также, чтобы замедлить укорочение мышц и сухожилий и удерживать их растянутыми, применяются ортезы. Кроме этого, такое приспособление дополнительно поддерживает пациента при движении.

Профилактика мышечной дистрофии
Тот факт, будет ли ребенок болен мышечной дистрофией Дюшенна, в наше время можно определить еще до того, как малыш появится на свет. Дородовая диагностика заболевания проводится следующим образом – берутся амноитическая жидкость, кровь плода или его клетки и проводится исследование на наличие в генетическом материале мутаций.
Если семья планирует завести ребенка, но кто-то из родственников болеет мышечной дистрофией, то женщина перед тем, как планировать беременность, должна обязательно пройти обследование. После него станет известно, нет ли у нее такой патологии.
У женщин дефектный ген может появиться из-за изменений в гормональном фоне. Их причинами может стать беременность, начало менструации или климакс. Если у матери есть такой ген, то он передается ее сыну. В возрасте 2-5 лет появляется мышечная дистрофия.
Медицинский справочник болезней
Миопатия. Формы, причины, симптомы и лечение миопатий.
Миопатия — прогрессирующая мышечная дистрофия — сборная группа заболеваний, характеризующихся первичным дистрофическим процессом в мышечной ткани.
Причины.
Относится к наиболее часто встречающимся хроническим заболеваниям нервно-мышечного аппарата и носит наследственный характер.
Различные экзогенные вредности (травмы, инфекция, интоксикация) могут выявить имеющуюся патологию или вызвать ухудшение текущего процесса. Для установления семейного характера заболевания необходим не только тщательный анамнез, но и по возможности более полный осмотр всех членов семьи с выявлением так называемых малых признаков заболевания.
Наличие спорадических случаев не исключает наследственную природу.
Следует также иметь в виду возможность фенокопий миопатии, т.е. симптоматических форм или миопатических синдромов.
Патологоанатомия.
При патологоанатомических исследованиях в нервной системе не находят характерных изменений. В редких случаях отмечаются незначительное уменьшение клеток передних рогов спинного мозга, иногда — изменения в двигательных нервных окончаниях в виде набухания миелиновой оболочки, изменения осевых цилиндров. В моторных бляшках исчезает фибриллярная структура. Грубые изменения находят в поперечнополосатых мышцах. Мышцы истончены, большая часть волокон замещена соединительной тканью и жиром. Характерна неравномерность отдельных мышечных волокон — одни волокна резко уменьшены, другие, наоборот, резко увеличены.
В поздних стадиях заболевания почти вся мышечная ткань замещена соединительной или жировой тканью. В сосудах наблюдается пролиферация адвёнтиции, сужение просвета и иногда пристеночное тромбообразование. По мере развития процесса увеличивается общая масса эндо- и перимизиальной соединительной ткани с образованием фиброзного футляра вокруг мышечных волокон и внутримышечных кровеносных сосудов.
При гистохимическом исследовании наблюдается увеличение кислых муко- полисахаридов в основном веществе мышц и коллагеновых волокнах.
Патогенез.
Патогенез миопатий до настоящего времени неясен. Первичный биохимический дефект не установлен. Наиболее значительным изменениям подвергается белковый и углеводный обмен в мышечной ткани. В последнее время высказана гипотеза о нарушении обмена циклических нуклеотидов (циклических АМФ и ГМФ), являющихся универсальными регуляторами внутриклеточного обмена и ответственными за реализацию генетической информации.
Клиническая картина.
Симптоматика миопатий характеризуется нарастающими атрофиями произвольной мускулатуры. Параллельно развитию мышечного похудания появляются и парезы, однако мышечная слабость обычно выражена меньше, чем степень атрофии.
В связи с медленным прогрессированием процесса и неравномерностью поражения отдельных мышечных групп и даже участков мышц создаются условия для относительной компенсации двигательного дефекта: больные миопатией длительное время остаются трудоспособными и могут себя обслуживать, прибегая к ряду характерных вспомогательных движений. Постепенно угасают сухожильные рефлексы. Чувствительность, координация движений не нарушаются. Тазовые функции всегда сохранены.
Для некоторых видов миопатий характерны наличие псевдогипертрофий, наклонность к концевым атрофиям и сухожильным ретракциям. Фасцикулярные подергивания отсутствуют. Механическая возбудимость мышц снижена.
Нередко наблюдаются те или иные изменения внутренных органов,
- главным образом сердца: расширение границ, глухость тонов, нарушение проводимости, подтверждаемое электрокардиограммой;
- страдает функция внешнего дыхания;
- вегетативные нарушения выражаются цианозом кистей и стоп, резко повышенной потливостью, похолоданием дистальных отделов конечностей, асимметрией кожной температуры, пульса, повышенным пиломоторным рефлексом;
- страдает микроциркуляция в мышцах конечностей;
- рентгенография трубчатых костей позволяет обнаружить дистрофические явлени я;
- при электромиографическом исследовании констатируется характерная картина — снижение амплитуды биопотенциалов при достаточной частоте, а также укорочение длительности одиночного потенциала и полифазный характер;
- при биохимических исследованиях находят нарушения в креатин-креатининовом обмене. Почти всегда в моче значительно уменьшается количество креатинина и появляется креатин. Креатиновый показатель в известной степени говорит о тяжести дистрофического процесса. Отмечается значительная аминоацидурия. При ряде форм миопатий очень рано (в преклинической или в начальной клинической стадии) можно обнаружить увеличение ферментов в сыворотке крови. В первую очередь это касается специфического для мышечной ткани фермента креатинфосфокиназы;
- увеличивается также содержание аминофераз и альдолаз . Уменьшена артериовенозная разница содержания сахара крови, увеличено содержание пировиноградной и молочной кислот в мышцах и в крови. Как правило, уменьшен уровень лимонной кислоты в крови. Имеются данные о специфичности некоторых биохимических изменений при различных типах миопатий.
Классификация миопатий.
До настоящего времени нет достаточно обоснованной и общепринятой классификации миопатий. В большинстве случаев используют классификацию, основанную на клиническом принципе.
Псевдогипертрофическая форма Дюшенна является одной из наиболее частых форм миопатий. Она характеризуется самым ранним началом заболевания — нередко с 2—5-летнего возраста, а иногда даже с первого года жизни, и наиболее злокачественным течением. В типичных случаях дети к 10—12 годам уже с трудом ходят и к 15 годам становятся полностью обездвиженными.
В первую очередь страдают мышцы проксимальных отделов нижних конечностей, тазового пояса, затем в процесс вовлекаются мышцы проксимальных отделов рук. Рано выпадают коленные рефлексы. Характерна псевдогипертрофия икроножных мышц; часто уплотнение и гипертрофия их являются первым симптомом заболевания.
Псевдогипертрофии могут наблюдаться и в других группах мышц — ягодичных, дельтовидных, иногда — в языке; отмечаются значительно выраженные ретракции, в первую очередь со стороны ахилловых сухожилий. Нередко страдает сердечная мышца. Отмечается снижение интеллекта в разной степени выраженности. Для миопатии Дюшенна очень характерен высокий уровень ферментов сыворотки крови, особенно креатинфосфокиназы. Повышенный уровень ферментов можно обнаружить и у носительниц мутантного гена.
Заболевание передается по рецессивному, сцепленному с Х-хромосомой типу. Болеют только мальчики, матери являются кондукторами. Риск заболевания сыновей матерей-носительниц 50 %; 50 % дочерей становятся носителями патологического гена. Пенетрантность высокая.
Доброкачественная псевдогипертрофическая миопатия, сцепленная с Х-хромосомой (миопатия Беккера), выделена в самостоятельную форму в связи с рядом особенностей. Начало заболевания — чаще между 12 и 25 годами, иногда раньше. Течение мягкое, прогрессирование медленное, больные многие годы сохраняют трудоспособность или самообслуживание. Интеллект всегда сохранен. В остальном клиническая картина подобна псевдогипертрофической форме Дюшенна.
Плечелопаточно-лицевая форма Ландузи — Дежерина — относительно часто встречающийся тип миопатии.
Начинается заболевание, как правило, в детском или юношеском возрасте; течение сравнительно благоприятное. Первые симптомы касаются поражения мышц лица, особенно круговой мышцы рта, или мышц плечевого пояса. К этому присоединяется слабость и похудание мышц проксимальных отделов рук, затем развивается парез дистальных отделов ног. Наблюдаются умеренные гипертрофии мышц, а затем своеобразные патологические позы из-за неравномерности атрофии различных групп мышц и ретракций. Сухожильные рефлексы долго остаются сохраненными. Может быть асимметрия поражения.
Заболевание передается по аутосомно-доминантному типу с полной пенетрантностью, страдают в равной степени мужчины и женщины. Отмечаются отчетливые различия в тяжести клинических признаков не только в разных семьях, но и у разных членов одной семьи (могут быть тяжелые, легкие и абортивные формы).
Описаны стертые формы. В сыворотке крови находят умеренное повышение ферментов. Начало заболевания очень вариабельно— от детского возраста до сравнительно зрелого, но чаще в начале второго десятилетия, что отражает название этой формы. Также изменчив характер течения — иногда мягкое, благоприятное, иногда очень злокачественное.
Большинство авторов признают аутосомно-рецессивный тип наследования заболевания. Часты спорадические формы и фенокопии. Болеют одинаково часто мужчины и женщины.
Дистальная форма миопатии встречается редко.
Характеризуется поражением мышц голеней, стоп, предплечий, кистей, постепенно процесс генерализуется. Отмечаются ретракции, концевые атрофии мышц. Заболевание начинается в сравнительно позднем возрасте — 20—25 лет; прогрессирование, как правило, медленное. Отсутствие расстройств чувствительности, нормальная скорость проведения возбуждения, повышенный уровень сывороточных ферментов отличают дистальную миопатию от невральной амиотрофии.
Тип наследственной передачи—аутосомно-доминантный с неполной пенетрантностью. Несколько чаще болеют лица мужского пола.
Лопаточно-перонеальная амиотрофия (миопатия Давиденкова) проявляется поражением дистальных мышц нижних и проксимальных отделов верхних конечностей и мышц плечевого пояса. Начинается заболевание сравнительно поздно — в 25—30 лет. Наблюдаются концевые атрофии, например в большой грудной мышце, иногда крупные фасцикулярные подергивания, раннее угнетение сухожильных рефлексов.
В ряде случаев отмечаются легкие расстройства чувствительности — дистальные парестезии, гипестезии, иногда умеренная боль. Почти никогда не бывает креатинурии.
При электромиографическом исследовании выявляются специфические изменения, отличающие эту форму от обычной миопатии и невральной амиотрофии Шарко — Мари (дизритмичные колебания в покое, снижение амплитуды, уменьшение частоты и иногда групповые спайковые разряды при активных движениях).
Таким образом, данная форма является как бы промежуточной между первичной миопатией и невральной амиотрофией. Некоторые авторы рассматривают эту форму лишь как особый вариант (скапуло-перонеальный синдром) плечелопаточно-лицевой миопатии Ландузи — Дежерина.
Редкие варианты миопатии.
Описано большое количество различных вариантов прогрессирующего мышечного поражения наследственного характера. Так, например, описаны миопатия четырехглавой мышцы бедра, миосклеротическая миопатия, мышечная дистрофия с истинными гипертрофиями, врожденная мышечная дистрофия с медленным и быстрым прогрессированием, иногда с катарактой, мышечный инфантилизм и др.
Непрогрессирующие миопатии включают группу заболеваний, отличающихся или своеобразными изменениями строения мышечных клеток, или специфическими биохимическими нарушениями. Проявляются эти состояния сравнительно рано, обычно на 1—3-м году жизни, имеют сравнительно благоприятное течение. Диагноз может быть поставлен после биопсии мышц, иногда только после электронно- микроскопического исследования.
Болезнь центрального стержня характеризуется резким снижением или полным отсутствием ферментативной активности в центральной части мышечного волокна, что выявляется при окраске препарата мышечной ткани трехвалентным хромом по Гомори.
Клиническая картина: снижение мышечного тонуса, дряблость мышц, задержка развития двигательных функций, в позднем возрасте — умеренная слабость проксимальных отделов и гипотрофия мышц.
На ЭМГ — уменьшение длительности колебаний потенциала и увеличение полифазных потенциалов. Передача по доминантному типу с неполной пенетрантностью. Часты спорадические случаи.
Немалиновая, или нитеобразная, миопатия проявляется врожденной мышечной слабостью конечностей и лица с понижением мышечного тонуса и отсутствием сухожильных рефлексов. Описаны изменения скелета, в частности деформация грудной клетки, сколиоз.
На ЭМГ — изменения, характерные для мышечного уровня поражения. При электронно-микроскопическом исследовании выявляются своеобразные нитевидные структуры под сарколеммой.
Миотувулярная миопатия клинически выражается в понижении мышечного тонуса, умеренно выраженных атрофиях мышц конечностей с наличием диффузной слабости рук, ног, туловища. Характерны также слабость мимической мускулатуры, птоз и ограничение подвижности глазных яблок, общая задержка развития двигательных функций. Состояние может быть стационарным или медленно прогрессирующим. У большинства больных выявляются те или иные костные деформации.
На ЭМГ — сочетание мышечного типа изменений с наличием спонтанной активности. Гистологически определяются мышечные волокна резко уменьшенной величины с центральным расположением ядер, напоминающие по строению эмбриональную мышечную ткань. При электронной микроскопии выявляются участки дегенеративно измененных миофибрилл, при гистохимическом исследовании обнаруживается повышение активности митохондри- альных ферментов.
Митохондриальные миопатии характеризуются увеличением числа митохондрий в мышечных волокнах или увеличением размеров митохондрий, обнаруживаемых при электронно-микроскопическом исследовании. Клинически отмечается мышечная слабость, главным образом в проксимальных отделах рук и ног, вялость, быстрая утомляемость при отсутствии особых мышечных атрофий. Прогрессирования, как правило, не отмечается.
Диагноз прогрессирующей мышечной дистрофии, как правило, не представляет больших трудностей. Атипичные формы приходится дифференцировать от сирингомиелии (переднероговая форма), начальных явлений амиотрофического склероза, спинальных амиотрофий, полимиозита и других миопатических синдромов (см.). Комплексное обследование больного с применением биохимических (определение уровня ферментов и др.), электрофизиологических (ЭМГ, определение скорости распространения возбуждения по нерву), гистологических исследований и анализ клинической картины позволяют поставить правильный диагноз.
ЛЕЧЕНИЕ.
- Воздействие на энергетической обмен в мышцах осуществляется назначением АТФ в виде монокальциевой соли по 3—6 мл в день внутримышечно в течение 30 дней.
- Показано применение витамина Е внутрь по 30—40 капель 3 раза в день или внутримышечно раствор токоферола ацетата в масле по 1—2 мл — 20 инъекций (или эревит).
- Назначают витамины группы В, гликокол, лейцин (по 1 столовой ложке 3 раза в день), глутаминовую кислоту (по 0,5—1 г 3 раза в день).
Накопленный опыт по применению анаболических гормонов не подтверждает возлагавшихся на этот вид лечения надежд.
- Рекомендуется сочетать медикаментозное лечение с физиотерапией (гальванический воротник и гальванические трусы с кальцием, солянохвойные ванны со строго индивидуальной лечебной физкультурой при средней нагрузке).
- При наличии контрактур может быть рекомендовано оперативное вмешательство на сухожилиях.
- Показан систематически проводимый легкий массаж.
