Кумулятивная вероятность беременности в течение 3 лет у женщин с идиопатическим бесплодием (то есть при отсутствии патологии органов малого таза) существенно выше, чем у женщин, страдающих минимально выраженным или мягко протекающим эндометриозом без лечения (54,6 и 35,5% соответственно; р=0,048). Установлено, что у бесплодной пары, в которой женщина страдает эндометриозом I—II стадии, месячный коэффициент плодовитости составляет 3% на цикл.
Курение снижает вероятность беременности и живорождения в обеих группах. Медикаментозная супрессивная терапия пероральными контрацептивами или агонистами люлиберина не повышает вероятность наступления беременности.
Хирургическое вмешательство при минимально выраженном или мягко протекающем эндометриозе повышает вероятность наступления спонтанной беременности. Однако увеличивается ли абсолютное количество беременностей — вопрос спорный. С целью уточнения этого аспекта было проведено два рандомизированных клинических исследования: мультицентровое исследование в Канаде и исследование в Италии. В канадском исследовании было продемонстрировано статистически значимое улучшение.
Коэффициент продолжающихся беременностей составил 29% в группе получавших лечение и 17% — в группе не получавших. Количество больных, которых необходимо лечить (которых необходимо прооперировать, чтобы получить одну дополнительную беременность), составило 9 (ДИ 95%, от 5 до 33). В итальянском исследовании вероятность наступления беременностей не повысилась. Метаанализ этих исследований показал, что в Канаде отмечалось улучшение, но со снижением коэффициента. Послеоперационная супрессивная медикаментозная терапия, проводимая после хирургического вмешательства, не улучшает фертильность. Эффективность ее доказана лишь перед планируемым ЭКО в случаях тяжелого и умеренного эндометриоза.
Если хирургическое лечение эндометриоза на ранних стадиях оказывается неэффективным или пациентка отказывается от операции, следующий этап лечения — назначение кломифена цитрата и внутриматочиое оплодотворение, затем — гонадотропин хорионический и внутриматочиое оплодотворение. Каждый из методов повторяется по три цикла.
В далеко зашедших случаях заболевания хирургическое вмешательство улучшает фертильность. Однако хирургическая операция достаточно сложна и требует тщательного подхода к оперативному доступу. Если первое оперативное вмешательство по поводу запущенного эндометриоза оказывается неэффективным, последующая операция менее эффективна в плане наступления беременности, чем ЭКО, поэтому его следует применять только в отношении пациенток, нуждающихся в хирургическом лечении болевого синдрома. Кломифена цитрат* или гонадотропин хорионический плюс внутриматочиое оплодотворение показаны женщинам на поздних стадиях эндометриоза, у которых не изменены трубы и присутствует минимально выраженный спаечный процесс.
Эффективность агонистов люлиберина, назначаемых перед цикловым использованием гонадотропина хорионического и внутриматочным оплодотворением, до настоящего времени не доказана.
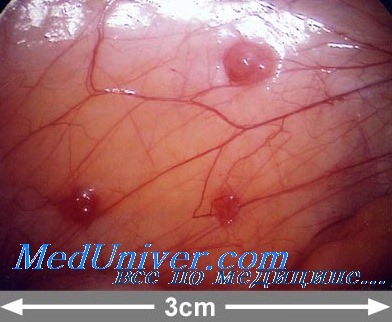
При метаанализе обсервационных исследований было показано, что при эндометриозе ЭКО характеризуется меньшим процентом возникновения беременностей по сравнению с трубным бесплодием, особенно в далеко зашедших случаях. Неясно, обусловлены статистически значимо сниженные коэффициенты беременности после ЭКО предыдущим хирургическим вмешательством или просто запущенностью самого заболевания.
Эндометриомы необходимо удалять и проводить исследование, исключающее их злокачественность. Удаление эндометриомы может улучшать спонтанную фертильность. Исходы ЭКО одинаковы у пациенток с эндометриомами и без них. Однако количество яйцеклеток, коэффициент оплодотворения и количество полученных эмбрионов снижены у женщин с ранее леченными эндометриомами по сравнению с пациентками без эндометриом. В аспекте ЭКО при овари-альных эндометриомах возникают следующие вопросы.
• Ухудшает ли наличие эндометриомы исход ЭКО? По этой проблеме не было рандомизированных клинических исследований. По-видимому, небольшие эндометриомы (4 см и менее) не влияют на исход ЭКО, что делает хирургическое вмешательство при этом необоснованным.
• Ухудшает ли удаление эндометриомы исход ЭКО? Преобладают доказательства того, что у женщин с клиническими проявлениями заболевания можно удалять эндометриомы без опасения нарушить функции яичников или отрицательно повлиять на исход ВРТ. Более того, удаление крупных эндометриом (4 см и более) иногда необходимо для получения доступа к яичнику. Случайный прокол эндометриомы во время забора яйцеклетки способен привести к инфекционным осложнениям.
Может понадобиться гистологическое подтверждение доброкачественности крупной эндометриомы. Хирургические методы удаления эндометриом оценивали в нескольких клинических исследованиях; была предпринята попытка определить, какой из доступов наносит наименьшее повреждение яичнику. Удаление путем срезания кисты с яичника приводит к одновременному удалению ткани яичника более чем в 50% случаев. При наличии кист с истинными капсулами это происходит лишь в 6% случаев. Тем не менее описаны случаи обнаружения нескольких фолликулов в ткани яичника, удаленной вместе с эндометриомой.
В одном из рандомизированных исследований было показано, что иссечение эндометриом ассоциировано с меньшей частотой рецидивов и более высоким коэффициентом фертильности по сравнению с фенестрацией и биполярной коагуляцией. Простое дренирование эндометриомы оказалось неэффективным.
Более 70 лет назад немецкие учёные Aschheim и Zondek привели убедительные доказательства гонадотропной функции передней доли гипофиза. Вскоре последовало разделение эффектов введения экстракта передней доли гипофиза на фолликулостимулирующий и лютеинизирующий. В 1932 г. Нohlweg и Junkmann но только в 1960 г. McCann и соавт. выявили ЛГ — рилизинг — фактор в гипоталамусе крысы. Впоследствии Schally и Guillemin установили, что гонадротропин — рилизинг — гормон (ГнРГ) является декапептидом и расшифровали его структуру.
Как известно, в передней доле гипофиза образуется два различных гонадотропных гормона, отличающихся по химической структуре и иммунологическим свойствам: фолликулостимулирующий гормон (ФСГ), или фоллитропин, лютеинизирующий гормон (ЛГ), или лютропин. Кроме того, здесь продуцируются адренокортикотропный гормон (АКТГ), или кортикотропин, тиреотропный гормон (ТТГ) или тиреотропин, соматотропный гормон (СТГ), или гормон роста, а также пролактин (ПРЛ), угнетающий продукцию гонадотропных гормонов. Относительная молекулярная масса ФСГ и ЛГ человека составляет около 32000. Эти гормоны могут существовать в виде мономеров, димеров и тетрамеров (10). Выделение ФСГ, ЛГ и ПРЛ регулируется рилизинг — и рилизинг — ингибирующими факторами гипоталамуса.
По-видимому, выделение ГнРГ зависит от дофамина, содержащегося в нервных окончаниях гипоталамуса; в свою очередь, ГнРГ действует на ФСГ- и ЛГ- секреторные клетки аденогипофиза. Секреторная активность гипоталамуса и гипофиза модулируется эстрогенами, прогестероном и тестостероном по — разному. Полагают, что ГнРГ оказывает сходное действие у мужчин и женщин, за исключением цикличности его выделения (у женщин), определяемой гипоталамусом. Регуляторная активность ГнРГ сосредоточена в двух центрах: тоническом (в вентро-медиальном и дугообразном ядрах) и циклическом (в преоптической супрахиазмальной области). У мужчин тонический центр доминирует, активизируя гипофиз и, вследствие этого, деятельность яичек, что вызывает сперматогенез и синтез тестостерона.
Регуляция репродукции и функция гонад осуществляется, преимущественно, гонадотропными гормонами, секретируемыми аденогипофизом, — ФСГ, ЛГ и ПРЛ (12). ФСГ вызывает пролиферацию гранулёзных клеток, стимулируя рост фолликулов, ЛГ – активизирует синтез андрогенов и совместно с ФСГ способствует овуляции. Секреция ФСГ и ЛГ регулируется ГнРГ по принципу обратной связи, осуществляется в циклическом режиме, но зависит также от уровня эстрогенов и андрогенов.
По химической структуре ЛГ и ФСГ — гликопротеиды, состоящие из двух полипептидных субъединиц α и β. Субъединица α этих гормонов является общей для каждого гликопротеида и имеет одинаковую последовательность аминокислот; β — субъединица отличается среди гликопротеидов по последовательности входящих в неё аминокислот. Именно β- субъединица отвечает за гормональную специфичность. В отдельности друг от друга обе субъединицы биологически неактивны.
Подобно стероидам, гонадотропины оказывают биологический эффект на ткани — мишени посредством активации специфических рецепторов. Однако, в отличие от стероидных гормонов, рецепторы гонадотропинов связаны с мембраной клеток — мишеней. Поверхностные клеточные рецепторы к пептидным гликопротеиновым гормонам являются белками, входящими в структуру клеточной мембраны. После связывания с гонадотропином мембранные рецепторы стимулируют выработку растворимых внутриклеточных мессенджеров, которые, в свою очередь, обеспечивают клеточный ответ (12).
Согласно современным представлениям, регуляторами выработки ФСГ, помимо гипоталамических либеринов, являются ингибин и активин, продуцируемые гранулёзными и лютеиновыми клетками яичников, а также клетками цитотрофобласта. На синтез и выделение ФСГ оказывает влияние также фоллистатин, выделенный из фолликулярной жидкости. Существует три типа секреции гонадотропинов: тонический, циклический и эпизодический (пульсирующий). Тоническая (базальная) секреция гонадотропинов регулируется посредством отрицательной обратной связи, циклическая — механизмом положительной обратной связи (с участием эстрогенов), пульсирующая секреция — обусловлена активностью гипоталамуса и высвобождением гонадолиберинов.
Развитие фолликула в первой фазе цикла происходит, благодаря тонической секреции ФСГ и ЛГ. Повышение секреции эстрадиола приводит к торможению образования ФСГ. Следовательно, ФСГ приводит к синтезу в определённом фолликуле эстрогенов, которые, увеличивая количество рецепторов к ФСГ, способствуют его накоплению (путём связывания рецепторами), дальнейшему созреванию фолликула и увеличению секреции эстрадиола; другие фолликулы в это время подвергаются атрезии. Концентрация эстрадиола в крови достигает максимума в крови в предовуляторный период, что приводит к высвобождению большого количества гонадолиберина. За этим следует пик предовуляторного повышения ЛГ и ФСГ, стимулирующий разрыв граафова пузырька и овуляцию.
ЛГ является основным регулятором синтеза стероидов в яичниках. Рецепторы к ЛГ локализуются на лютеальных клетках, а влияние ЛГ опосредуется через стимуляцию аденилат — циклазы и внутриклеточного повышения уровня цАМФ. Активируются ферменты, участвующие в биосинтезе прогестерона, под влиянием ЛГ в яичниках увеличивается количество холестерина, необходимого для синтеза гормонов, повышается активность ферментов семейства цитохромов Р450 и других ферментов, участвующих в синтезе прогестерона, а также и других стероидов. Таким образом, в жёлтом теле под влиянием ЛГ усиливаются процессы стероидогенеза.
Гонадотропные гормоны применяют для индукции овуляции, что имеет большое значение для лечения так называемого функционального женского бесплодия, в генезе которого существенное место занимают ановуляторные нарушения.
Перед началом лечения необходимо проведение соответствующих гормональных исследований, позволяющих провести дифференциальную диагностику первичной гипоталамо — гипофизарной недостаточности с первичной овариальной. Например, нормальный или часто пониженный уровень ФСГ, позволяет думать о первичных нарушениях в гипоталамо — гипофизарной области. На этой стадии диагностики нередко появляется необходимость исключения опухоли гипофиза. Невозможность вызвать менструацию после лечения высокими дозами эстрогенов, может свидетельствовать о маточной форме аменореи.
В медицинской практике в качестве препаратов, обладающих активностью ФСГ, применяют гонадотропин менопаузный (менотропины), а также его гомологи (урофоллитропин, фоллитропин — альфа, фоллитропин — бета) – табл. 1. Гонадотропин менопаузный получают из мочи женщин, находящихся в менопаузе. Препаратом, обладающим активностью ЛГ, является гонадотропин хорионический, получаемый из мочи беременных женщин. Все гонадотропины, как известно, представляют собой полипептиды, разрушающиеся ферментами при приёме внутрь, посему эффективны только при парентеральном введении.
Табл. 1 Препараты гонадотропинов (2)
- КЛЮЧЕВЫЕ СЛОВА: тазовая боль, эндометриоз, агонисты ГнРГ, эндокринология
Хроническая тазовая боль (ХТБ) относится к группе болевых синдромов, включающей такие значимые заболевания и состояния, как остеоартроз, миофасциальные боли, радикулопатия, головные боли и др. Актуальность проблемы ХТБ определяется и высокой распространенностью, и этиологическим разнообразием синдрома. ХТБ встречается приблизительно у 15% женщин в возрасте 18–50 лет. Даже если не учитывать гастроэнтерологические, урологические и прочие болезни, ассоциированные с ХТБ, одни только гинекологические нарушения, лежащие в основе ХТБ, представляют собой широкую палитру заболеваний: эндометриоз, злокачественные опухоли, синдром остаточных яичников, синдром тазовой венозной конгестии, воспалительные заболевания органов малого таза, туберкулезный сальпингит, спаечный процесс в малом тазу, кистозная доброкачественная мезотелиома, миома, послеоперационные жидкостные образования брюшной полости воспалительного и невоспалительного генеза, аденомиоз, дисменорея и овуляторные боли, неэндометриоидные кисты придатков матки, атрезия цервикального канала, внематочная беременность, хронический эндометрит, полипы эндометрия и цервикального канала, эндосальпингоз (дистопия эпителия маточных труб), осложнения внутриматочной контрацепции (внутриматочная спираль), пролапс гениталий.
Причины развития эндометриоза не ясны. Пик заболеваемости приходится на 25–40 лет. К факторам риска относят неблагоприятные экологические условия (диоксин, продукты сгорания топлива), стресс, ранние, обильные, длительные менструации, короткие менструальные циклы, отсутствие родов, обструктивные пороки развития гениталий, спонтанные и артифициальные аборты, внутриматочную спираль [3]. Главными патогенетическими звеньями эндометриоза считаются локальное нарушение гормонального баланса, увеличивающее пролиферативный потенциал эктопических эндометриальных клеток, генетически детерминированная склонность к избыточной пролиферации [4, 5], а также персистирующее воспаление, вызванное как функционированием эндометриоидных гетеротопий, так и особой (вероятно, врожденной) склонностью тканей к избыточной воспалительной/иммунной реакции [6]. Не исключено, что характер восприятия болевого сигнала при эндометриозе, так же как и другие элементы воспалительной реакции, имеет генетически детерминированные особенности.
Патофизиология эндометриоза неразрывно связана с формированием его главного симптома – тазовой боли. Активированные макрофаги, продуцирующие различные цитокины [6], не только участвуют в имплантации эндометриальных клеток, но и вызывают болевой сигнал. Например, интерлейкин-1 индуцирует синтез простагландинов, стимулирует пролиферацию фибробластов, накопление коллагена и образование фибриногена, то есть процессы, которые способствуют фиброзу и образованию спаек. Матриксные металлопротеиназы, воздействуя на компоненты внеклеточного матрикса и вызывая его деструкцию, способствуют фиксации и имплантации эктопического эндометрия в подлежащие ткани, вместе с тем провоцируя каскад воспалительных изменений [7]. В результате реализации воспалительной реакции, локальной гиперэстрогении, повышенной активности макрофагов и цитокинов в тканях вырабатываются простагландины, избыточная концентрация которых ответственна за возникновение боли [6].
- тяжелая (нестерпимая) тазовая боль или другие основания предполагать наличие инфильтративного эндометриоза;
- наличие тазовой боли у пациентки с впервые обнаруженной кистой яичника;
- дополнительные показания к лапароскопии.
Эмпирическое лечение болевого синдрома при подозрении на эндометриоз может проводиться в виде трехмесячного курса прогестинов, КОК или агонистов ГнРГ. Следует учитывать, что КОК могут назначаться только женщинам, нуждающимся в предохранении от беременности. Прогестины и агонисты ГнРГ являются равноценными средствами; назначение оральных прогестинов следует предпочесть, но только в том случае, если женщина ранее не имела опыта их использования либо использовала КОК с сомнительным лечебным эффектом.
Агонисты ГнРГ в настоящее время представляют собой одну из наиболее эффективных и хорошо изученных групп препаратов для лечения гиперпластических процессов репродуктивной системы, в том числе эндометриоза. Изначально агонисты ГнРГ создавались как лекарственные средства, обладающие большей активностью и длительностью действия по сравнению с эндогенным ГнРГ. Однако длительное непрерывное введение агонистов ГнРГ обеспечивало лишь кратковременное повышение уровня гонадотропинов, а затем синтез и секреция фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) снижались. Этот парадоксальный эффект оказался полезным в лечении гормонозависимых гинекологических заболеваний.
Описан блокирующий эффект агонистов ГнРГ на рецепторы эпидермального фактора роста [9], под их влиянием в эндометриоидных гетеротопиях активизируются процессы апоптоза. Агонисты ГнРГ в экспериментальных исследованиях достоверно редуцируют экспрессию сосудистого эндотелиального фактора роста, что уменьшает ангиогенез и, следовательно, пролиферативный потенциал тканей. Таким образом, действие агонистов ГнРГ, в их числе бусерелина, направлено не только на создание гипоэстрогенного статуса, но и на локальные пролиферативные процессы и ангиогенез, представляющие не менее значимое звено патогенеза эндометриоза.
Побочные эффекты агонистов ГнРГ, обусловленные гипоэстрогенией, могут купироваться дополнительным назначением так называемой терапии прикрытия (add-back therapy). Терапия прикрытия снижает частоту и выраженность побочных реакций, сопровождающих применение агонистов ГнРГ, не влияя на их эффективность. Вопрос о времени ее инициации не решен. В Северной Америке рекомендуется использование терапии прикрытия с первой инъекции агониста ГнРГ. Однако большинство женщин хорошо переносят лечение и не нуждаются в дополнительном назначении лекарственных средств. Мы считаем, что назначать препараты для купирования симптомов гипоэстрогении и предотвращения потери МПК необходимо в группах риска женщинам с исходной вегетативной дисфункцией или остеопенией, а также в случаях, когда симптомы, нарушающие качество жизни, появились на фоне применения агонистов ГнРГ. В качестве средств терапии прикрытия можно использовать тиболон (гестагенный препарат, обладающий также анаболической, слабой андрогенной и эстрогенной активностью) или комбинированные монофазные низкодозированные эстроген-гестагенные препараты для заместительной гормональной терапии.
