
Распространенным эндокринным нарушением считается гиперандрогения и характеризуется такая патология повышенным производством мужских половых гормонов в организме женщины. Происходит такой процесс в яичниках и надпочечниках, и последствия его могут быть весьма плачевными. Гиперандрогения и бесплодие — это два взаимосвязанных понятия, ведь такое патологическое состояние считается одним из ведущих факторов не вынашивания беременности.
Симптомы патологии
Гиперандрогения сопровождается развитием необратимых явлений в яичниках, что вызывает появление кистозных образований. Повышенное производство андрогенов в женском организме становится причиной ановуляции, когда в середине цикла из яичника не выходит яйцеклетка, и развивается бесплодие. В том случае, если беременность все же наступает, то чаще всего она прерывается в первом — втором триместре.
Нарушается работа яичников, и проявляется это в нарушении менструального цикла. В некоторых случаях наблюдается такое патологическое состояние, как аменорея, когда месячные полностью отсутствуют. Гиперандрогения может сопровождаться появлением следующей симптоматики:
- образование обильного волосяного покрова по мужскому типу на руках и ногах;
- выпадение волос и появление залысин в области лба;
- снижение тембра голоса;
- изменение пропорций женского тела;
- появление на лице сильной угревой сыпи.
При нарушении функционирования такого главного эндокринного органа, как гипофиз, и у женщины развивается ожирение.
Причины развития недуга
Гиперандрогения у женщин может развиваться под воздействием следующих факторов:
- адреногенитальный синдром;
- опухоли надпочечников различного характера;
- производство большого количества мужских половых гормонов в яичниках;
- сбои в работе органов эндокринной системы;
- опухоли яичников.
Нередко такое заболевание развивается при высокой чувствительности кожи к такому мужскому гормону, как тестостерон.
Полечите на почту 8 народных рецептов при гиперандрогении
Беременность при патологии
Многие специалисты говорят о взаимосвязи двух таких понятий, как гиперандрогения и бесплодие. При высоком уровне мужских половых гормонов в организме женщин появляется проблема с зачатием, ведь такая патология негативно отражается на состоянии яичников. На ранних этапах развития патологии замедляется процесс созревания яйцеклетки и наблюдается процесс уплотнения яичника. Происходят изменения во внутренней структуре органа и создаются благоприятные условия для образования большого количества кист. Даже при созревании яйцеклетки в яичнике она не может из него выйти, и оплодотворение становится невозможно.
Иногда зачатие все же наступает, но понятия беременность и гиперандрогения просто несовместимы. Именно по этой причине в скором времени происходит ее самопроизвольное прерывание на ранних сроках либо плод перестает развиваться. Гиперандрогения практически всегда заканчивается бесплодием, и при желании женщины родить ребенка необходимо пройти обязательное лечение.
Гиперандрогения считается сложным патологическим состоянием организма женщины, которое нуждается в медикаментозной терапии. Распространенными методами устранения такого заболевания являются гормональное лечение и хирургическое вмешательство. При появлении у женщины симптомов гиперандрогении важно как можно раньше обратиться за консультацией к специалисту, что позволит провести эффективное лечение и тем самым повысить шансы на рождение ребенка.
Девочки, хочу разобраться с гормональной стороной не вынашивания. Нашла интересную статью на мой взгляд, но не совсем понимаю какие конкретно сдавать гормоны.
ТТГ, ДГЭА, 17-ОП, может еще что то сдавали.
Сдавала пролактин, тестостерон, ТТГ-2,18, ДГЭФ-С, Андростендион Они все в норме. 17-ОП не сдавала, но признаков типа оволосения и тд нет у меня.
Может посоветуете хорошего эндокринолога или гиниколога в Екатеринбурге, моя гормоны те что перечислила назначила и все, было 2 бхб и срыв имплантации при ЭКО, проблемы с иммункой и кровью есть, но вот на гормоны никто даже не смотрит из врачей. Да и по иммунке и крови я сама нашла докторов, до этого Г говорили про бхб так бывает.
Одной из основных причин прерывания беременности в первом триместре являются гормональные нарушения в организме матери. Наиболее значимыми из них являются: неполноценная лютеиновая фаза (вторая фаза менструального цикла) и гиперандрогения различного генеза (повышение содержания мужских гормонов в женском организме). Следует отметить, что при выраженных эндокринных нарушениях, как правило, наблюдается бесплодие. Для невынашивания же беременности характерны стертые формы гормональных нарушений.
Механизм прерывания беременности при неполноценной лютеиновой фазе менструального цикла связан как с недостаточным уровнем прогестерона, так и с изменениями, которые происходят в эндометрии при нарушении процессов секреторной трансформации, обусловленной недостаточностью продукцией прогестерона. В эндометрии наблюдается недоразвитие желез, стромы сосудов, недостаточное накопление гликогена и других веществ, необходимых для развития плодного яйца. Эти изменения создают неблагоприятные условия для развития трофобласта и питания зародыша, что обуславливает прерывание беременности в первом триместре либо развитие плацентарной недостаточности при прогрессировании беременности.
Существует и другая точка зрения: неадекватное развитие плодного яйца не стимулирует нормальный уровень продукции прогестерона. Снижение уровня прогестерона в крови ведет к угрозе прерывания беременности с развитием кровотечения. Такое состояние корректируется путем назначения Дюфастона или Утрожестана с 6-8 недель беременности до 13 недель с последующим снижением дозы препарата к 16 неделям, т.к. к этому сроку гестации сформировавшаяся плацента начинает продуцировать прогестерон. Прогестерон – гормон желтого тела яичника, способствующий пролонгированию беременности и нормальному ее течению.
Вторым аспектом гормональных нарушений является гиперандрогения. Гиперандрогения может быть яичниковая, надпочечниковая или смешанная.
При гиперандрогении – андрогены влияют на плод во много раз агрессивнее, чем лекарства, которыми можно снизить их уровень, особенно тяжело сказывается избыток андрогенов на развитие плода женского пола. Однако, для того чтобы правильно назначать те или иные препараты и, главное, подобрать нужные дозы и длительность лечения, необходимо знать источник избытка андрогенов.
Если источник повышенных андрогенов являются надпочечники, то в крови находят высокий уровень 17 – гидроксипрогестерона (17- ОП) и/или дегидроэпиандростерона (ДЭАС). Если повышены эти гормоны или хотя бы один из них, это означает что есть генетически передаваемое заболевание – адрено-генитальный синдром (АГС). Однако, степень тяжести этого заболевания чрезвычайно варьирует от легких, стертых форм, до очень тяжелых, при которых вопрос о беременности практически не возникает. Если у вас повышен уровень 17-ОП, то у вас есть дефект гена, ответственного за фермент 21 – гидроксилаза. Клинически это выражается в явлениях вирилизации – строение тела по мужскому типу (герсутизм – оволосение по мужскому типу), нарушение менструального цикла – цикл более длинный, чем у женщин не имеющих этого заболевания. Тяжесть этих проявлений также определяется степенью выраженности дефекта 21 – гидроксилазы; от незначительных до очень тяжелых, когда трудно понять перед тобой женщина или мужчина. Если женщина имеет стертые проявления заболевания и имеет практически регулярный цикл, у нее может наступить беременность – самостоятельно. При избытке андрогенов, мало эстрогенов (женских половых гормонов), беременность прерывается по типу — неразвивающейся беременности, но это не самое страшное. Адрено- генитальный синдром — генетически передаваемое заболевание, и ребенок может получить от мамы этот измененный ген. У плода будет избыток своих адрогенов и плюс адрогены матери. Для мальчика это не катастрофично, но он будет небольшого роста из-за раннего созревания от избытка адрогенов. А для девочки это катастрофично, у нее формируются половые органы под влиянием не эстрогенов, а адрогенов – формируется урогенитальный синус и очень большой клитор, напоминающий половой орган мальчика. И опять степень тяжести определяется степенью дефекта гена. Хуже бывает, когда ребенок получает дефектные гены от обоих родителей — гомозиготная форма заболевания. Это заболевание протекает очень тяжело. Чтобы уменьшить патологическое влияние на плод адрогенов, назначается дексаметазон. Он активнее, чем преднизолон /метипред, т.к. проникает более активно через плаценту и более эффективно обеспечивает защиту от андрогенов. Доза дексаметазона ничтожно мала (не более 0,5 мг-0,35мг), более часто назначают ¼ или ½ часть таблетки. Отдаленные результаты показали, что эта доза не оказывает патогенного действия на плод. Этот препарат не вызывает пороков развития, не обладает токсическим действием на плод. А после рождения у девочки, если она получит дефектный ген АГС от родителей, будут те же проблемы что и матери – избыток мужских гормонов и, чтобы иметь ребенка, ей придется принимать гормоны, До открытия причин этого заболевания, пациентки с этой патологией практически не рожали, т.к. у таких женщин привычное невынашивание или бесплодие и они не рожали себе подобных.
С внедрением методов диагностики и лечения за 40 последних лет — женщины с гиперандрогенией смогли стать матерями, но их дочери имеют те же проблемы и в популяции растет число женщин с этими проблемами. Убрать дексаметазон можно будет только тогда, когда врачи научатся менять дефектный ген.
Источником андрогенов могут быть яичники при заболевании, которое называется – синдром поликистозных яичников (СПКЯ). При этом заболевании отмечается высокий уровень тестостерона и для женщин с этой патологией характерно бесплодие. Лечение проводят либо стимуляцией овуляции, либо оперативным путем проводят клиновидную резекцию яичников. Чтобы овуляция была более полноценной, также назначается дексаметазон. Дексаметазон не убирает тестостерон, но уменьшает андрогены надпочечников, снижается общий уровень андрогенов и овуляция будет более полноценная и возможно наступление беременности.
При наступлении беременности у женщин с яичниковой гиперандрогенией — дексаметазон не назначают, хотя уровень 17-КС может быть повышен. Но если вы обратились к врачу уже с беременностью, а по уровню 17-КС в моче невозможно определить источник андрогенов, то врач назначает дексаметазон, т.к. 67% женщин с гиперандрогенией имеют сочетанный источник андрогенов – нарушен метаболизм гормонов и в яичниках, и в надпочечниках. Длительность лечения и дозы подбирают индивидуально, в зависимости от уровня андрогенов, т.е. с учетом степени тяжести заболевания.
Споров по поводу приема глюкокортикоидов при гиперандрогении нет. Это четко установленный факт и это лечение проводится во всем мире одинаково.
Таким образом при гиперандрогении надпочечникового генеза, связанного с увеличением ДЭА (прием дексаметазона продолжают до 16 недель беременности), при гиперандрогении яичникового генеза до 20-24 недель беременности, а при смешанной форме гиперандрогении дексаметазон назначается до 33-35 недель беременности. У этих пациентов беременность может осложняться гипертензией (повышением артериального давления) и развитием токсикоза второй половины беременности. У всех пациентов с гиперандрогенией есть критические периоды в течение беременности, обусловленные началом гормональной продукции у плода: 13, 24, 28 недель беременности. В процессе беременности необходим контроль состояния шейки матки, т.к. у 2/3 пациенток развивается истмико-цервикальная недостаточность (размягчение и укорочение шейки матки с раскрытием внутреннего зева, ведущее к угрозе прерывания беременности, преждевременным родам). Важно отметить о необходимости проведения профилактики плацентарной недостаточности с первых недель беременности.
Избыток андрогенов часто приводит к ановуляции и гирсутизму. У женщин андрогены синтезируются в яичниках и надпочечниках, а также образуются из других стероидных гормонов в периферических тканях.
О продукции яичниковых и надпочечниковых андрогенов судят соответственно по уровню общего тестостерона и дегидроэпиандростерона сульфата в сыворотке. Если уровень общего тестостерона превышает 200 нг%, а уровень дегидроэпиандростерона сульфата — 600 мкг%, больную необходимо обследовать на предмет андрогенсекретирующей опухоли. Быстрое нарастание уровня андрогенов при таких опухолях нередко сопровождается андрогенетической алопецией, гипертрофией клитора, изменением тембра голоса и увеличением мышечной массы. Уровень свободного тестостерона повышен практически у всех больных с гирсутизмом, поэтому его диагностическая ценность невелика.
Часто при гирсутизме, в том числе и сопровождающемся нарушениями овуляции, уровень андрогенов не повышается.
Таким женщинам ставят диагноз конституционального гирсутизма. Избыточный рост волос у них связан с повышенной чувствительностью рецепторов волосяных фолликулов к андрогенам и усилением периферической конверсии тестостерона в более активный дигидротестостерон. Если гирсутизм и нарушения менструального цикла сочетаются с повышением уровня тестостерона в сыворотке, то у больной гиперандрогения яичникового происхождения, чаще всего обусловленная синдромом поликистозных яичников. В основе этого заболевания лежит дисфункция гипоталамо-гипофизарно-яичниковой системы. Стойкое повышение уровня ЛГ стимулирует синтез тестостерона в строме яичников. Избыток андрогенов в яичнике приводит к атрезии фолликулов и ановуляции.
Недавние исследования показали, что гиперандрогения яичникового происхождения часто сочетается с гиперинсулинемией, обусловленной инсулинорезистентностью. Как правило, гиперинсулинемия не приводит к нарушениям углеводного обмена. Однако, по последним данным, у 30% больных со временем развивается нарушение толерантности к глюкозе, а у 7-10% — инсулинонезависимый сахарный диабет. У 70% больных удается вызвать овуляцию с помощью кломифена.
Препарат назначают в дозе 50 мг/сут внутрь с 5-го по 9-й день менструального цикла, а на 7- 10-й день после его отмены наступает овуляция. Если кломифен не помогает, назначают препараты гонадотропных гормонов парентерально. Недавно показано, что сахаропонижающие средства, повышающие чувствительность периферических тканей к инсулину, снижают уровень андрогенов и вызывают овуляцию. Обычно с этой целью применяют метформин и производные тиазолидиндиона, подавляющие глюконеогенез и повышающие чувствительность клеток к инсулину.
Ред. проф. Дж. Нобеля

Гиперандрогения у женщин — что это, причины и лечение
Гиперандрогения – это патология, при которой гормональный фон женщины претерпевает значительные изменения. Происходит выработка слишком большого количества гормона андроген, который считается мужским. В организме женщины данный гормон выполняетмножество необходимых функций, однако его чрезмерное количество приводит к неприятным последствиям, лечение которых обязательно.
Вырабатываются андрогены у женщин адипоцитами, надпочечниками и яичниками. Данные половые гормоны напрямую влияют на процесс полового созревания у женщин, появление волосяного покрова в области гениталий и подмышками. Андрогены регулируют работу печени, почек, а также влияют на мышечный рост и репродуктивную систему. Они необходимы зрелым женщинам, поскольку синтезируют эстроген, поддерживают на достаточном уровне либидо и укрепляют ткани костей.
Что это такое?
Гиперандрогения у женщин – собирательный термин, который включает в себя целый ряд синдромов и заболеваний, сопровождающихся абсолютным или относительным повышением концентрации мужских половых гормонов в крови женщины.
Причины возникновения
Можно выделить следующие главные причины данного синдрома:
- наличие опухолей надпочечников;
- неправильная выработка особого фермента, синтезирующего андрогены, в результате чего происходит их чрезмерное накопление в организме;
- патологии щитовидной железы (гипотериоз), опухоли гипофиза;
- заболевания и сбои в работе яичников, провоцирующие излишнюю выработку андрогенов;
- ожирение в детском возрасте;
- длительный прием стероидов во время профессиональных занятий силовыми видами спорта;
- генетическая предрасположенность.
При нарушениях работы яичников, увеличении коры надпочечников, гиперчувствительности клеток кожи к воздействию тестостерона, опухолях половых и щитовидных желез возможно развитие патологии и в детском возрасте.
Врожденная гиперандрогения иногда не позволяет с точностью установить пол родившегося ребенка. У девочки могут отмечаться большие половые губы, увеличенный до размеров пениса клитор. Внешний вид внутренних половых органов соответствует норме.
Одной из разновидностей адреногенитального синдрома является сольтеряющая форма. Заболевание носит наследственный характер и обычно выявляется в первые месяцы жизни ребенка. В результате неудовлетворительной работы надпочечников у девочек появляется рвота, диарея, судороги.
В старшем возрасте гиперандрогения вызывает избыточный рост волос по всему телу, задержку формирования молочных желез и появление первых месячных.
Классификация
В зависимости от уровня мужских половых гормонов в крови выделяют гиперандрогению:
- абсолютную (концентрация их превышает нормальные значения);
- относительную (уровень андрогенов находится в пределах нормы, однако они усиленно метаболизируются в более активные формы либо же чувствительность к ним органов-мишеней значительно повышена).
В большинстве случаев причиной гиперандрогении является синдром поликистозных яичников. Также она имеет место при:
- адреногенитальном синдроме;
- синдроме галактореи-аменореи;
- новообразованиях надпочечников или яичников;
- гипофункции щитовидной железы;
- синдроме Иценко-Кушинга и некоторых других патологических состояниях.
- приеме женщиной анаболических стероидов, препаратов мужских половых гормонов и циклоспорина.
В зависимости от происхождения выделяют 3 формы этой патологии:
- овариальную (яичниковую);
- надпочечниковую;
- смешанную.
Если корень проблемы находится именно в этих органах (яичниках или коре надпочечников), гиперандрогению называют первичной. В случае патологии гипофиза, обусловливающей нарушения регуляции синтеза андрогенов, ее расценивают как вторичную. Кроме того, это состояние может передаваться по наследству либо же развиваться в течение жизни женщины (то есть являться приобретенным).
Симптомы гиперандрогении
Среди всех симптомов гиперандрогении у женщин преобладают следующие:
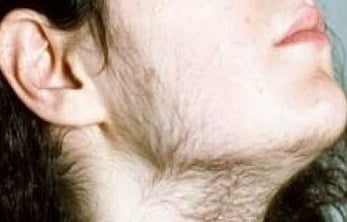
- Гирсутизм – избыточный рост волос у женщин, так называемое оволосение по мужскому типу, является самым частым признаком гиперандрогении. О нем можно говорить при появлении волос на животе по срединной линии, на лице, груди. Вместе с тем на голове возможны залысины.
- Следует различать этот симптом от гипертрихоза – избыточный рост волос, не зависимый от андрогенов, который может быть как врожденным, так и приобретенным (при различных заболеваниях, например при порфириях). Надо также обращать внимание на расовую принадлежность пациентки – так у эскимосок и женщин выходцев из среднеазиатских стран оволосение более выражено, нежели у женщин в Европе или Северной Америке.
- Сыпь на лице, акне, признаки шелушения. Часто такие дефекты на лице бывают в период подросткового возраста на фоне гормональной перестройки организма. При гиперандрогении у женщин косметические дефекты на лице длятся гораздо дольше, при этом ни лосьоны, ни кремы от этой проблемы не спасают.
- Опсоолигоменорея (укороченные и разделенные длительным промежутком месячные), аменорея (отсутствие месячных) и бесплодие – чаще всего данный симптом встречается при поликистозе яичников, сопровождающимся гиперандрогенией.
- Избыточный вес. Лишний вес у женщин становится частой причиной гормонального сбоя, при котором нарушается менструальный цикл.
- Атрофия мышц конечностей, мышц живота, остеопароз, атрофия кожи – наиболее характерно для синдрома Кушинга (или Иценко-Кушинга в русскоязычной литературе).
- Повышенный риск инфицирования. В результате гормонального сбоя нарушается функционирование многих органов и систем, что разрушительно сказывается на иммунитете, увеличивая риск попадания и развития инфекций.
- Нарушение толерантности к глюкозе – преимущественно при поражении надпочечников, часто так же и при патологии со стороны яичников.
- Формирование наружных половых органов промежуточного типа (гипертрофия клитора, мочеполовой синус, частичное сращение больших половых губ) – выявляется сразу после рождения или в раннем детском периоде; чаще при врожденной гиперплазии коры надпочечников.
- Артериальная гипертония, гипертрофия миокарда, ретинопатия (невосполительное повреждение сетчатки глаза).
- Депрессия, сонливость, повышенная утомляемость – связано кроме всего с тем, что нарушается секреция глюкокортикоидов надпочечников.
Синдром гиперандрогении может быть связан с некоторыми заболеваниями. Итак, среди причин повышенного уровня андрогенов можно выделить:
- Синдром гиперандрогении может быть связан с синдромом Кушинга. Причина развития данной патологии кроется в надпочечниках в результате избыточной выработки глюкокортикоидов. Среди симптомов данного заболевания можно выделить: округлое лицо, увеличенная шея, отложение жира в области живота. Могут наблюдаться сбои менструального цикла, бесплодие, эмоциональные расстройства, сахарный диабет, остеопороз.
- Синдром Штейна-Левенталя. При этом синдроме в яичниках образуются кисты, но не те, которые требуют немедленного оперирования, а временные. Характерным явлением для синдрома поликистоза яичников является увеличение яичника перед менструацией и уменьшение его после того, как месячные пройдут. При данном синдроме наблюдается отсутствие овуляции, бесплодие, повышенное оволосение, избыточный вес. Происходит нарушение выработки инсулина, в результате чего у больных может развиться сахарный диабет.
- Возрастная гиперплазия яичников. Наблюдается в достаточно зрелом возрасте у женщин в результате нарушения баланса между эстрадиолом и эстроном. Проявляется в виде гипертонии, сахарного диабета, избыточного веса, онкологии матки.
При гиперандрогении практически невозможно забеременеть в связи с отсутствием овуляции. Но все же иногда женщине удается зачать ребенка, но выносить его, к сожалению, становится невозможно. У женщины на фоне гиперандрогении случается выкидыш или происходит замирание плода в материнском утробе.
Гиперандрогения у беременных женщин
Гиперандрогения при беременности становится одной из самых распространенных причин развития самопроизвольного аборта, который чаще всего происходит на ранних сроках. Если это заболевание выявлено уже после зачатия и вынашивания ребенка, определить, когда оно точно возникло достаточно трудно. В данном случае врачей мало интересуют причины развития гиперандрогении, поскольку нужно предпринять все меры для сохранения беременности.
Признаки патологии у женщин в положении ничем не отличаются от симптомов, которые наблюдают в любое другое время. Невынашивание беременности в большинстве случаев связано с тем, что плодное яйцо не способно хорошо прикрепиться к стенке матки из-за гормонального дисбаланса в организме. В результате даже при незначительном негативном внешнем воздействии происходит выкидыш. Он почти всегда сопровождается кровянистыми выделениями из влагалища, тянущими болями внизу живота. Также такая беременность характеризуется не столь выраженным токсикозом, который присутствует у большинства женщин в первом триместре.
Осложнения
Спектр возможно осложнений при всех описанных выше заболеваниях крайне велик. Можно отметить только некоторые, самые важные:
- Метастазирования злокачественных опухолей – осложнение, более характерное для опухолей надпочечников.
- При врожденной патологии возможны аномалии развития, самые распространенные из них — аномалии развития половых органов.
- Осложнения со стороны других систем органов, которые подвергаются негативному влиянию изменения гормонального фона при патологии надпочечников, гипофиза и яичников: хроническая почечная недостаточность, патология щитовидной железы и т.д.
Этим простым перечислением список далеко не окончен, что говорит в пользу своевременного обращения к врачу, дабы предвосхитить их наступление. Только своевременная диагностика и квалифицированное лечение способствуют достижению положительных результатов.
Диагностика
Диагностика гиперандрогении у женщин в условиях клинической лаборатории:
- Определяется количество кетостероидов-17 в урине;
- Определение основного гормонального уровня. Выясняют, каково количество пролактина, свободного и общего тестостерона, дегидроэпиандростерона сульфата, андростендиона и уровня ФСГ в плазме крови. Забор материала производится утром, натощак. Из-за постоянного изменения гормонального фона, больным гиперандрогенией пробу делают трижды, с промежутками между процедурами 30 минут, затем все три порции крови смешивают. Дегидроэпиандростерона сульфат, в количестве более 800 мкг%, говорит о наличии андрогенсекретирующей опухоли надпочечников;
- Берут маркер на определение ХГ (в случае, когда признаки гиперандрогении есть, но основной уровень андрогенов остается нормальным).
Исследование инструментальное: больную с подозрением на гиперандрогению направляют на МРТ, КТ, внутривлагалищное УЗИ (для визуализации опухолевых образований).
Лечение гиперандрогении
Выбор лечения гиперандрогении во многом зависит от фонового заболевания, которое явилось причиной развития этого патологического состояния, а также от тяжести течения заболевания и выраженности лабораторных признаков гиперандрогении.
В связи с этим, ведение пациентов и определение тактики лечения должно быть преимущественно индивидуальным, с учетом всех особенностей каждой конкретной пациентки. Во многих ситуациях лечение гиперандрогении подразумевает проведение целого комплекса лечебных мероприятий как консервативного, так и оперативного направления.
Рекомендации, касающиеся образа жизни:
- нормализация массы тела;
- регулярные занятия спортом (хорошо подойдут ходьба, бег, аэробика и плавание);
- специальная гипокалорийная диета (объем потраченных калорий должен быть больше приобретенных).
- агонисты гонадотропин-рилизинг гормона (снижение выработки андрогенов и эстрогенов яичниками);
- эстроген-гестагенные препараты (стимуляция образования женских гормонов);
- антиандрогены (подавление избыточного выделения андрогенов как надпочечниками, так и яичниками);
- препараты с высоким содержанием гормона яичников (прогестерона).
Лечение сопутствующих патологий:
- заболевания щитовидной железы и печени;
- СПЯ (синдром поликистозных яичников), когда избыточная выработка мужских половых гормонов сопровождается отсутствием овуляции;
- АГС (адреногенитальный синдром).
- удаление гормонопродуцирующих опухолей.
Косметологические виды коррекции:
- обесцвечивание нежелательных волос;
- в домашних условиях — выщипывание и бритье;
- в салоне красоты — депиляция, электролиз, удаление волос с помощью воска или лазера.

Синдром поликистоза яичников, являющийся самой распространенной причиной яичниковой гиперандрогении, во многих случаях хорошо поддается консервативному лечению с применением целого спектра гормональных препаратов.
При синдроме Кушинга с признаками гиперандрогении у пациенток, страдающих онкологическими патологиями надпочечников, единственным эффективным методом лечения является хирургический.
Лечение врожденной гиперплазии надпочечников следует начинать еще в стадии внутриутробного развития ребенка, так как данная патология приводит к развитию тяжелой степени гиперандрогении.
В ситуации, когда гиперандрогения у пациентки является симптомом андрогенсекретирующей опухоли яичника, единственным действенным вариантом лечения является сочетание оперативной, лучевой и химиопрофилактической терапии.
Лечение женщин, страдающих гиперандрогенией в постменопаузальном периоде, заключается в назначении Климена по общепринятой схеме, обладающего выраженным антиандрогенным эффектом.
Меры профилактики
Профилактика заключается в следующем:
- регулярное (2-3 раза в год) посещение гинеколога;
- минимизация повышенных нагрузок (как психоэмоциональных, так и физических);
- отказ от вредных привычек (курение, злоупотребление алкоголем);
- сбалансированное и рациональное питание: отдайте предпочтение продуктам, богатым клетчаткой, и откажитесь от жареной и острой пищи, а также консервации;
- своевременное лечение заболеваний печени, щитовидной железы и надпочечников.

Дата публикации: 20.04.2017 2017-04-20
Статья просмотрена: 3212 раз
Актуальность данной темы базируется на частоте развития бесплодия на фоне гиперандрогении. Среди женщин с жалобами на гипоменструацию, невынашивание и наконец, бесплодие около 30 % страдают высоким уровнем андрогенов в крови.
Ключевые слова: бесплодие, гиперандрогенемия, андрогены
Бесплодие бывает различного генеза, чаще причиной являются хронические воспалительные заболевания женских половых органов [21,16,19,17,20,18]. Среди бесплодия эндокринного генеза, значительную роль занимает гиперандрогения.
Андрогены в организме женщины синтезируются рядом структур: надпочечники, яичники, периферические ткани, такие как печень, кожа, жировая ткань, мышечная ткань, урогенитальный тракт. К данной группе гормонов относятся — дигидроэпиандростерон, дигидроэпиандростерона сульфат, андростендион, тестостерон, андронстендион, дигидротестостерон.
В яичниках секретируется большее число тестостерона и андростендиона (около 50 %), а также ДГЭА около 10 %. Основная часть синтеза происходит в тека-клетках, то есть во внутренней оболочке фолликула, и частично — в строме. Регуляцию образования андрогенов яичников осуществляет лютеинизирующий гормон (ЛГ), а также под воздействием инсулина и соматотропного гормона синтез стимулируют внутриовариальные факторы роста.
Основная доля ДГЭА (90 %), весь ДГЭА-с и часть тестостерона синтезируется в надпочечниках. Дигидротестостерон образуется в перефирических тканях за счет воздействия фермента 5-альфа-редуктазы на тестостерон, ДГЭА, андростендион. [2]
Андрогены циркулируют в крови на 80 % связанные с СГСГ крови, 19 % — с альбумином, 1 % в свободном состояние. Данное явление физиологически обусловлено более сильной биохимической активностью свободных андрогенов, при повышение которых и формируется гиперандрогения. Андрогены реализуют свое действие на клеточном уровне, под действием ароматазы они превращаются в эстрогены.
Как уже отмечалось, гиперандрогения — это повышения уровня андрогенов в крови женщины с появлением характерных признаков. Причины развития данной патологии довольно разнообразны [3]:
– Сахарный диабет 2 типа
– Частые инфекционные заболевания
Гиперандрогения разделается на две основные формы: яичниковую и надпочечниковую. Каждая из них различна по происхождению, но их объединяет так называемый порочный круг (когда патологический процесс идет по кругу, без саморазрешения).
Наиболее распространенной причиной яичниковой гиперандрогенемии является СПКЯ (синдром поликистозных яичников), менее часто в следствие развития андроген-продуцирующей опухоли. [6] В настоящее время рассматривают две теории развития СПКЯ: нарушение секреции гонадотропин-рилизинг гормонов (Гн-РГ) в гипоталамусе и инсулинорезистентности.
Согласно центральной теории, нарушение выделения Гн-РГ ведет за собой нарушение секреции гонадотропинов в гипофизе. Это приводит к смещению соотношения ЛГ/ФСГ в сторону увеличения синтеза ЛГ. Гиперпродукция ЛГ приводит к избыточному синтезу андрогенов в тека клетках яичников, а не женских половых гормонов. В следствии этого происходит нарушение развития фолликула и эстродиол сохраняется на низком уровне. Ароматизация избыточных андрогенов вне яичников, приводит к увеличению уровня циркулирующих эстрогенов. В свою очередь это активирует механизм положительно обратной связи изменяет ответ гипофиза на Гн-РГ, что приводит к избыточному синтезу ЛГ. Так происходит замыкание порочного круга. Также в нарушение созревания доминантных фолликулов при СПКЯ принимает участие гипепродукция факторов роста (антимюллеровский фактор). Высокий уровень АФ приводит к изменению стероидогенеза за счет повышения андрогенов. [6]
Для пациенток с нарушением жирового обмена характерно развитие СПКЯ на фоне инсулинорезистентности. Частота встречаемости 35–60 % среди больних с СПКЯ. В этом случае нарушается утилизация глюкозы тканями, вследствие чего формируется гиперинсулинемия. Инсулинорезистентность обусловлена нарушением передачи инсулинового сигнала в клетку. Усиление синтеза андрогенов происходит вследствие повышения активности цитохрома Р450с17 на фоне гиперинсулинемии. Так же увеличение количества инсулина снижает синтез стеройдосвязывающих глобулинов в печени, что повышает уровень свободного тестостерона. Преобладание одного или другого механизма говорит о двух известных формах заболевания — СПКЯ с ожирением и СПКЯ без ожирения. При ожирении на фоне инсулинорезистентности повышается ЛГ-зависимый синтез андрогенов. При СПКЯ с нормальной массой тела повышен уровень гормона роста увеличивает синтез ИПФР (инсулиноподобного фактора роста), который в сочетании с высоким уровнем ЛГ повышает продукцию андрогенов в тека-клетках. [6]
Надпочечниковая форма гиперандрогении чаще всего является следствием андреногенитального синдрома. При данном синдроме развиваются ферментативные дефекты (дефицит 21-гидроксилазы, 3 гидроксилазы, ЗР-гидроксистероид-дегидрогеназы), приводящие к блокаде продукции глюкокортикойдов. Глюкокортикойды и андрогены надпочечников имеют общих предшественников (прегненолон, прогестерон, 17а-гидроксипрогестерон), соответственно снижение синтеза одних гормонов, приводит к увеличению других. Так же дефицит глюкокортикоидов по принципу отрицательной обратной связи увеличивает уровень АКТГ, который еще больше стимулирует синтез андрогенов. [1,5]
При врожденном АГС беременность протекает без особенностей. У новорожденной девочки отмечаются некоторые особенности в строение наружных половых органов — гипертрофированный или пенисообразный клитор, углубление преддверия влагалища, урогенитальный синус, высокая промежность, недоразвитие половых губ, а также различные изменения со стороны костно-мышечной системы. Наступает раннее половое созревание. К первому менархе в пре- и пубертатном периодах у больных появляются мужские вторичные половые признаки. Молочные железы недоразвиты, менструация отсутствует, рост матки замедлен, не происходит развития фолликулов и соответственно овуляции.
Сложной формой АГС для диагностики является скрытая. Вначале девочка развивается нормально, иногда отмечается низкий рост, половые органы развиты по женскому типу, могут быть слегка гипертрофированы. Однако после первого менархе, которое наступает в срок или с некоторым опозданием, развивается гипоменструальный синдром, а затем и аменорея. По мере нарастания гирсутизма молочные железы гипотрофируются, проявляется вирилизация фигуры. [1,5]
Основной причиной бесплодия при гиперандрогенемии является нарушение менструального цикла. Примерно у 50–70 % больных наблюдают проблему с менструацией, у 60–74 % из них зафиксировано бесплодие и у 21–30 % невынашивание. Клиника данной патологии включает аменорею, олигоменорею, менорагию, нарушение фертильности, болевой синдром. У ряда пациенток на первый взгляд с нормальным менструальным циклом отмечается нарушение овуляции, пролонгированние фолликулярной фазы, недостаточность лютеиновой фазы.
При осмотре больных с гиперандрогенемией отмечаются проявления вирилизации, наиболее выраженные при надпочечниковой форме. К вирилизации относят гипертрофию клитора, огрубение голоса (барифония), атрофию грудных желез, выраженный гирсутизм, андрогенную алопецию, маскулинизацию. [2]
Так же к клиническим проявлениям относят акне и себорея. Под действием андрогенов усиливается дифференцировка и митотическая активность эпидермиса, синтез липидов, увеличивается толщина эпидермиса. Андрогены увеличивают синтез кожного сала, стимулируют пролиферацию и созревание себоцитов.
Диагностика гиперандрогенемии включает несколько этапов — сбор анамнеза, осмотр, инструментальные методы (трансректальная сонография органов малого таза для оценки размеров и структуры яичников), лабораторные исследования, определение источника андрогенов. При сборе анамнеза необходимо выяснить возраст телархе, андронархе и менархе, характер менструаций, репродуктивный анамнез, гирсутизм, наследственный анамнез. [2]
– антропометрические показатели (рост, вес, ИМТ, окружность талии, окружность бедер);
– выраженность и распределение гирсутизма (шкала Ferrimana-Gallwey);
– строение наружных половых органов;
– гинекологический осмотр (размеры матки; пальпируемые образования, состояние слизистой оболочки)
– наличие акантозиз нигриканс (коричневая, иногда бородавчатая гиперпигментация на боковых и задней поверхностях шеи, в подмышечной области, под грудными железами, перианальной зоне, промежности — маркер инсулинорезистентности);
– пальпацию щитовидной железы и молочных желез
Ультразвуковое исследование используется для диагностики СПКЯ. К УЗ признакам относят — 8–12 фолликулов и более с диаметром 2–10 мм, увеличение овариального объёма, увеличение овариальной стромы. Дополнительно может быть проведена лапороскопия. [2]
Лабораторная диагностика включает гормональные исследования на 5–7 день цикла на уровень таких гормонов как — Т, ДГЭА-С, ПРЛ, ЛГ, ФСГ, 17-ОНП, (св.Т, СГСГ). Уровень свободного тестостерона может быть повышен при нормальном значение общего тестостерона, что исключает диагностическую ошибку. Так же необходимо определить уровень инсулина с нагрузкой для диагностики инсулинорезистентности.
Увеличение уровня ДГЭА-С в крови свидетельствует о гипепродукцию андрогенов надпочечниковой природы, если значения достигают высоких цифр необходимо исключить опухолевую природу синдрома.
Повышение концентрации ЛГ и изменение соотношения ЛГ/ФСГ более 2,5 выявляется у 70 % женщин с гиперандрогенемией, однако соотношение менее 2,5 не является критерием исключения данной патологии. Увеличение уровня ЛГ так же имеет значение в оценки репродуктивной функции организма, так как обуславливает снижение овуляторных процессов и предрасположенность к выкидышам. [2]
Исследование 17-ОНП используется для скрининговой диагностики адреналовой гиперандрогении вследствие дефицита 21-гидроксилазы (поздняя форма ВДКН). Диагноз поздней формы ВДКН ставится сразу,если уровень 17-ОНП в повторном тесте выше 8 нг/мл, в случае если значение оказывается в диапазоне от 2 до 8, то проводят дополнительное исследование на уровень АКТГ.
Существует несколько тестов позволяющих точно определить локализацию патологического процесса. Один из них супрессивный дексаметазоновый тест, который заключается в исследование крови до нагрузки в первый день и через день после нагрузки дексаметозоном. Увеличение уровня тестостерона на 40 % и ДГЭА-с и кортизола на 60 % свидетельствует о надпочечниковом генезе, если тестостерон остается в норме — яичниковый генез. В случае если тестостерон повышается менее чем на 40 % ставится смешанная форма. Снижение уровня кортизола говорит о возможной гиперфункции надпочечников (синдром Кушинга, опухоль).
К стимуляционному тесту с гонадотропин-рилизинг гормоном обращаются для определения яичниковой формы и включает в себя дексаметазоновый тест. На фоне супрессированной продукции андрогенов НП вводится ГТ-РГ (нафарелин). О яичниковой форме говорит повышение уровня 17-ОНП. [2]
После диагностики формы гиперандрогенемии проводят соответствующее лечение. При андреногенитальном синдроме лечение начинают с подавления высокого уровня АКТГ. Для этого используют препараты глюкокортикоидов (дексаметазон) с контролем уровня кортизола. Если на фоне терапии не наступает овуляции (неклассическая форма или недостаточность лютеиновой фазы) назначают кломифен-цитрат или кломид по общей схеме с 5 по 9 или с 3 по 7 день менструального цикла. Данный препарат имеет два противоположных эффекта: слабый эстрогенный и выраженный антиэстрогенный. Но следует отметить, что не следует прекращать терапию дексаметазоном, так как эффект кломифен-цитрата наступает только при снижении синтеза андрогенов надпочечниками. При наступлении беременности отмена приема глюкокортикоидов может привести к самопроизвольному выкидышу или прекращению развития оплодотворенной яйцеклетки. Если в дни предполагаемой овуляции сохраняется недостаточность фазы желтого тела, то дополнительно назначают препараты ФСГ и ЛГ. Если пациентка не планирует беременность в ближайшее время, то применяют терапию оральными контрацептивами с антиандрогенным эффектом (Диане-35, Ярина, Джес и т. д.). Так же эти препараты обладают выраженным антигирсутическим действием. С этой целью дополнительно назначают антогонисты андрогенов (флутамид, ципротерон-ацетат, финастерид, кетоконазол и т. д.). [3]
Во время лечения СПКЯ, то есть яичниковой формы гиперандрогенемии вначале необходимо восстановить овуляторный цикл и фертильность, устранить проявления дермопатий, нормализовать вес. [3]
При наличии ожирения (ИМТ > 25 кг/м 2 ). Прежде чем назначать препараты снижающие массу тела, необходимо скорректировать диету. Пища должна быть низкокалорийной, содержащая не более 25–30 % жира, 55–60 % медленноусвояемых углеводов, 15 % белков от общей калорийности. Ограничить употребление соли. Так же необходимы регулярные физические нагрузки. [3]
Независимо от массы тела большинство больных с СПКЯ имеют инсулинорезистентность. Для купирования данного синдрома назначают бигуаниды (метформин). Метформин снижает уровень глюкозы в крови и повышает чувствительность тканей к инсулину. Бигуаниды нормализуют массу тела, менструальный цикл, уменьшают уровень тестостерона. [3]
Ко второму этапу относят восстановление овуляции, но только после нормализации массы тела. Для стимуляции овуляции назначают кломифен, если данная терапия не эффективна в течение 6 месяцев, то пациентку считают резистентной к данному препарату и назначают препараты ФСГ. Это наблюдается у 20–30 % больных. Аналоги ГнРГ применяют при повышенном уровне ЛГ. Так же применяют оральный контрацептивы, как было сказано выше.
Если консервативное лечение не дает положительных эффектов, то прибегают к хирургическим методам лечения. К показаниям для хирургического вмешательства относят: сочетание СПКЯ с маточными кровотечениями и гиперплазией эндометрия, при критическом повышение уровня ЛГ без наличия ожирения, женщины старше 35 лет не зависимо от массы тела. [3]
Таким образом, было выяснено, что гиперандрогенемия сложный патологический процесс, имеющий высокую роль в патогенезе бесплодия. Причины развития данного синдрома довольно разнообразны, каждая из них требует определенного лечения. Необходимо учитывать то, что лечение гиперандрогенемии заключается не только в снижение уровня андрогенов, а в поэтапной терапии, начинающейся от лечения причины повышения андрогенов.
- Богатырева Е. М., Кутушева Г. Ф. Проблемы гиперандрогенемии надпочечниково генеза у девочек // Вестник Российской Военно-медицинской академии. -2015. № 3. -С. 273–279.
- Боткина Т. В. Комплексная оценка состояния репродуктивной системы у женщин с гиперандрогенемией. — Томск:, 2001. — 23 с.
- Гусейнова З. С. К вопросу об осбледование женщин с гиперандрогенией и неразвивающейся беременностью в анамнезе // Проблемы женского здоровья. — 2010. — № 4. — С. 60–67.
- Дубкова Е.А, Маринкин И. О., Соколова Т. М., Усова А. В. Взаимосвязь патологии щитовидной железы и синдрома поликистозных яичников у женщин с бесплодием // Новосибирский государственный медицинский университет. — 2013. -№ 4. — С.2.
- Дуда В. И. Геникология. — Минск: Харвест, 2004. — 560 с.
- Захарова И. И., Дворянский С. А. Сндром поликистозных яичников // Вятский медичинский вестник. — 2010. — № 4.
- Караева М. А., Орлова Е. М. Адреногенитальный синдром: прошлое, настоящее и будущее // Проблемы эндокринологии. — 2011. — № 1. — С. 66–70.
- Колесникова Л. И., Даренская М. А., Лабыгина А. В., Шипхинеева Т. И. Особенности теченничя бесплодия у женщин двух популяций // Бюллетень ВСНЦ СО РАМН. — 2011. — № 5. — С. 53–59.
- Малышева О. Г., Агаркова Л. А., Бухарина И. Ю. Гиперандрогения у беременных: этиопатогенез, диагностика, лечение, перинатальные исходы // Бюллетень ВСНЦ СО РАМН. — 2013. — № 5. — С. 46–52.
- Малышева О. Г., Агаркова Л. А., Логвинов С. В. Гиперандрогения и беременность // Международный журнал прикладных и фундаментальных исследований. — 2013. — № 2. — С. 21–22.
- Манушева Р. А., Черкезова Э. И. Синдром гиперандрогенемии у женщин // Медицинский совет. — 2009. — № 3. — С. 19–24.
- Мурашко Н. В., Данилова Л. И. Синдром гиперандрогении у женщин репродуктивного возраста: клиника,дифференциальный диагноз. — Минск:, 2010. —120 с.
- Сидельникова В. М. Подготовка и ведение беременности с привычным невынашиванием беременности. — 3-е изд.-М.: МЕД-пресс-информ, 2013.- 228 с.
- Соболева Е. Л. Этиология, патогенез, клиника и лечение синдрома поликистозных яичников // Лечение и профилактика. — 2012. — № 1. — С. 88–98.
- Третьякова О. С., Заднипряная О. И., Заднипряный И. В. Гиперандрогения как базис формирования беслодия и акне у женщин репродуктивного возраста // Оригинальные статьи. — 2015. — № 3. — С. 65–71
- Петров Ю. А. Сонографические аспекты диагностики хронического эндометрита// Казанский медицинский журнал.-2011. Т.92. № 4. –С. 522–525.
- Петров Ю. А. Роль иммунных нарушений в генезе хронического эндометрита //Вестник Российского университета дружбы народов. Серия: Медицина. -№ 6. — С. 282–289.
- Петров Ю. А. Результаты иммуно-микробиологической составляющей в генезе хронического эндометрита //Вестник Волгоградского государственного медицинского университета. -2011. -№ 3. –С.50–53.
- Петров Ю. А. Эффективность сонографической диагностики хронического эндометрита// Вестник Российского университета дружбы народов. Серия: Медицина.- 2011. -№ S5. -C. 248–253.
- Радзинский В. Е. Патогенетические особенности макротипов хронического эндометрита /Радзинский В. Е., Петров Ю. А., Калинина Е. А., Широкова Д. В., Полина М. Л.//Казанский медицинский журнал. — 2017. –Т.98. -№ 1. –С.27–34.
- Радзинский В. Е., Петров Ю. А., Полина М. Л. Хронический эндометрит в современной перспективе // Казанский медицинский журнал. -2012. –Т.93. –№ 1. –С. 178.
